IgA腎炎
| A+醫學百科 >> 疾病百科 >> 炎症 >> IgA腎炎 |
IgA腎炎(IgA glomerulonephritis)是以反覆發作性肉眼或鏡下血尿,腎小球系膜細胞增生,基質增多,伴廣泛IgA沉積為特點的原發性腎小球疾病。1968年Berger首先描述本病,故又稱Berger病。此外,又被稱為IgA-IgG系膜沉積性腎炎和IgA系膜性腎炎等。
IgA腎病也可解釋為腎活檢免疫熒光檢查腎小球系膜區有大量顆粒狀IgA沉積為特徵的原發性腎小球疾病。
目錄 |
診斷
本病須經腎活檢證實方可診斷。但在腎小球系膜區中有較明顯的IgA沉積的疾病很多,應注意鑒別。最常見應列入鑒別的有:過敏性紫癜和紫癜性腎炎、系統性紅斑狼瘡和肝源性腎小球硬化症等。此外還有強直性脊柱炎、類風濕關節炎、混合性結締組織病和感染後關節炎等膠原病;谷蛋白腸病、潰瘍性結腸炎和局限性腸炎等腸道疾病;皰疹樣皮炎和銀屑病等皮膚病;肺癌、喉癌、粘液腺癌、IgA丙球病、蕈樣真菌病和非何杰金淋巴瘤等腫瘤病;周期性嗜中性粒細胞減少症、混合性冷球蛋白血症、免疫性血小板減少症和紅細胞增多症等血液病;以及特發性肺含鐵血黃素沉著症、結節病、後腹膜纖維化、澱粉樣變性、重症肌無力、麻風、HIV感染和薄基底膜腎病等也應列入鑒別。
治療措施
迄今為止,本病尚無滿意的治療方案。對本病伴有進行性腎功能減退者使用腎上腺皮質激素伴或不伴免疫抑制劑的結果並不一致。最近的資料提示對蛋白尿超過1g/d者,施以隔日用藥的腎上腺皮質激素對蛋白尿的改善有益。對有IgA沉積的微小病變腎病則有可能緩解蛋白尿。合併使用環磷醯胺、潘生丁和華福林可減輕蛋白尿而對腎小球濾過率無影響;合併使用環孢素A也可減少蛋白尿,然也降低肌酐清除率。苯妥英鈉、抗血小板藥物、色苷酸二鈉、二苯基海因等藥物的療效不肯定。雖有報導尿激酶可有保護腎小球濾過率的作用,但遠不能定論。反覆發作扁桃體炎者,扁桃體切除可能是有益的;抗生素預防和治療感染對一些以急性腎炎症候群和急性腎衰為表現者可能有幫助。一個較小系列觀察發現使用魚油製劑具有減少蛋白尿和增加腎小球濾過率的作用。嚴重IgA腎病(腎小球濾過率每月下降2~4ml/min)使用大劑量免疫球蛋白靜脈滴入期間,可停止腎小球濾過率下降,改善血尿和蛋白尿,可是停藥後常複發。對有高血壓和重度蛋白尿的病例,使用轉換酶抑制劑可減慢腎小球濾過率下降速率和減少蛋白尿,所以在重症IgA腎病中,轉換酶抑制劑是首選降壓藥。對血壓正常者轉換抑制劑能否有效尚不清楚。
終末期IgA腎病者接受腎移植後,移植腎很快發生系膜區IgA沉積;若供腎者有亞臨床IgA腎病,植入非IgA腎病尿毒症者後,供腎系膜區IgA沉積物常迅速消失。移植腎伴複發性IgA腎病並不必然發生進行性腎衰,然而腎移植後所施免疫抑制治療,包括環孢素A也並不能阻止其發展。對屍體腎移植而言、1年和3年移植腎存活率可達87%和77%,然而個別有抗HLA抗原的IgA抗體的IgA腎移植者,2年移植腎存活率可達100%,有理由認為這些抗HLA抗原的抗體對增加移植腎存活率起了有益的作用。
發病機理
本病發病機理並未闡明。由於本病病人皮膚和肝臟中都能檢測到IgA沉積,提示為系統性疾病。由於在腎小球系膜區和毛細血管均可有顆粒狀IgA和C3沉積,提示其免疫複合物性發病機理。現時的研究圍繞著抗原通過粘膜的能力、粘膜屏障是否存在缺陷;IgA結構是否有缺陷和免疫調節功能是否有缺陷等方面展開。早年的研究曾提示本病所沉積的IgA可能是粘膜源性的。然而近年的研究使用了高度專一性的技術,證實本病所沉積的是IgA1,主要是系統源性的,主要由骨髓和淋巴系統所產生;粘膜源性的IgA2則主要見於肝源性腎小球硬化症中的IgA沉積中。在本病病人循環中也可見到總IgA1和含IgA1的免疫複合物增高,骨髓中產生IgA1的漿細胞增多並形成多聚體為主。在本病的腎組織中可發現存在J鏈,故提示沉積的IgA是多聚體;而分泌塊則十分罕見。儘管如此,現有資料尚不能最終確定本病的IgA沉積物的來源。
眾多的抗原,包括多種病毒和多種食物的抗原可在本病病人的系膜區中被檢出,並常常伴有IgA1沉積。這些抗原的抗體也屬IgA1。由於這些抗體也可存在於正常人的循環中,上述抗原並無專一性或特徵性。
有證據提示本病存在免疫調節異常。本病的含IgA1循環免疫複合物中,發現有多聚的IgA1類風濕因子;抗α重鏈Fab片斷的IgG抗體增多而IgM抗體減少。有趣的是HIV感染者也存在類似的抗免疫球蛋白模式,卻不發生腎臟IgA沉積。這證明單單這些循環的自身抗體存在,並不是系膜IgA沉積的原因。此外目前還發現了二種抗內皮細胞的自身抗體(屬IgG)。本病腎組織中常有C3沉積,提示激活了補體旁路途徑。然而IgA本身無激活補體的能力,IgA免疫複合物雖可激活補體旁路途徑,但它結合補體和C3b的能力很弱。通常認為在腎臟發生補體激活和形成膜攻擊複合物,需有IgG-IgA複合物,但是本病腎組織中有IgA和C3沉積而沒有IgG或IgM沉積卻很常見。因此,本病補體激活的機制尚不清楚。細胞免疫也參與了發病機制。已發現本病可有T輔助細胞(CD4)增加和T抑制細胞(CD8)減少;具有轉換IgM合成為IgA合成的Ta4細胞增加,與之有關的Sa1等位基因的頻度也增加;引起IgA同型轉換的TGFβ、促進產生IgA的B淋巴細胞分化的IL-5和介導IgA產生的IL-4形成均有增加。雖然T細胞和B細胞均參與了增加IgA合成的過程,但IgA合成增多並不是系膜區IgA沉積的原因,因為在IgA多發性骨髓瘤病人中罕見有組織IgA沉積。因此,結構-免疫學/理化異常才可能是系膜IgA沉積的原因。
本病病人血清和系膜中可檢出抗牛血清白蛋白多克隆基因型抗體,其滴度與血尿相關。最近,有人用從病人腎皮質和腎小球中獲得的IgA得到了5種單克隆抗基因抗體,它們與病人血清或漿細胞反應差,而與其腎臟組織有很高的反應率,提示腎臟的沉積是與這些多克隆IgA抗體的異常性質有關。此外,在本病病人中發現有β1,3-半乳糖轉移酶缺陷,改變了IgA1或含IgA1的複合物清除率,導致IgA1在系膜區沉積。
綜上所述,抗原的沉積,伴或不伴細胞介導的免疫應答,IgA複合物形成速度和具有IgAFc受體的系膜細胞或嗜中性粒細胞的清除效率參與了整個發病機制,而細胞因子和生長因子則主要參與了系膜增生和硬化的機制。
病理改變
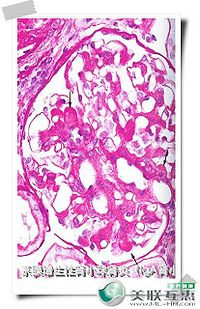
本病的典型病理表現在光鏡下常見系膜細胞增生、基質增多,常呈局灶節段性分布。輕微者則只有輕微系膜增生,亦可呈瀰漫增生(常有局灶節段性加重)。約20%病例可出現新月體,通常不超過30%腎小球。若新月體超過50%腎小球,則為急進性IgA腎病。免疫熒光鏡下,可見在腎小球系膜中呈瀰漫分布的顆粒或團塊狀IgA沉積物(主要是IgA1)。約60%~90%的病例伴C3和IgG沉積,但強度較弱。IgM沉積則報導不一。IgA輕鏈以λ為主,有J鏈,無分泌塊。通常無C1q和C3沉積。電鏡下幾乎都可見到細小均一的顆粒狀電子緻密物,分布於系膜區;若在上皮下或內皮下出現,則常病情嚴重。上皮細胞足突常正常。進行性病例可見球囊基底膜變形、裂解;腎小球基底膜「溶解」。世界衛生組織接受的分型標準附於文後。
流行病學
世界各地報導的發病率有很大差別,似以西太平洋地區為最高。日本報導占活檢證實的腎小球疾病的50%,而歐洲約為10%~30%,美國則不到2%。我國各地報導也不盡相同,約在20%~30%左右。這種差別顯然也受到各地腎活檢指征和尿液普查的影響,例如英國一般報導在5%左右,然而蘇格蘭地區,一組無症状血尿活檢中則達到37%。本病以男性為多見,男女比例約為2∶1。種族間存在著差別,例如美國新墨西哥地區印第安人中佔35%,黑人中卻十分罕見。雖然發現黑人中IgA2m(1)明顯低於白人,但未能證明這與發病率低有肯定關係。自1978年以來,有一些報導提示本病有家族中高發傾向,提示至少在某些IgA腎病病人中存在著基因的易感性。HLA分析發現與Bw35和DR4有關。最近的一組因IgA引起的終末期腎衰中的分析提示B27和DR1頻度增高而DR2頻度下降。
臨床表現
典型病例常在上呼吸道感染後數小時至2天內出現肉眼血尿,通常持續數小時至數天,個別可達1周。這類病人約佔總數的40%~50%,兒童中略高。個別可有嚴重的腰痛和腹疼,可能與腸道IgA血管炎有關。本病另一常見表現為無症状血尿和/或蛋白尿,約佔總數的30%~40%。其中20%~25%病例在病程中可發生1次或數次肉眼血尿。
腎病症候群可見於5%~20%的病人中,以兒童和青年病例為多,常屬瀰漫性增生型伴或不伴腎小球硬化。此外,有時系膜IgA沉積為主的現象也可以出現在以足突融合為特徵的微小病變腎病中。
約不到10%患者可呈急性腎功能衰竭表現,通常能自行緩解。其中20%~25%則可能需要透析,多因患有新月體腎炎。在病程活動期有氮質瀦留者並不少見,約佔25%。起病時即有高血壓約佔10%,然在30歲以後起病者中顯著增多;隨病程延長,伴高血壓者超過40%。
輔助檢查
鏡下血尿者,尿紅細胞以畸形者為主。約50%患者血清IgA增高,但與病情活動無關。血清IgA中λ輕鏈濃度增高。尿免疫球蛋白測定無特殊意義。血補體成分大多正常。某些補體成分或因子可能減少,主要見於有家族高發傾向病人中,但不具有診斷價值。約半數病人IgA-纖維連接蛋白聚集物測定值可有一過性增高,雖然有助於與其他腎病鑒別,但其與本病活動無關,故並無診斷價值。10%~15%病人可有IgA循環免疫複合物增高,32%病人有IgA類風濕因子水平增高。多項免疫學指標,包括病毒和食物抗原、抗體、T細胞亞群、HLA位點抗原等測定結果可有改變,但均無診斷價值。50%病人前臂掌側皮膚活檢中可見毛細血管內有IgA和C3等沉積。
預後
本病可有自發緩解,約佔4%~20%。每年約有1%~2%病例進入終末期腎衰。壽命表統計分析顯示10年腎存活率為80%~90%。估計最終發展成尿毒症者約35%左右。其餘為持續的血尿或蛋白尿。提示預後不良的因素有:起病時即有腎功能不全、蛋白尿超過1.5g/d、高血壓和無肉眼血尿;腎活檢有腎小球硬化、間質纖維化、腎小球毛細血管被侵犯、瀰漫增生和瀰漫新月體形成等。
飲食療法
1.蛋白質的供給。慢性腎炎的飲食治療應根據腎功能損害的程度來確定蛋白質的攝入量,如果病程長、腎功損害不嚴重者,食物中的蛋白質則不必嚴格限制,但每天不宜超過每公斤體重1克,優質蛋白質要達到50%以上。
2.由於部分病人限制了蛋白質,其熱能的供給要以碳水化合物和脂肪做為主要來源,能量供給視勞動強度而定。休息者,成人每日可供給126千焦耳~147千焦耳(30千卡~35千卡)/公斤體重。並要滿足病人活動的需要。
3.控制鈉鹽的攝入。嚴重水腫及高血壓時,鈉鹽的量要控制在2克/日以下,甚至給予無鹽飲食,一般以低鹽為宜。
保健
慢性腎炎的食物選擇:
1.要給予充足的維生素,尤其要補充維生素c,因為長期慢性腎炎的患者可有貧血,補充維生素c能增加鐵的吸收,所以應食用西紅柿、綠葉蔬菜、新鮮大棗、西瓜、心裡美蘿卜、黃瓜、西瓜、柑桔、獼猴桃和天然果汁等食品。
2.食慾差者可補充維生素c製劑;同時應多補充維生素b和葉酸豐富的食物,如動物的內臟,綠葉蔬菜等食品,有助於糾正貧血。高血鉀時要忌食含鉀高的食物,要慎重選用蔬菜和水果。慢性腎炎的病人要忌食糖類飲料和刺激性食品。
IgA腎炎的發病率
世界各地報導的發病率有很大差別,似以西太平洋地區為最高。日本報導占活檢證實的腎小球疾病的50%,而歐洲約為10%~30%,美國則不到2%。我國各地報導也不盡相同,約在20%~30%左右。這種差別顯然也受到各地腎活檢指征和尿液普查的影響,例如英國一般報導在5%左右,然而蘇格蘭地區,一組無症状血尿活檢中則達到37%。本病以男性為多見,男女比例約為2∶1。種族間存在著差別,例如美國新墨西哥地區印弟安人中佔35%,黑人中卻十分罕見。雖然發現黑人中IgA2m(1)明顯低於白人,但未能證明這與發病率低有肯定關係。自1978年以來,有一些報導提示本病有家族中高發傾向,提示至少在某些IgA腎病病人中存在著基因的易感性。HLA分析發現與Bw35和DR4有關。最近的一組因IgA引起的終末期腎衰中的分析提示B27和DR1頻度增高而DR2頻度下降。
相關研究
日本福岡大學醫學院第二病理室的Satoshi Hisano醫學博士為闡明鏈球菌感染後急性腎小球腎炎(PSAGN)和IgA腎炎(IgAGN)之間的臨床病理學差別,應用免疫組化比較了14例PSAGN兒童和20例組織學上與PSAGN相似的IgA腎炎患兒,觀察腎小球內的浸潤細胞數。
應用針對T細胞標記(CD3和CD45RO)、B細胞標記(CD20)、中性粒細胞標記(CD15)、巨噬細胞標記(CD68)、四種巨噬細胞亞群(早期、急性期、慢性期和成熟炎症巨噬細胞標記)和增殖細胞核抗原(PCNA)的單株抗體,進行患者腎臟組織免疫組化研究。
按照從檢測到尿蛋白到腎活檢的時間,34例患者分成3組。腎小球內免疫陽性細胞以每個腎小球內細胞數目表示。
PSAGN患者腎小球內CD15、CD68和巨噬細胞亞群陽性細胞數比IgAGN患者多。在PSAGN組織中,隨時間推移,腎小球內浸潤巨噬細胞逐漸減少,而IgAGN中的巨噬細胞數在各期保持恆定。在IgAGN,單純急性期炎症巨噬細胞的腎小球內浸潤明顯。IgAGN患者腎小球內增殖巨噬細胞(PCNA陽性+CD68陽性)的數量和增殖巨噬細胞/總巨噬細胞的比例比PSAGN患者中的數值大。
隨訪中所有PSAGN患者尿液檢查正常,而IgAGN中18例持續尿檢異常。
他總結認為,浸潤巨噬細胞的成熟和增殖巨噬細胞的數量的差別與PSAGN和IgAGN患兒的臨床病理特徵差別有關。
|
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 關於「IgA腎炎」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |