醫學微生物學/B型肝炎病毒
| 醫學電子書 >> 《醫學微生物學》 >> 肝炎病毒 >> B型肝炎病毒 |
| 醫學微生物學 |
|
|
1963年Blumberq在兩名多次接受輸血治療的病人血清中,發現一種異常的抗體,它能與一名大利亞土著人的血清起沉澱反應。直到1967年才明確這種抗原與B型肝炎(簡稱B肝)有關,1970年在電子顯微鏡下觀察到HBV的形態,1986年將其列入嗜肝DNA病毒科。
目錄 |
一、生物學性狀
(一)形態與結構
1.大球形顆粒:亦稱Dane顆粒,它是一種由一個囊膜和一個含有DNA分子的核衣殼組成的病毒顆粒,直徑約42nm。核衣殼為20面體對稱結構。游離的核衣殼只能在肝細胞核內觀察到。血中Dane顆粒濃度以急性肝炎潛伏期後期為最高,在疾病起始後則迅速下降。 Dane顆粒表面含有HBsAg ,核心中還含有雙股有缺口的DNA鏈和依賴DNA的DNA多聚酶。目前認為Dane顆粒即完整的HBV(圖26-1)。
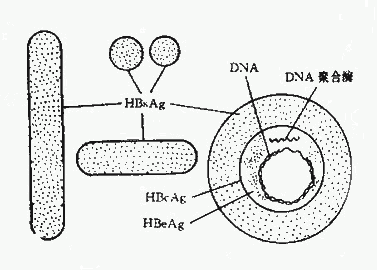
圖26-1 HBV病毒顆粒圖示
HBV DNA的兩鏈長短不一,長鏈(L)完整,為負鏈,長度恆定,約3200個核苷酸。短鏈(S)為正鏈,長度可變,約為長鏈長度的50~100%,鏈的增生按5′-3′順序進行。在不同分子中短鏈3′端的位置是可變的,而短鏈和長鏈的5′端位置固定點為粘性末端,通過250~300個核苷酸鹼基配對,以維持DNA分子的環狀結構。在粘性末端兩側,兩鏈5′端各有一個由11個bp組成的直接重複序列(Direct repeat DR)-5′TTCACCTCTCC,該DR位於第1824個核苷酸者稱DR1,位於第1590個核苷酸者稱DR2,在病毒複製中起作用。
2.小形球顆粒:直徑約22nm的小球形顆粒是HBV感染後血液中最多見的一種。它由HBsAg,即病毒的囊膜組成。化學組成為脂蛋白,可按其特有的密度與正常血清蛋白部分分離。在此顆粒中未檢出達DNA多聚酶活性。目前認為HBV的小顆粒不是HBV,可能是它感染肝細胞時合成過剩的囊膜而游離於血循環中。
3.管形顆粒:直徑約22nm,長度可在100~700nm之間。實際上它是一串聚合起來的小顆粒,但同樣具有HBsAg的抗原性。
(二)基因結構
目前,已可從感染HBV病人的血清中及感染肝臟提純的病毒核心中分離出環狀雙股DNA,從而確定HBV屬DNA病毒。
研究Dane顆粒DNA結構發現,DNA分子含有約3,200個核苷酸。它包括兩個鏈;一個長度固定的負鏈和另一長度不定的正鏈。由於DNA生物合成是在多聚酶作用DNA引子生長末端3′-OH與加入的脫氧核苷酸的5'-磷酸基形成磷酸二脂鍵完成的,因此,鏈的增生按5'-3'順序進行,而且加到鏈上的每種脫氧核苷酸是按模板DNA的鹼基配對互補規律進行,長鏈在1,800或1,818核苷酸附近有一個製品。短鏈的5'-末端通過長達250-300個核苷酸的鹼基配對而維持分子的環狀結構。DNA多聚酶作用不斷延長短鏈3′端以修補缺口。缺口可能與HBV的DNA在感染細胞內的整合有關。
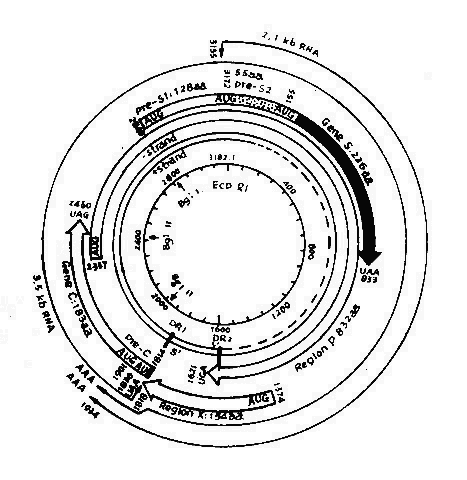
圖26-2 HBV病毒基因圖示
目前,由於克隆化DNA完整核苷酸已經確定,現已證實HBsAg和HBcAg都是由Dane顆粒的DNA所編碼,並且二類基因存在同一DNA分子上。有人比較病毒基因編碼能力和病毒多少,發現HBv DNA負鏈能編碼全部已知的HBV蛋白質,而其正鏈開放讀碼區,不能編碼病毒蛋白。
HBV DNA負鏈有四個開放區,分別稱為S、C、P及X(圖26-2),能編碼全部已知的HBV蛋白質。S區可分為二部分,S基因和前S基因。S基因(核苷酸155~833)能編碼主要表面蛋白。S基因之前是一個能編碼163個胺基酸(2,848-154)的前S基因,編碼Pre S1和Pre S2蛋白。C區基因包括前C基因和C基因,分別編碼HBeAg和HBcAg。P區最長,約佔基因組75%以上,編碼病毒體DNA多聚酶。X區(核苷酸1,374~1,835)可能編碼有154個胺基酸的鹼性多肽,長鏈的裂口位於此區。
(三)HBV的抗原組成
1.HBsAg:HBsAg是由HBV的基因組所特定的,為上述三種形態的顆粒所共有。
HBsAg 抗原活性屬於高浮力密度範圍內的脂蛋白類。用CsCl密度梯度離心,表面抗原(小顆粒和管狀顆粒)平均密度為1.20g/cm2。Dane顆粒的密度略高,為1.25g/cm2。純化的22nm顆粒的平均沉降係數為33-54S,分子量約為24-2.5×106。
純化的HBsAg 含有類脂質、糖類、脂質、蛋白質及糖蛋白。它由8種多肽組成,定名為P1至P8。其中至少有二種或三種多肽過碘酸Schiff試驗陽性,提示存在糖類結構。用紫外分光光度計檢查提取的HBsAg,顯示有典型的蛋白吸收光譜。蛋白佔總量的70~90%以上,廣義的HBsAg 由三種蛋白組成:(1)主要表面蛋白(S蛋白,小分子HBsAg),由S基因編碼的226個胺基酸組成。(2)中分子蛋白(中分子HBsAg),由前S2、S基因編碼,在S蛋白226個胺基酸的N端附加一個含55個胺基酸的Pre S2蛋白組成,共281個胺基酸。(3)大分子蛋白(大分子HBsAg),由S,前S1和前S2基因編碼,在中分子蛋白281個胺基酸的N端附加一個含119個胺基酸的PreS1蛋白組成,共400個胺基酸。
S蛋白即狹義HBsAg,是HBV囊膜的主要表面抗原的主要成份,包括糖基化的GP27和非糖基化的P24兩種形式,以二硫鍵相連形成二聚體,代表HBsAg的結構單位,具備完整的抗原性。如二聚體解離,則HBsAg抗原性將會明顯下降。
HBsAg 能刺激機體產生相應抗體—抗HBS,它是HBV的中和抗體,具有免疫保護作用,HBsAg的檢出是HBV感染的標誌之一。
前S蛋白2(Pre S2),的C端HBsAg端相連,Pre S2暴露於HBV囊膜外層,具有多聚人血清白蛋白 (Polymenized Human SerumAlbumin,PHSA)的受體(PHSA-R),能與PH-SA結合。由於肝細胞表面也有PHSA-R,HBV能通過血循環中存在的PHSA的介導,吸附到肝細胞表面,最後經胞飲作用進入肝細胞內。如病人血清中檢出Pre S2,表示HBV在肝細胞中複製。PreS2有良好的免疫原性,能刺激機體產生相應抗體—抗Pre S2。此抗體出現於急性感染恢復早期,比抗HBs出現早而維持時間與抗HBs一樣。抗PreS2具有中和作用,可作為機體康復的指標之一。
Pre S1有較強免疫原性,並能增強Pre S2和HBsAg 的免疫原性;Pre S1刺激機體產生相應抗體—Pre S1。該抗體有lgM和lgG兩種,其中抗Pre S1在HBV感染潛伏期,也就是在抗HBV~lgM出現前已產生,故可作為HBV早期感染的特異性指標。而抗Pre S1 lgG出現稍晚,在體內維持時間較長,具有中和作用。
HBsAg對一些促進變性的化合物,如乙醚、1:1氯仿一尿素、十二烷基硫酸鈉、吐溫30以及各種蛋白水解酶都很穩定。HBsAg在酸性下孵育幾小時仍很穩定。在鹼性下,冷凍融化不能使其滅活。表面的類脂質可能對於一些主要由蛋白組成的抗原決定簇起保護作用。
HBsAg具有幾種特異性抗原組分,包括各亞型共同抗原特異決定族a,和二組互相排斥的亞型決定簇d/y和 w/r。HBsAg的主要亞型有adr、adw、ayr及ayw4種。歐美各國adr、為主,我國漢族以adr居多中區地區及我國少數民族地區以ayw為主(西藏、新疆、內蒙等)。
2.HBcAg:HBcAg存在於Dane顆粒的核心和B型肝炎患者的肝細胞核內。HBcAg一般從HBcAg陽性屍檢肝或實驗感染的黑猩猩肝臟提取。在B型肝炎的急性期、恢復期和HBcAg攜帶者中常可測出抗~HBc。此抗體對病毒無中和作用。體內如發現HBcAg或抗~HBc表示HBV在肝內持續複製。
3.HBeAg:有關e抗原的本質還不十分清楚,但多數認為它是潛藏存在於Dane顆粒的核心部分。到目前為止,尚未在HbsAg陰性的血清中出現過。HBeAg是一種溶性抗原。抗原已知有三種亞型:e1,e2及e3。由於HBeAg與DNA多聚酶在血液中的消長相符,故HBcAg的存在可作為體內有HBV複製及血清具有傳染性的一種標記,血中HBsAg滴度越高,HBeAg的檢出率亦愈高。有些病人可出出現HBe抗體,可能也是一種有保護作用的抗體。
(四)HBV的培養
HBV的組織培養尚未成功。雖然近年來發展了從人胚肝獲得的分化膿細胞初代培養、製備半連續人肝細胞系和診斷性肝穿刺培養的成人胚組織的方法,但應用各種肝組織在體外培養HBV仍很困難。儘管用各種細胞和器官分離HBV的大膽嘗試,獲得一些「肝炎待定」病毒,但難以使其在組織培養中連續傳代,因而還沒有一個被公認是HBV。近來用提取HBv DNA進行傳染及通過細胞融合來拯救病毒的途徑發離HBV,仍未得到公認的結果。
南非學者(1976)報導了從一個HBsAg陽性原發性肝癌組織建立的細胞系(PLC/PRF/5)中找到HBsAg的複製。此細胞系的主要特點是能產生HBsAg 逐日上升。104/日細胞可產生500ng HBsAg ,免疫電鏡顯示大多數為22nm的顆粒,均為圓形,略有亞微結構。其抗原性與免疫性均與血液中的HBsAg相同。未見有Dane顆粒及管形。目前,此細胞系已用於體外研究病毒基因組表達的有用模型。
黑猩猩是HBV的易感動物,狨猴雖可感染但不如前者敏感。國外用黑猩猩研究HBV的發病機理,檢測自動免疫、被動免疫的效果以及HBV疫苗的安全性。但黑猩猩的來源短缺,難以廣泛應用。
(五)抵抗力
HBV對外界的抵抗力較強。對低溫、乾燥、紫外線和一般化學消毒劑均耐受。B肝病毒的傳染性和HBsAg的抗原性在對外界抵抗力方面完全一致。二者在37℃活性能維持7天,在-20℃可保存20年,100℃加熱10分鐘可使HBV失去傳染病,但仍可保持表面抗原活性。HBV對0.5%過氧乙酸、5%氯酸鈉和3%漂白粉敏感,可用它們來消毒。
二、HBV的致病性與免疫性
B肝的主要傳染源是病人和HBV抗原攜帶者。在潛伏期和急性期,病人血清均有傳染性。B型肝炎的傳播非常廣泛,據估計HBsAg攜帶者在世界上約有2億。由於他們不顯臨床症状,而HBsAg攜帶的時間又長(數月至數年),故成為傳染源的危害性要比患者更大。
HBV的傳染性很強,據報導,接種0.00004ml含病毒的血液足以使人發生感染。輸血或注射是重要的傳染途徑,也可口感染。外科和口腔手術、針剌、使用公用剃刀、牙刷等物品,皮膚微小操作污染含少量病毒的血液,均可成為傳染源。通過呼血吸昆蟲傳染B型肝炎亦有報導。近來有人報告在急性B型肝炎患者和慢性HBsAg攜帶者唾液標本中檢測到HBsAg及Dane顆粒,因此,HBsAg隨唾液經口傳播的途徑應當重視。孕婦在妊娠後期患急性B型肝炎,其新生兒容易感染此病。由於B型肝炎容易感染此病。由於B型肝炎患者和HBsAg攜帶者的精液、陰道分泌物均可檢出HBsAg ,因此,兩性接觸傳播B型肝炎的可能性是存在的。
(二)致病機理與免疫性
HBV的致病機理尚未完全明了。鑒於B肝臨床類型可表現為多種多樣(如急性肝炎、慢性活動性肝炎、慢性遷延性肝炎、重症肝炎及HBsAg無症状攜帶者),因而認為HBV的致病作用一般病毒不同。可能不是由於病毒在奪細胞內增殖而直接損害靶細胞,而很可能系通過機體對病毒的免疫反應而引起病變和症状。
1.特異性抗體:受B肝病毒感染後,機體可產生三種抗體,抗HBs、抗HBc 及抗HBe。抗HBs一般在感染HBV後4周出現,對B肝有保護作用。據報導,在712名醫務人員中,有抗—HBs者發生B肝的不到1%,而無抗—HBs者有11%發生肝炎。但抗HBs僅能作用於細胞外的HBV,在預防感染上較重要,而在疾病恢復時尚需細胞免疫協同作用。
抗HBc的出現反映了HBV新近感染及正在體內進行增殖,因此,它可用為HBV在體內複製的一個指標。抗HBc一般在感染後60~150天出現,往往在症状出現前或出現不久後即存在,比抗HBs出現要早31~87天,但不如抗~HBc存在持久。抗~HBc與肝中HBcAg量有關,慢性HBsAg攜帶者抗HBc滴度較低,慢肝活動期、肝硬化及肝癌患者則較高。滴度波動與病情呈平行關係,由於抗HBc在疾病恢復過程中不僅不升高、反而下降,因此,認為抗HBc與抗HBs不同,它與保護無關,而與病毒增殖和肝細胞損害有關。
抗Hbe能使病毒活力降低,可能有保護作用,但機制不一樣。
2.免疫複合物的損傷作用:在B型肝炎病人血循環中常可測出HBsAg—抗HBs的免疫複合物。免疫複合物可引起Ⅲ型變態反應,其中以關節炎和腎炎最為常見。在暴發性肝炎病從血中有時也可同時測HBsAg—抗HBs,這種病人預後不良,死亡率高。因此,認為免疫複合物可在肝外引起病人的一系列症状。如大量免疫複合物急性沉著於肝內,致毛細血管栓塞,則可能引起急性肝壞死而導致死亡。
3.細胞介導的免疫反應:目前認為HBV是非溶細胞性的,即不會增殖裂解被感染的細胞。因此,機體清除B肝病毒主要依賴T細胞(Tc,T殺傷細胞)或通過抗體介導的K細胞來殺傷靶細胞,將病毒釋放於體液中,以後再經抗體作用。實驗研究發現,凡轉為慢性肝炎者,一般T細胞數及功能較低下。因此,推測可能B型肝炎病人T細胞功能強弱與臨床過程的輕重和轉歸有關。Dudleuy認為,當T細胞免疫功能正常,受病毒感染的肝細胞不多時,B肝病毒很快被細胞免疫配合體液免疫予以清除,這時,由細胞免疫所造成的急性肝細胞損傷可完全恢復。如T細胞免疫功能低下,免疫反應不足以完全破壞被病毒感染的肝細胞,或亦不能產生有效的抗HBs,或即使抗HBs卻無法作用於細胞內的病毒,持續在肝細胞內的病毒可引起免疫病理反應而導致慢性持續性肝炎。如機體對病毒完全缺乏細胞免疫反應,既不能有效地清除病毒,亦不導致免疫病理反應,結果出現HBsAg 無症状攜帶症状。如果T細胞免疫功能過強,病毒感染的細胞又過多,細胞免疫反應可迅速引起大量肝細胞壞死,臨床上表現為暴發性肝炎。但上述學說尚未被完全證實,通過進一步的研究,多數人認為細胞免疫和體液免疫相互配合發揮免疫作用。因此,抗體介導的K細胞作用已日益受到重視,並認為是殺傷靶細胞的重要免疫機制。除上述T細胞作用低下外,還有人認為慢性活動性肝炎的發生與T細胞抑制性功能低下,Tc細胞或K細胞的殺傷功能過強有關,從而造成肝細胞持續損傷。
4.自身免疫反應:HBV感染肝細胞後,一方面可引起肝細胞表面抗原的改變,暴露出膜上的肝特異蛋白抗原(Liver specific protein:;LSP),另一方面可能因HBsAg含有與宿主肝細胞蛋白相同的抗原,從而誘導機體產生對肝細胞膜抗原成份的自身免疫反應。通過研究,發現確有部分B肝病人存在對LSP的特異抗體或細胞免疫反應。一般認為,如病人在病程中出現自身免疫反應,則可加強對肝細胞的損傷而發展成為慢性活動性肝炎。
5.B型肝炎與原發性肝癌:近年來,關於B型肝炎病毒感染與原發性肝癌的發生之間的關係,日益受到重視。國內外資料均提示肝炎患者的肝癌發病率比自然人群高。肝癌病人有HBV感染指示者也比自然人群高。Maupas等就HBV與原發性肝癌的密切關係作了以下論證:①B型肝炎傳染形成高度地方性的區域與原發性肝癌流行率高的地區,在地理上有相關性;②在地方性與非地方性區域,男性HBsAg慢性攜帶者中發生原發性肝癌的危險是相對恆定的。在此種人群中,原發性肝癌的年死亡率在250-500/10萬人。粗略估計全世界HBsAg慢性攜帶者約1.75億,原發性肝癌的年發生率為35萬例。這就指出與HBV相關的原發性肝癌是在全世界人口中較為流行的癌症之一;③HBV感染可先於並經常伴隨原發性肝癌的發生;④原發性肝癌常發生於與B型肝炎病毒有關的慢性腩炎或肝硬化的肝;⑤在原發性肝癌患者取出的組織中存在HBV的特異性DNA及抗原;⑥有些原發性肝癌細胞系已能在培養中產生HBsAg ,並已證明HBV的DNA已能整合到這些細胞的基因組中。此外,含有HBV相似的生物化學、生物物理特性,它在其宿主可誘發肝硬化及原發性肝癌。在中國和美國的北京鴨(Anas domesticus)中已分離出一種相似的病毒。但對上述資料解釋仍有不同觀點:①HBV能引起致癌或促癌作用,須配合其它如遺傳、內分泌、免疫與環境因素而導致肝癌;②肝癌是與HBV無關的因素引起,但這些癌細胞可能對HBV特別易感,以致持續攜帶病毒。
三、微生物學診斷
(一)B肝抗原與抗體的檢查法
目前已建立對HBsAg 、HBcAg及HBeAg及其抗體系統的檢測法。以放射免疫法及酶聯免疫法及酶聯免疫法最為敏感,其次為反向被動血凝及免疫粘附血凝法。免疫擴散與對流電泳法雖不甚敏感,但仍為我國廣泛採用。三種抗原體系統中以檢測HBsAg最為常用。
(二)檢測B肝抗原抗體的實際意義
1.HBsAg:血清中檢測到HBsAg ,表示體內感染了HBV,因而是一種特異性標誌。HBsAg陽性見於:①急性B型肝炎的潛伏期或急性期(大多短期陽性);②HBV致的慢性肝病、遷延性和慢性活動性肝炎、肝炎後肝硬化或原發性肝癌等。③無症状攜帶者。
2.抗HBs:表示曾感染過HBV,不論臨床上有無肝炎症状表現,均已得到恢復,並且對HBV有一定的免疫力。
3.HBcAg與抗HBc:由於HBcAg主要存在於肝細胞核內,並僅存在於Dane顆粒中。因此,對病人血清不能檢測HBcAg,而測抗HBc。血清內抗HBc陽性反映:①新近有過HBV感染;②體內有HBV增殖;③有助於診斷急性或慢性B型肝炎,特別是少數病例就診時已處於急性恢復期早期,HBsAg已從血中消失,此時血中僅有抗HBc存在,因此,對恢復期患者可作病因追索。
4.HBeAg和抗HBe:HBeAg的存在常表示病人血液有感染性。HBeAg陽性揭示病人肝臟可能有慢性損害,對預後判斷有一定幫助。抗HBe陽性對病人可能有一定的保護力。
(三)檢測B肝抗原與抗體的實際用途
1.篩選供血員:通過檢測HBsAg,篩選去除HBsAg 陽性的供血者,可使輸血後B肝發生率大幅度降低。
2.可作為B肝病人或攜帶者的特異性診斷。
3.對B肝病人預後和轉歸提供參考。一般認為急性B肝患者,如HBsAg持續2個月以上者,約2/3病例可轉為慢性肝炎。HBeAg陽性者病後發展成為慢性肝炎和肝硬化的可能性較大。
4.研究B肝的流行病學,了解各地人群對B肝的感染情況。
5.判斷人群對B肝的免疫水平,了解注射疫苗後抗體陽轉與效價升高情況等。
四、防治原則
目前,B型肝炎治療上比較肯定的藥物為α干擾素。國內外均有報導,經連續大劑量注射α干擾素半年後HBsAg轉陰的例子。但最近發現,一些轉陰後病人在停用干擾素後又轉為陽性。其他如胸腺肽、轉移因子治療慢性肝炎雖有報導,但效果欠佳。
近來,對B肝疫苗的研究及應用十分活躍。B肝基因工程(酵母重組HBsAg)疫苗已大規模投入應用並取得可喜的結果。多肽疫苗、融合蛋白疫苗和基因疫苗的研製方興未艾,相信經過多方努力,控制B肝的願望會成為現實。
參看
|
|||||||||||||||||||||||||||||||||
B肝科普知識
- 正確認識B肝:一種普普通通的疾病
- B肝病毒是怎麼傳播的?
- 如何看B肝兩對半化驗單
- 兩種『小三陽』攜帶,性質很不相同
- 「大三陽」的同學,你有苦惱嗎?
- B肝"小三陽"比"大三陽"的肝炎更要重視
- 轉氨酶升高,說明什麼?
- 不要耽誤抗病毒治療的時機
- 急性B型肝炎,無需抗病毒治療
- 如何選擇合適的抗病毒藥物
- 抗病毒好藥---替諾福韋
- 核苷類藥治療慢性B肝:何時到頭?
- 抗病毒藥物能治癒慢性B肝嗎?
- 抗病毒治療能使肝硬化逆轉,這是真的嗎?
- 慢性B肝病毒攜帶者該幹什麼?
- 與B肝患者討論幾個與「性」相關的問題
- B肝媽媽到底能不能給寶寶母乳餵養
- B肝患者能否懷孕生小孩
- 飲酒對肝臟有什麼傷害?
| 關於「醫學微生物學/B型肝炎病毒」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |