葡萄球菌感染
| A+醫學百科 >> 葡萄球菌感染 |
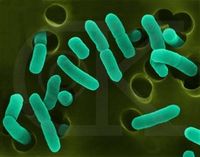
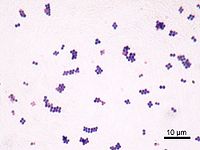
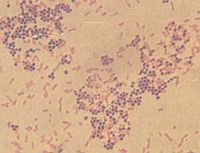
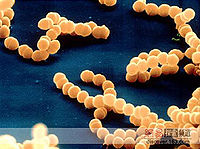
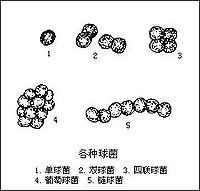
葡萄球菌感染是葡萄球菌引起的感染。葡萄球菌屬細球菌科,葡萄球菌屬,因其排列如葡萄串狀而得名。革蘭氏染色陽性。主要引起癤、癰、毛囊炎、肺炎、腦膿腫、肝膿腫、化膿性骨髓炎及傷口感染等。在自然界中分布廣泛,絕大多數不致病,僅少數引起人和動物的化膿性感染。
目錄 |
簡要介紹
葡萄球菌引起的感染。葡萄球菌屬細球菌科,葡萄球菌屬,
因其排列如葡萄串狀而得名。革蘭氏染色陽性。主要引起癤、癰、毛囊炎、肺炎、腦膿腫、肝膿腫、化膿性骨髓炎及傷口感染等。在自然界中分布廣泛,絕大多數不致病,僅少數引起人和動物的化膿性感染。其致病性隨細菌侵入途徑、菌量、毒力及機體免疫力不同而異。由於抗生素的廣泛使用,耐藥菌株逐年增加,目前金黃色葡萄菌對青黴素的耐藥率已高達90%,但對新型青黴素、慶大黴素和頭孢唑啉還比較敏感,體外實驗證明黃連、黃芩、連翹、大青葉、板藍根、蒲公英等對金黃色葡萄球菌有抑菌或殺菌作用。
病原體種類
根據細胞壁組成、血漿凝固酶和毒素產生的不同,葡萄球菌分為致病性的金黃色葡萄球菌(簡稱金葡菌)和非致病性(或條件致病性)的表皮葡萄球菌。
金黃色葡萄球菌
生物學特性:金葡菌呈球形,直徑0.48微米,排列成葡萄
串狀,無鞭毛,無芽孢,多數無莢膜。金葡菌的細胞壁有大量磷壁酸構成該菌的表面抗原,通過共價鍵與粘肽層的胞壁酸相連,在細胞膜的外面尚有膜磷壁酸,對維持胞膜穩定性和胞膜酶的激活都具有重要意義,胞壁可耐25個大氣壓。
金葡菌的營養要求不高,在普通瓊脂培養基上37℃、pH7.4左右經24~48小時後生長良好,金葡菌在有氧和CO、22℃以及培養基中含有牛奶奶油等情況下生長最好,在血瓊脂平板上產生菌落大,且絕大多數在菌落周圍可見溶血環。金葡菌在無芽孢菌中抵抗力較強,在乾燥衣服上可存活3~6個月。在乾的痰中,2~3個月後,仍可培養出菌來。金葡菌在10~15%NaCl溶液中可很好生長。純培養可抵抗1%酚溶液15分鐘,濃度增至2%才能殺死金葡菌。80℃經30分鐘可殺死本菌,但金葡菌對龍膽紫很敏感,血清培養基中含1:125000(濃度)龍膽紫即能抑制其生長。
金葡菌的變異可以自然發生,但與臨床關係密切的可能是藥物敏感性變異和菌落L型變異。也有對青黴素、苯唑青黴素(新型青黴素)、頭孢唑啉等多種藥物耐藥的菌株,這些
菌株又被稱為抗甲氧苯青黴素(新青)金葡菌(MRSA),這些菌株已構成對醫院內感染控制的威脅。產生耐藥性的途徑有二:①產生了分解抗生素中有效基因的誘導酶,如β內醯胺酶。②敏感菌株通過有關噬菌體轉導耐藥基因的質體而獲耐藥性。
另一種金葡菌的變異,是在一些慢性或反覆感染的病灶中分離出的金葡菌L型。這些變異型用常規方法檢查不出來,需通過特殊培養基,延長培養時間才能獲得。為此,臨床上懷疑金葡菌感染時,若培養陰性,要考慮到是否有變異為L型的問題。
金葡菌的噬菌體分型特異性不高,因為多數菌株能與兩種以上噬菌體起反應。
金葡菌株表面含有一種蛋白質成分,稱葡萄球菌蛋白質A(SPA),它結合於胞壁的粘肽部分,大約30%是金葡菌分裂的對數生長期產生的,若使用胰酶處理胞壁,可破壞SPA的活性。SPA在體外可抑制對金葡菌和大腸桿菌的吞噬;損傷血小板;對人的T和B淋巴細胞有無致分裂作用
,意見尚不一致。SPA對噬菌體吸附於金葡菌體的作用也有影響,它的含量與所吸附噬菌體量呈負相關,SPA含量低的菌株吸附噬菌體的能力大。
實驗室檢查 主要有以下幾種:
②培養和鑒定。將標本接種於血瓊脂平板、甘露醇和高鹽培養基上,根據菌落特徵、生物化學反應等進行鑒定。致病性金葡菌的主要特點為:產生金黃色色素、有溶血性、發酵甘露醇、凝固酶試驗陽性、皮膚壞死和動物致死性試驗陽性等。關於金葡菌的藥物敏感試驗,臨床常用紙片抑菌環法,亦有用測定青黴素酶的方法,但較複雜,不作為常規應用。
③血清學檢查。可用對流免疫電泳和被動凝膠擴散法,檢測病人血清中磷壁酸抗體。正常人滴度低,陽性率少,金葡菌感染患者血清中磷壁酸抗體滴度均≥1:4。用對流免疫電泳法檢查金葡菌抗原,有助於早期診斷,在腦脊液和胸水中能查到抗原,血中檢到者報導不多。
④毒素的檢查。用幼貓或猴做動物實驗,取含有毒素的剩餘食物對動物灌胃、腹腔或靜脈注射毒素來觀察動物是否出現噁心、嘔吐、腹瀉、寒戰等反應,或用免疫瓊脂擴散法、間接血凝法和反向間接血凝法、免疫螢光法及放射免疫法等血清學檢查均可檢出食物中腸毒素的含量。
表皮葡萄球菌
一般認為系條件致病菌。細菌性心內膜炎約有10%由此菌引起,免疫功能低下者也可出現此菌的菌血症。
毒素種類
主要有四種:
①溶血毒素。有、β、γ、δ四種,其中、β溶血毒素可損傷綿羊和人的
紅細胞,破壞人的血小板
②致剝脫性毒素。又稱皮膚溶解毒素,可導致皮膚病變,約5%金葡菌能產生此毒素。
③殺白細胞素。金葡菌的多種產物可以損傷白細胞,如毒素引起白細胞的顯著變化,δ毒素可使白細胞的核腫大,細胞隨即溶解。有一種殺白細胞素(P-V殺白細胞素),可引起白細胞運動功能喪失,細胞內顆粒丟失,導致細胞的破壞,P-V殺白細胞素對其他細胞無作用。P-V殺白細胞素的作用部位主要在細胞膜,開始時
細胞膜中三磷酸肌醇發生構型變化,隨後細胞通透性增高,造成鉀的丟失,其他變化有鈣蓄積、ATP酶受刺激等。受P-V殺白細胞素作用的嗜中性粒細胞,最初表現細胞偽足丟失,細胞變圓並輕度腫脹,同時伴有部分細胞顆粒脫出,細胞的多葉核變得較突出,隨後形成球形,最後輪廓消失,整個作用進行緩慢(20~30分鐘),細胞不立即溶解。
④腸毒素。金葡菌可產生A、B、C、D、E、F等多種腸毒素。金葡菌性食物中毒以A型腸毒素引起者最多。腸毒素對熱的抵抗力極強,加熱至100℃、30分鐘不能完全破壞,仍能使人致病,其中以B型最耐熱,C型次之,A型最差。
臨床表現
新生兒感染通常發生於出生後6周之內,最常見的是膿皰性或大泡性皮膚病損,一般位於腋下,腹股溝或頸部皮膚皺褶處;但多發性皮下膿腫(特別是乳腺),表皮剝脫,菌血症,腦膜炎或肺炎也可發生。化膿性病變顯微鏡檢查可發現嗜中性白細胞和革蘭氏陽性葡萄球菌,後者常位於嗜中
性白細胞內。
產後1~4周發生乳腺膿腫或乳腺炎的餵奶母親,應視為有耐抗生素葡萄球菌感染,很可能通過其嬰兒從嬰兒室傳入所致。
手術後感染可從縫線處膿腫直到廣泛的創口感染,一般由葡萄球菌感染所致。這種感染可出現於手術後數日或數周;若病人在手術時接受過抗生素,則感染的出現可能推遲。金葡菌感染中以化膿性感染為多見。
①化膿性感染,如癤、毛囊炎、癰、肺炎、心內膜炎、化膿性骨髓炎以及敗血症等。
②食物中毒,金葡菌污染食物後,在20~30℃經4~2小時繁殖併產生腸毒素,人進食帶有此毒素的食物1~5小時後,出現急性胃腸炎的症状,表現噁心、嘔吐和腹瀉。食物中毒主要由腸毒素引起,與細菌無關。造成食物中毒最小劑量的腸毒素是1~7.2g/kg體重。美國報告敏感人群攝入腸毒素<100ng就能引起發病,多數經1~2天後自愈,死亡罕見。治療主要是輸液以維持水和電解質的平衡,不需用。
③中毒性休克症候群(TSS),葡萄球菌腸毒素F和致熱原性外毒素C可以引起TSS,目前認為這兩種毒素為相似的糖蛋白,分子量均在22000,現總稱其為TSST-1。TSS最早在1978年報導了7例,均為8~17歲有外傷史的青少年,起病急,主要表現高熱、神志恍惚、猩紅熱性皮疹、腎功能衰竭、嚴重的低血壓,恢復期全身有大片脫皮,當時診斷不清。至1980年逐漸弄清TSS與經期用月經栓有關,患者90%為年輕的女性,有經期用月經栓史,陰道分泌物培養有金葡菌噬菌體型,亦有報告型的。當時死亡率很高,複發率有報告達30%。經調查,製造月經栓的工廠從1977年起將生產月經栓由棉花加人造纖維改為用吸水性能好的聚丙烯酸酯纖維。發病可能與之有關,目前還不太清楚其機理。亦有少數男性病人,因傷口感染而發生類似的病症。TSS病人血培養無金葡菌生長,而陰道分泌物培養陽性。
美國疾病控制中心對TSS診斷歸納5點:發冷發熱、猩紅熱樣皮疹、低血壓、多個臟器功能損害、恢復期有大片脫皮。
TSS的治療為:停用月經栓改用月經帶,輸液擴容糾正低血壓,用新型青黴素或頭孢唑啉,嚴重者可與氨基糖苷類合用。也可用激素等治療。關於TSS的預防,大力宣傳TSS的發病與月經栓有關,病人需停用月經栓。
易感人群
新生兒和餵奶的母親好發葡萄球菌感染,而流感,慢性支氣管肺部疾患(如囊性纖維性變,肺氣腫),白血病,腫瘤,器官移植,假體或其他異物,燒傷,慢性皮膚疾病,手術切口,糖尿病以及血管內塑料導管留置的病人,也容易受此菌感染。接受腎上腺皮質類固醇,放射治療,免疫抑制劑或抗腫瘤化療的病人,受感染的危險性也很大。易感病人可從自身其他帶菌部位或醫院工作人員獲得耐抗生素的葡萄球菌。經工作人員的手是最普遍的傳播方式,但也可經空氣傳播。
葡萄球菌肺炎
葡萄球菌肺炎是由葡萄球菌所引起的急性肺部化膿性感染。本病起病多急驟
,有高熱、寒戰、胸痛,痰為膿性,量多,帶血絲或呈粉紅色乳狀。病情重篤者可早期出現周圍循環衰竭。院內感染病例起病稍緩慢,但亦有高熱、膿痰等。肺部X線顯示肺段或肺葉實變,或呈小葉樣浸潤,其中有單個或多發的液氣囊腔。X線陰影的易變性是金葡萄肺炎的另一重要特徵。
病情較重,常發生於免疫功能已經受損的病人,如糖尿病、血液病(白血病、淋巴瘤、再障等)、愛滋病、肝病、營養不良、酒精中毒以及原已患有支氣管-肺病者。兒童患流感或麻疹時,葡萄球菌可經呼吸道而引起肺炎,若未予恰當治療,病死率較高。皮膚感染灶(癰、癤、毛囊炎、蜂窩組織炎、傷口感染)中的葡萄球菌亦可經血循環而產生肺部感染,細支氣管往往受阻而伴發氣囊腫,尤多見於兒童患者。膿腫可以潰破而引起氣胸、膿胸或膿氣胸,有時還伴發化膿性心包炎、胸膜炎等。
葡萄球菌性菌血症
可發生於任何與血管內導管或其他異物有關的局限性葡萄球菌膿腫或感染,它是嚴重燒傷病人死亡的常見原因。持續性發熱常見,而且可伴有休克。表皮葡萄球菌和其他凝固酶陰性的葡萄球菌,已成為與導管和其他異物相關的醫院菌血症的日益增多的原因。也是虛弱病人的發病率(特別是長期住院者)和死亡率的重要原因。
葡萄球菌性心內膜炎
特別好發於靜脈注射給藥者和裝有人工心臟瓣膜的病人。突然出現心臟雜音,膿毒性栓子和其他經典體征便可作出可疑診斷,確診需依據超聲心動圖和血培養。
葡萄球菌性骨髓炎
主要見於兒童,可引起寒戰,發熱和受累骨疼痛,繼之出現紅腫。關節周圍感染常引起關節積液,提示為化膿性關節炎而不是骨髓炎。白細胞計數常>15000/μl並且血培養常陽性。X線變化在10~14日內不明顯,骨質疏鬆和骨皮質反應甚至更長時間仍不能測出,而放射性核素骨掃描則常能較早出現異常。
免疫性
感染金葡菌後可以產生抗毒素,但抗毒素免疫主要是對毒素的中和作用,不能直接抑制金葡菌在體內繁殖,抗毒素和抗菌免疫不同。有人在1966年用菌細胞製劑的不同部分進行免疫研究,認為金葡菌的保護性抗原可能有兩種:一為耐熱的細胞壁成分,可以產生抗體,有特異調理作用。另一種成分是不耐熱對胰酶敏感的細胞蛋白抗原,使寄主產生非特異性保護作用。
預防措施
無菌措施(如檢查病人前後徹底洗手和消毒合用的器械)至關重要。已被感染的病人應與其他易感病人隔離,患有活動性葡萄球菌感染,即使是局部性的感染(如癤)的醫護人員,在其感染治癒前不得接觸病人或器械。無症状的鼻腔帶菌者,除非所帶菌株十分危險或被懷疑為暴發流行的傳染源,一般不必隔離。
治療方法
治療包括膿腫引流,抗生素(重症病人需腸外給藥)和全身支持療法。培養標本應在開始治療前或更換抗生素之前獲取。抗生素的選擇和劑量取決於感染的部位,疾病的嚴重程度和細菌對藥物的敏感性。
醫院獲得的葡萄球菌和大多數社區獲得的菌株,通常對青黴素G,氨苄青黴素和抗假單胞菌青黴素有耐藥性。大多數菌株對耐青黴素酶青黴素(甲氧苯青黴素,苯甲異惡唑青黴素,乙氧萘青黴素,鄰氯青黴素,雙氯青黴素),頭孢菌素(頭孢菌素Ⅰ,頭孢唑啉,頭孢菌素Ⅳ,頭孢拉定,頭孢羥唑,頭孢西丁和第三代頭孢菌素),卡巴培南類(亞胺培南,美羅匹寧),慶大黴素,萬古黴素,替考拉寧,林可黴素和氯林可黴素,是敏感的。雖然頭孢菌素和萬古黴素都有效,但通常首選一種耐青黴素酶的青黴素。很多葡萄球菌菌株對紅霉素,四環素類藥物,氨基糖苷類,桿菌肽和氯黴素也敏感,但因有更好更安全的藥可用,故很少使用氯黴素和桿菌肽。目前在美國,特別在第三級保健中心和大城市醫院,耐甲氧苯青黴素金黃色葡萄球菌(MRSA)菌株日益增多。這種細菌雖可從社區獲得感染的病人中分離得到,但多數是從感染的靜脈吸毒者和重症監護室的病人中分離獲得。MRSA菌株通常對耐β-內醯胺酶青黴素,頭孢菌素和卡巴培南類有耐藥性。實驗室的錯誤報告日益頻繁,報告稱這些細菌對頭孢菌素是敏感的,但實際上頭孢菌素治療MRSA感染不可靠。這些細菌對氨基糖苷類和大環內酯類(紅霉素,克拉黴素,阿齊黴素,林可黴素和氯林可黴素)的耐藥性也很普遍。雖然亞胺培南-西拉司丁或喹諾酮類對某些MRSA感染是有效的,但靜脈注射萬古黴素為首選。腎功能正常成人的通用劑量是每6小時靜脈注射500mg或每12小時靜滴注1000mg,至少在1小時內滴完。腎功能受損時,劑量應根據血清中藥物的濃度加以調整,療程視感染部位及病人的反應而定,但一般為2~4周。某些嚴重的或有併發症的感染,可能需要靜脈給藥治療6~8周,然後再口服治療1個月或更長時間。最近在日本和美國已發現對萬古黴素有中間耐藥性的MRSA菌株。
可用於替代萬古黴素治療MRSA感染的藥物有:TMP-SMZ,成人劑量為TMP10~15mg/(kg。D)加SMZ50~75mg/(kg。D),分劑口服或腸外給藥,每次間隔8小時或12小時,連續2~4周;利福平(600mg/d)口服或腸外給藥;腸外給亞胺培南-西拉司丁(500mg每6小時1次)或美羅匹寧(0。5~1。0g每8小時1次。但利福平不要單獨應用,因為細菌很易產生抗藥性。在治療異物相關性MRSA感染或漿膜腔MRSA感染時,利福平和氨基糖苷類是有用的輔助藥物。鄰氯青黴素,雙氯青黴素,TMP-SMZ,環丙沙星及局部用莫匹羅星(mupirocin)可用於治療MRSA帶菌狀態,但MRSA對這些藥物可產生抗藥性。
參考
健康問答網關於葡萄球菌感染的相關提問
| 關於「葡萄球菌感染」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |