放射治療
| A+醫學百科 >> 放射治療 |
腫瘤放射治療是利用放射線如放射性同位素產生的α、β、γ射線和各類x射線治療機或加速器產生的x射線、電子線、質子束及其它粒子束等治療惡性腫瘤的一種方法。
腫瘤放射治療(簡稱放療)就是用放射線治療癌症。放射治療已經歷了一個世紀的發展歷史.在倫琴發現X線、居里夫人發現鐳之後,很快就分別用於臨床治療惡性腫瘤,直到目前放射治療仍是惡性腫瘤重要的局部治療方法。大約70%的癌症病人在治療癌症的過程中需要用放射治療,約有40%的癌症可以用放療根治。放射治療在腫瘤治療中的作用和地位日益突出。放射治療已成為治療惡性腫瘤的主要手段之一。
放射療法僅有幾十年的歷史,但發展較快。由於超高壓治療機的使用,輔助工具的改進和經驗的積累,治療效果得到顯著提高,目前已成為癌症治療中的最重要手段之一。我國約有70%以上的癌症需用放射治療,美國統計也有50%以上的癌症需用放射治療。放射治療幾乎可用於所有的癌症治療,對許多癌症病人而言,放射治療是唯一必須用的治療方法。
成千上萬的人單用放射治療或並用放射治療、手術治療、化學治療和生物治療後,治癒了他們的癌症。醫生在病人手術前,可以用放射治療來皺縮腫瘤,使之易於切除;手術後,用放射治療來抑制殘存癌細胞的生長。
目錄 |
腫瘤與癌症
腫瘤分兩種,有良性和惡性之分,良性的叫腫瘤,惡性的就叫做癌。
簡單的說良性的稱為腫瘤,一旦發展到惡性的就稱為癌。
腫瘤一詞在醫學專著中的定義為:「腫瘤是人體器官組織的細胞,在外來和內在有害因素的長期作用下所產生的一種以細胞過度增殖為主要特點的新生物。這種新生物與受累器官的生理需要無關,不按正常器官的規律生長,喪失正常細胞的功能,破壞了原來器官結構,有的可以轉移到其它部位,危及生命。」腫瘤可以分為良性腫瘤和惡性腫瘤兩大類,而癌症則是一類惡性腫瘤。由於良性腫瘤對人體健康影響較小,所以下面著重介紹惡性腫瘤,特別是癌症。
惡性腫瘤從組織學上可以分為兩類:一類由上皮細胞發生惡變的稱為癌,如肺上皮細胞發生惡變就形成肺癌,胃上皮細胞發生惡變就形成胃癌等等;另一類由間葉組織發生惡變的稱為肉瘤,如平滑肌肉瘤,纖維肉瘤等。人們對癌聽得較多,而對肉瘤聽得較少,這與癌病人遠比肉瘤病人為多有關。臨床上,癌與肉瘤之比大約為9:1。
癌作為一類惡性腫瘤,是由人體內正常細胞演變而來的。正常細胞變為癌細胞後,就像一匹脫韁的野馬,人體無法約束它,產生所謂的「異常增生」。異常增生是相對於細胞的正常增生而言的。人體細胞有一個生長、繁殖衰老、死亡的過程。老化的細胞死亡後就會有新生的細胞取代它,以維持機體組織和器官的正常功能。可見,人體絕大部分細胞都可以生。但是這種正常細胞的增生是有限度的,而癌細胞的增生則是無止境的。正是由於這種惡性增生,使人體大量營養物質被消耗。同時,癌細胞還能釋放出多種毒素,使人體產生一系列症状。如果發現和治療不及時,癌細胞還可轉移到全身各處生長繁殖,最後導致人體消瘦、無力、貧血、食欲不振、發熱及臟器功能受損等,其後果極為嚴重。
五年生存率
醫學界為了統計癌症病人的存活率,比較各種治療方法的優缺點,採用大部分患者預後比較明確的情況作為統計指標,這就是醫生常說的五年生存率。
五年生存率系指某種腫瘤經過各種綜合治療後,生存五年以上的比例。用五年生存率表達有其一定的科學性。某種腫瘤經過治療後,有一部分可能出現轉移和複發,其中的一部分人可能因腫瘤進入晚期而去世。轉移和複發大多生在根治術後三年內,約佔80%,少部分發生在根治術後五年內,約佔10%。所以,各種腫瘤根治術後五年內不複發,再次複發的機會就很少了,故常用五年生存率表示各種癌症的療效。術後五年內,一定要鞏固治療,定期檢查,防止複發,即使有轉移和複發也能及早治療。另外,也有用三年生存率和十年生存率表示療效的。
放射治療的放射源
放射治療的放射源主要有放射治療機和放射性核素。
1、X線治療機
可分為X線治療機(10KV~60KV)、淺層治療機X線(60KV~160KV)和深部X線治療機(180KV~400KV)等不同能量射線。X線治療機的缺點是能量低,穿透力弱,皮膚受量大,現已較少使用。
2、醫用加速器
有電子感應加速器和電子直線加速器。前者輸出高能電子束,後者輸出高能電子束(8~14MeV,主要針對淺表層腫瘤)和高能X線(4~10MV,穿透力強,皮膚受量少)。醫用加速器中用得最多技術發展最快的是電子直線加速器。
3、放射性核素
226鐳為天然放射源,因其半衰期長,現已為人工放射性核素60 鈷、137銫、192銥所替代。放射性核素可放射a、ß、r三種射線,臨床上ß射線僅用於治療表淺腫瘤,r射線為放射治療的主要放射源,能量1.25MeV。
用60鈷製成的放射治療機,因r射線穿透力強、深部劑量高,皮膚受量少,適用於深部腫瘤的治療。
放射治療的種類
放射治療主要有兩種形式:體外和體內。某些病人接受兩種形式的放射治療。
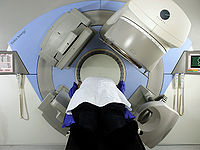
1、體外照射
體外照射又稱為遠距離放射治療。這種照射技術是治療時,放療機將高能射線或粒子來瞄準癌腫。用於體外照射的放射治療設備有X線治療機、Co60治療機和直線加速器等。60鈷治療機和直線加速器一般距人體80~100cm進行照射。單純從身體外部進行放射治療有一定的局限性,即使在足量照射的情況下,總有一部分腫瘤局部複發。
2、體內照射
體內照射又稱為近距離放射治療。這種治療技術把高強度的微形放射源送入人體腔內或配合手術插入腫瘤組織內,進行近距離照射,從而有效地殺傷腫瘤組織。治療技術涉及腔管、組織間和術中、敷貼等多種施治方式。這一技術發展很快,它可使大量無法手術治療、外照射又難以控制或複發的病人獲得再次治療的機會,並有肯定的療效。而正常組織不受到過量照射,以避免嚴重併發症,成為放射治療技術上的一個焦點。過去,後裝技術僅能用於婦科腫瘤治療,最新一代後裝治療機已把這種技術擴大應用到鼻咽、食管、支氣管、直腸、膀胱、乳腺、胰腺、腦等腫瘤。這種新技術與其他治療方法配合,逐步形成了很有發展前途的綜合治療手段,在應用中均取得了明顯的效果。
放射性粒子植入治療腫瘤,是指在B超或CT引導下,可精確地將放射性粒子均勻地置入腫瘤周圍,通過放射性粒子持續釋放射線來達到最大限度地殺傷腫瘤細胞的作用。
腫瘤放射性粒子置入治療由三個部分組成:
①放射性粒子,如198Au、125I和103pd。
②三維治療計劃系統,保證粒子置人後在空間分布上與腫瘤形狀、大小一致。
放射性粒子可通過術中置入,也可通過B超或CT引導下穿刺置入。放射性粒子置入具有創傷小、腫瘤靶區劑量分布均勻和對周圍正常組織損傷小、價格低廉、操作簡便等特點,臨床上有廣闊的應用前景,將造福於腫瘤病人。美國Cooper大學醫學中心放射治療學院用大分子白蛋白(MAA)作為"生物膠",可使注入瘤體內32p安全地瀦留在腫瘤內。此方法操作很簡單,在CT指導下醫生用帶有1cm塑料護手板的活檢穿刺針插入腫瘤中心,然後用兩套注射器,先注人生物膠MAA,再注入32P,藉助於壓力使注入物從腫瘤中心向邊緣擴散。此技術用於失去手術機會的胰腺癌、大腸癌肝內轉移和晚期頭頸部惡性腫瘤,可使腫瘤"融化消失"達數月之久。
放射治療的作用
所有細胞(癌細胞和正常細胞)都要生長和分裂。但是癌細胞的生長和分裂比他們周圍許多的正常細胞都要快。放射療法採用特殊設備產生的高劑量射線照射癌變的腫瘤,殺死或破壞癌細胞,抑制它們的生長、繁殖和擴散。雖然一些正常細胞也會受到破壞,但是大多數都會恢復。與化療不同的是,放療只會影響腫瘤及其周圍部位,不會影響全身。
1、放射殺傷癌細胞的機制
人們對手術和吃藥打針治療癌症的方式能做到直觀了解,故比較熟悉,但對放射殺癌的作用就不是那麼清楚了。放療之所以能發揮抗癌作用,是因為放射線承載著一種特殊能量,稱為輻射。眾所周知,輻射在自然環境中可以誘發癌變,而對於放療,輻射作為癌症的"殺手"。當一個細胞吸收任何形式的輻射線後,射線都可能直接與細胞內的結構發生作用,直接或間接地損傷細胞DNA。
(一)放療機制
直接損傷 主要由射線直接作用於有機分子而產生自由基引起DNA分子出現斷裂、交叉。
間接損傷 主要由射線對人體組織內水發生電離,產生自由基,這些自由基再和生物大分子發生作用,導致不可逆損傷。兩種效應有同等的重要性。
(二)腫瘤吸收劑量
既然放療的作用就是通過射線與癌細胞間能量的傳遞,引起癌細胞結構和細胞活性的改變,甚至殺死癌細胞,因此人們關心腫瘤組織內能量吸收的多少,即腫瘤的吸收劑量,這與療效有關。
射線的性質用射線的質和量來描述:
a、射線的質:表示射線穿透物質的能力,稱射線的硬度,用能量表示,如MV、MeV;
b、射線的量:表示放射線的強度,用居里或貝柯勒爾(Bq)表示。
射線的質和量決定於不同放射源(或放療機)的選擇。
射線與物質的相互作用。
吸收介質的性質:不同組織(或腫瘤)吸收程度差異較大。吸收劑量單位過去用拉德(rad),現用戈瑞(Gy)表示,且1Gy=100rad。
(三)腫瘤細胞的變化
放療過程中,腫瘤細胞群(瘤體)內會發生一系列的複雜變化,有的癌細胞死亡了,被消滅了;有的僅僅是"掛了彩",日後還會死灰復燃,捲土重來。科學家將這些變化歸納為放射治療的4個"R"(因下列4項名稱的第1個文字母均為R):
放射損傷的修復 受到致死損傷的細胞將發生死亡。而射線引起的所謂亞致死損傷及潛在致死損傷的細胞,在給予足夠時間、能量及營養的情況下,可以得到修復又"偷偷"活下來。
氧和再氧合作用 氧在輻射產生自由基的過程中扮演重要角色,細胞含氧狀態對放療殺傷作用有很大影響。放療對乏氧細胞殺傷力就減弱,對氧合細胞殺傷力明顯增強。腫瘤組織常有供血不足及乏氧細胞比率高的問題,部分癌細胞可逃避放射損傷,這是放療後腫瘤再生長及複發的常見原因之一。放療中,也有原來乏氧的細胞可能獲得再氧合的機會,從而對放療的敏感性增加。
細胞周期的再分布 癌細胞群的細胞常處於不同的細胞增殖周期中,對射線敏感也不一致。最敏感的是M期細胞,G2期細胞對射線的敏感性接近M期,S期細胞對射線敏感性最差。對於G1期的細胞來講,G1早期對射線的敏感性差,但G1晚期則較敏感。放療的敏感細胞被清除;引起癌細胞群中細胞周期的變動(再分布)。
細胞再增生 放療後細胞分裂將加快,腫瘤組織生長也比較快。考慮細胞有再增生作用,放療需要延長療程,增加總照射量,才能達到更滿意的治療效果。了解了上述癌細胞的"動向",有利於改進放療技術,更多的殺傷癌細胞。
2、放射治療的臨床應用
(一)根治性放療
根治性放療指應用放療方法全部而永久地消滅惡性腫瘤的原發和轉移病灶。放療所給的腫瘤量需要達到根治劑量。對放射線敏感及中度敏感的腫瘤可以用放射治療根治。在這類腫瘤的綜合治療方案中,放療也起到主要作用。
(二)姑息性放療
姑息性放療是指應用放療方法治療晚期腫瘤的複發和轉移病灶,以達到改善症状的目的。有時將姑息性放療稱為減症放療,用於下列情況:
止痛 如腫瘤骨轉移及軟組織浸潤等所引起的疼痛。
促進潰瘍性癌灶控制 如伴有潰瘍的大面積皮膚癌、口腔癌、乳腺癌等。
改善生活質量 如通過縮小腫瘤或改善症状後使生活質量提高。
(三)輔助性放療
輔助性放療是放療作為綜合治療的一部分,應用放療與手術或化療綜合治療,提高病人的治療效果。在手術或化療前後,放療可以縮小腫瘤或消除潛在的局部轉移病灶,提高治癒率,減少複發和轉移。
(四)腫瘤急症放療
上腔靜脈壓迫症候群 病人臨床表現為面部水腫,發紺,胸壁靜脈及頸靜脈怒張,上肢水腫,呼吸困難不能平臥休息等。引起上腔靜脈壓迫症候群的腫瘤,肺癌佔75%~85%,惡性淋巴瘤佔11%~15%,轉移瘤佔7%,良性腫瘤佔3%。此時應立即給予放射治療,緩解病人的症状,減輕病人的痛苦。症状緩解後改為常規放療。
顱內壓增高症 顱內壓增高症會導致腦實質移位,在張力最薄弱的方向形成腦疝,造成病人神經系統致命性損傷而猝死。其臨床表現為頭痛、嘔吐、視覺障礙,甚至精神不振、昏睡、嗜睡、癲痼發作。放射治療最適於白血病性腦膜炎及多發性腦轉移瘤引起的顱內壓增高症的急症治療。同時使用激素及利尿劑,能夠使病人症状得到緩解,恢復一定的生活自理能力。
脊髓壓迫症 脊髓壓迫症發展迅速,一旦截癱很難恢復正常。原發性或轉移性腫瘤是脊髓壓迫症的常見原因,肺癌、乳腺癌、前列腺癌、多發性骨髓瘤和,淋巴瘤最易轉移至脊椎,導致脊髓壓迫。95%以上的脊椎轉移瘤均在髓外,對不能手術的髓外腫瘤應儘快採取放射治療,同時也應使用大劑量皮質類固醇,促使水腫消退,防止放療水腫發生。這種快速照射法通常可使多數病人疼痛明顯減輕,症状緩解。
骨轉移劇痛 骨轉移的放射治療的止痛作用既快又好,同時也有延長生存的作用。
六、放射敏感性及其影響因素
組織對一定量射線的反應程度,稱為放射敏感性,不同組織器官以及各種腫瘤組織在受到照射後出現變化的反應程度各不相同。放射敏感性與腫瘤細胞的增殖周期和病理分級有關,即增殖活躍的細胞比不增殖的細胞敏感,細胞分化程度越高放射敏感性越低,反之愈高。此外,腫瘤細胞的氧含量直接影響放射敏感性,例如早期腫瘤體積小,血運好,乏氧細胞少時療效好,晚期腫瘤體積大,瘤內血運差,甚至中心有壞死,則放射敏感性低;生長在局部的鱗癌,較在臀部和四肢的腫瘤血運好,敏感性高;腫瘤局部合併感染,血運差(乏氧細胞多),放射敏感性下降。因此,保持照射部位清潔,預防感染、壞死,是提高放療敏感性的重要條件。
不同腫瘤及正常組織的放射敏感性
相對敏感度 腫瘤 正常組織
高度 淋巴類腫瘤、白血病、精原細胞瘤 淋巴、骨髓、睾丸、卵巢、腸上皮
中等高度 鱗癌:口腔、鼻咽、食管、膀胱、皮 膚、宮頸癌等
口腔、皮膚、角膜、毛囊、皮脂腺、食管、膀胱、晶狀體、陰道、子宮
中度 血管及結締組織腫瘤 一般結締組織、神經結締組織、生長軟骨及骨組織
成熟軟骨、骨組織,粘液唾液腺上皮、汗腺上皮、鼻咽上皮,肝、腎、甲狀腺,腎上皮
另外,放射治療的敏感性還受下列因素的影響:如細胞的分化程度、臨床分期、既往治療、腫瘤生長部位及形狀、有無局部感染、病人營養狀況或有無貧血等等。
放射反應護理
1、全身反應
由於腫瘤組織崩解、毒素被吸收,在照射數小時或1~2天後,病人可出現全身反應,表現為虛弱、乏力、頭暈、頭痛、厭食,個別有噁心、嘔吐等,特別是腹部照射和大面積照射時,反應較重。護理措施:
(1)照射前不宜進食,以免形成條件反射性厭食。
(2)照射後完全靜臥休息30分鐘。
(3)進清淡飲食,多食蔬菜和水果,並鼓勵多飲水,促進毒素排出。
(4)參加集體文娛活動或氣功,以轉移注意力。此外,每周檢查血象1次,當白細胞下降至4×109L、80×109L以下時,需給升血藥物,如血象明顯下降需暫停放療。
2、皮膚反應
皮膚對射線的耐受量與所用放射源、照射面積和部位有關。鈷60治療機和直線加速器產生的r射線和高能X線透力強,皮膚受量小,反應輕;X線治療機產生的低能X線和感應加速器產生的電子束皮膚受量大,反應重。臨床上大面積照射時或照射皮膚的皺褶及潮濕處,可出現一定程度的皮膚反應,皮膚反應分為三度:
(1)Ⅰ度反應:紅斑、有燒灼和刺癢感,繼續照射時皮膚由鮮紅漸變為暗紅色,以後有脫屑,稱干反應。
(2)Ⅱ度反應:高度充血,水腫、水泡形成,有滲出液、糜爛,稱濕反應。
(3)Ⅲ度反應:潰瘍形成或壞死,侵犯至真皮,造成放射性損傷,難以癒合。
放療後數日或更長時間,照射部位可出現皮膚萎縮,毛細血管擴張、淋巴引流障礙、水腫及深棕色斑點、色素沉著,稱後期反應。
照射野皮膚保護措施:
①內衣宜柔軟、寬大,吸濕性強。
②保持乳房下、腋窩、腹股溝及會陰部皮膚清潔乾燥,防止干反應發展為濕反應。
③照射野皮膚應用溫水和柔軟的毛巾輕輕沾洗,忌用肥皂,不可塗酒精、碘酒、紅汞、油膏,並避免冷熱刺激(如熱水袋)。
④照射野不可貼膠布,以免所含氧化鋅(重金屬)產生二次射線,加重皮膚損傷。
⑤頭面部照射,防止日光照曬。
⑥使用電剃鬚刀,避免損傷皮膚,造成感染。
⑦皮膚脫屑期,切勿用手斯剝。
⑧發生干反應,可塗0.2%薄荷澱粉或羊毛脂止癢;濕反應可塗龍膽紫或氫化可的松暴露創面;如有水泡形成,塗硼酸軟膏包紮1~2天,待滲液吸收後,再行暴露療法。
3、粘膜反應
(1)口腔炎:口腔粘膜照射後可出現水腫、充血、潰瘍、疼痛、唾液分泌減少、口乾,以至出現假膜。護理措施:
①保持口腔清潔,每次飯後用軟毛牙刷刷牙,每日用朵貝爾液含漱4次,出現假膜時改用1.5%雙氧水。
②改少渣飲食,忌用刺激性調味品和過冷過熱食物。
③如有劇烈疼痛,可在飯前噴以1%地卡因或用地卡因糖。
④口乾可吃少量酸性食物,以刺激唾液分泌,並用抗口乾牙膏刷牙。
此外,為預防放射後期發生骨髓炎或骨壞死,治療前需潔齒並治療牙疾,治療後3年內不可拔牙。
(2)食管炎:食管照射後可出現粘膜充血、水腫及炎症,使食管梗阻加重,造成下咽困難、疼痛、粘液增多。
應保持口腔和食管的清潔,每次飯後喝溫水沖洗食管。高度梗阻需行胃造瘺或靜脈高營養。中、晚期食管癌,特別是潰瘍型,粘膜壞死易造成穿孔;中段食管癌有穿入主動脈引起大出血的可能。因此,應密切觀察病人有無嗆咳、痛疼及脈搏的變化,早期發現出血和穿孔,以免延誤搶救。
(3)直腸炎:全腹或盆腔照射時,可出現粘膜潰瘍、腹脹、腹痛、腹瀉等,甚至壞死組織脫落,引起大出血和腸穿孔。注意病人有無血性粘液便、里急後復放射性直腸炎發生,以及腸穿孔,大出血及休克。
(4)膀胱炎:膀胱照射後可引起毛細管擴張而出現尿頻、尿急、血尿等膀胱炎症状,放療後期膀胱縮小。應鼓勵病人多飲水,以達自然沖洗膀胱並預防感染目的。
4、放射性肺炎和肺纖維變
胸部照射後可發生放射性肺炎。輕者無症状,急性放射性肺炎伴有高熱、胸痛、咳嗽、氣急等。需立即吸氧,靜滴氫化可的松和抗生素。上呼吸道感染是其誘因,應注意保暖,預防感冒。放療後期可出現進行性肺纖維變,表現為氣短、乾咳,需對症處理。
5、放射性脊髓炎
脊髓受較大劑量照射後會出現脊髓損傷,多發生於放療後數月至數年內,開始表現為漸進性、上行性感覺減退,行走或持重乏力,低頭時如觸電感,逐漸發展為四肢運動障礙,反射亢進、痙攣,以至癱瘓。
治療時需給予大量維生素B族神經營養藥物、激素和血管擴張藥,配合針灸、中醫治療;按截癱病人護理。
放射防護的基本原則
為保護工作人員免受射線的傷害,國家制定的放射防護條例規定最大允許量為5Rem(測量放射人員受量單位)。放射防護的基本原則是:
1、減少受照劑量
照射量與源的放射性強度成正比。在不影響工作的情況下,應盡量減少操作人員的受量,使其在國家制定的允許標準之內。
2、縮短受照時間
照射量隨接觸時間而增加。在保證醫療質量條件下,工作宜迅速,減少在其周圍的停留時間。
3、增加輻射距離
照射量與距離的平方成反比。可利用長柄工具或機械手遠距離操作,減少放射量,從而起到保護工作人員的作用。
4、增加防護屏蔽
利用防護屏障可有效地減低照射量。
此外,放射工作人員應接受劑量監督,定期做保健檢查。
腫瘤放射治療技術新進展
放射腫瘤學由於高科技的發展已取得了許多理論上和技術上的突破,下面簡要介紹放射生物科學,生物等效劑量超分割以及三維調強立體定向放射等技術的進展。
1、放射生物學進展
1)放射生物學的進展以線性--平方模式(Linear-Quadratic model)來解釋放射生物學中的反應,以α/β係數來預測放射治療劑量時間療效關係,為放射生物學開闢了較為廣闊的天地。近年來深入研究了細胞周期,即增殖期(G1-S-G2-M)和靜止期(G0)的關係,為此提出了4個R即是修復(Repair),再氧化(Reoxygenation)和再分布(Redistribution)和再增殖(Regeneration)作為指導放射生物中克服乏氧等問題的研究要點,放射生物學推進到目的明確,針對性強的有效研究中去。近年來在研究細胞修復和增殖中又進一步了解到細胞凋亡(Apoptosis)和細胞分裂(Mitosis)的關係後,提出了凋亡指數(AI)與分裂指數(MI)(Apoptosisindex/Mitosisindex)比來予測放射敏感性和預後,指導調發自發性凋亡和平衡各種細胞的抗放、耐藥(即Resistant RT和Resistant Chemotherapy),並由此估計複發,研究增敏,開發出超分割、加速超分割治療等新技術,從而取得了科研及臨床的許多新結果,加深了理論深度,開拓出新的領域,推動了放射治療學的進展。
2)DNA和染色體研究
為了測定腫瘤細胞本身輻射損傷,染色體中DNA鏈中的斷裂(單鏈斷裂SSB和雙鏈斷裂DSB),其斷裂的準確位置,以及在這個過程中,腫瘤細胞如何進行修復,也觀察到錯誤修復,以及無修復等對細胞的子代產生的決定作用。目前臨床用對DNA調節機制的多種原理表達進行測試,可以分清那些是有意義的表達,那些是靈敏的表達,建立對臨床治療,預後評估的方法學和化驗項目,指導放射生物學,放射物理學,臨床放射腫瘤學的發展,使更有目的性,針對性和實用性。放射生物學從細胞水平已進入到大分子水平,從純實驗室過渡到臨床初步應用階段〔5,6〕。
2、放射物理技術的進展
1)立體定向治療的實現
基於電子計算機精度提高,雙螺旋CT及高清晰度MRI出現,因此立體定向治療應運而生,目前使用的γ-刀,從某種意義來說是一個立體定向放射手術過程(Sterol Radiation Surgery, SRS),它通過聚焦,等中心照準,於單次短時間或多次較長時間給予腫瘤超常規致死量治療,達到摧毀瘤區細胞的目的,γ刀利用約30~200個鈷源,在等中心條件下,從立體不同方向位置,在短距離內對細小腫瘤(或良性腫瘤,先天畸形等病灶,一般約1~2cmΦ)進行一次或多次照射,給予總劑量超過腫瘤及正常組織耐受量,用準確聚焦的辦法使多個60Co源的劑量集中在靶區,分射束聚焦使周圍正常組織受量仍在可能的耐受量中,由於採用電腦、CT,以及準確的立體設計定位,因而射野邊界銳利可達±2mm以下,確保了非瘤區正常組織安全。應用於腦部的良性小腫瘤和先天性畸形效果尤佳,應用於腦幹等生命禁區也取得了效果。但目前許多單位濫用,不嚴格控制適應症,因此造成了許多後遺症和併發症,使γ-刀的應用與初始設計原意偏離了軌道。
此外,採用X刀(加速器)其應用電腦進行定位,聚焦等技術與γ刀原理相近,它除應用在頭部腫瘤(如γ-刀)外,還應用在胸、腹盆等區域,應用範圍比γ-刀廣,應用效率較γ-刀要好。但立體照射(γ,X刀)技術應用中還存在許多問題,如放射生物學中的遠期併發症,腫瘤的局部控制問題,遠處轉移仍未得到解決,因此想單靠一種這樣機器是不能完全解決放射治療的所有問題的。
2)三維適形放療技術
3-Dimension Conformal Radiation Therapy(即3-D CRT),其理論和物理技術基礎與γ-刀等大同小異。但近年來特彆強調的由平面二維定位,過渡到立體三維定位,與其相適應的光柵(遮光器)能夠隨射野改變而適形變化,達到準確適應腫瘤形狀,使高劑量區分布形狀在三維方向上與病變靶區完全一致,適形和三維是一個問題的兩個方面,沒有三維定位則適形也無從實現,沒有多葉光柵(multiple leaves collimator),以及其隨體位、腫瘤空間形態改變的適形照射也是一句空話。近年來開發出了立體定向X-刀電子計算機晶片設計程序突破了晶片對多葉光柵同步控制的適形變化部分,使3DCRT就已經步入了實用階段,它可以通過常規分割,超分割,加速超分割,以及低速分割(Hypo fraction)等治療方式來完成目前一般的常規放療機(加速器,鈷60機,γ-刀等)所不能完成的任務。無論其精確度、療效,併發症均優於常規治療機,國外一些人士稱它為21世紀的常規放療機。它使射野(單個、多個、運動、固定)形狀與病變靶區的投影保持一致,多葉光柵對射野內諸點的輸出劑量率按要求不斷進行調整。
3)調強適形放療(Intensity Modulation Radiation Therapy-IMRT)
這種技術目前仍已應用於臨床,但國內外同行評價這種技術為21世紀放射治療技術的主流。三維適形治療(3-DCRT)所採用的同步可控多葉光柵,三維適形定位這種技術在IMRT中已成為基礎技術。但其不同之處在於採用(1)逆向演算法設計(Inversereckon Planning),這是IMRT除三維適形之外,為更精確起見所插入的必要步驟,它不僅正面方向的精確劑量計算,而且從逆方向演算法來進行驗證和審核,使用的高能X線,電子束、質子束等放射源,其射野繞人體用連續或固定集束,在旋轉照射方向上達到更精確邊界,因而它可以提高強度,達到適應腫瘤形狀高輸出劑量,三維數字圖象重建(3DRR-3Dimension Reckon-Picture Reconstruction)功能,使三維圖象中靶區等重要器官與圖象吻合,劑量分布合適與否一目了然。
a、有冠狀、矢狀、橫斷面的圖象及劑量分布,還要能給出任意斜切面的圖形及劑量分布,並隨時可以顯示給治療人員,設計人員以及醫生,它使視野方向的觀視(BEV Beam-field Equation Vision)和醫生反方向的觀視(REV-Reaction Equation Vision)都成一致。
b、模擬選擇--在安排和設計射野時必須具有模擬類似常規模擬定位機射野的選擇功能,包括準直器種類,(獨立式、對稱式)和多葉準直器即多葉光闌(LMC-Multiple leaves collimator),大小,放置射野檔塊和楔形過濾板等。
c、治療方案確定後,將各項條件輸入CT模擬治療(CT-Simulator),CT的模擬機應能接受上述條件。
d、驗證,擇優方案選擇後將信息轉至治療機電腦按上述條件運轉,將各種附加條件如機架,準直器,床移動範圍,射野大小,多葉光柵葉片運動及調整機匹配,這樣整個過程就完成了。所謂調強適形放射技術就是從固定視野上的物理條件出發,把其準確性調至最高,將平面二維準確調至三維更準確方向,在三維補償照準方面調至最精確,給到最大足量。從診斷、設計實施和多種補償手段,各種運動射束的調強,使射野邊界銳利,界限明確,達到最高限度的準確定位,最高準確劑量達到靶,高準確度執行預定計劃,從而可以超過SRT及SRS的準確治療方式,又可克服SRT及SRS的明顯缺陷。
4)圖像導引放射治療-IGRT
這是目前腫瘤放射治療的發展的方向。其目的是在同一台治療設備上做到精確計劃(TPS)、精確定位(IGRT)、精確治療(IMRT)三原則。目前美國VARIAN、德國SIEMENS、瑞典ELAKAT都具備這方面的能力。我國的醫用加速器與此上有一定的差距,但是相信很快也能趕上並超過他們。
3、臨床實用放療技術進展
1)生物等效劑量(BED-Biological Equralent Dose)
為了使腫瘤中心物理劑量與其他點的劑量差異(即劑量不均質性);以及物理劑量與生物效應之差異(也稱為生物效應差異),這雙重差異的結果能最後表達出來,在放射生物學上對這種雙重差異效應統一,稱之為生物等劑量(BED),過去臨床醫生僅憑經驗及臨床效果來猜測,它要達到對腫瘤區的根治劑量,又要對周圍正常組織的保護,為了使BED應用於臨床實際,以往L-Q模式α/β比能夠大致表達這種內容。在低劑量區起始段為細胞殺滅與劑量成線性關係(e-ad)為單靶區域α擊中;隨著劑量增加存活曲線向下彎曲,此時細胞存活和劑量成平方關係(e-βd2),通過線性(α/β值約為10Gy)。利用這個理論及實驗室結果,使治療中生物等效劑量更接近臨床治療中實際,以往在治療中應用的常規分割(每周五次,每天一次,每次劑量約2Gy)這個矢量對腫瘤的控制,它的生物等效劑量比較好,但不理想。因此為了接近腫瘤實際故又提出了腫瘤可控機率TCP(Tumor Contral Probability)和不可控機率NTCP(Non Tumor Control Probability),以TCP/NTCP數值來衡量BED和腫瘤治療機率。
2)超分割(HF,Hyperfraction),加速超分割,(AF,Acceleated Hyperfraction)和低分割(Hypofraction)技術在臨床上的應用
以往我們常用常規分割——即每周五天,休息二天,每天一次,每次劑量約2Gy,這已用了幾十年的方法稱為常規分割(Convention fraction)其原理在於五天放射,二天休息,每周共五次是較為合適的治療,它使腫瘤受損達到較高程度,但又使靶區內的正常細胞有可能得到部分修復,利用正常細胞與腫瘤細胞「受量耐受性差」作為治療根據,但這種常規分割(CF),24小時重複一次,不論劑量調強到3Gy/次也好或更高,但有一定限度,連續4Gy/日高量則正常組織修復乏力,從臨床動物試驗結果看到,腫瘤細胞經過照射之後約4小時即已開始進行修復,因此每天一次照射至第二天再開始則受打擊之腫瘤細胞,它通過4R(修復,再氧化,再分布和增殖)已經達到了一定水平的恢復。如果在其修復周期3~24小時之間,再給予一定的輻射打擊,則可以加重其損傷程度和減少修復百分比,使致死性損傷更多,雙鏈斷裂(DS更多,使阻於G1期的細胞減少。基於此近十幾年來在國內外開展了超分割(HF)治療,其基本條件為每天照射2次,每次間隔4~6小時每次劑量在1.1~1.4Gy之間,其餘條件為:總劑量、每周五天均與CF無差別。經過十幾年來試驗和臨床觀察已看到了局部控制,複發率,生存率比CF有顯著意義提高,其近期副作用比常規分割明顯大,長期損傷和遲發反應明顯後遺症和常規分割無顯著性差別。這些結果國內外經過雙盲隨機,單盲隨機,非隨機回顧性對比均取得同一臨床結果,動物實際結果也得到確認 加速超分割(AF,Accelerated Hyperfracton)其原理和基本出發點和規定與分割相同,但在每天放療次數,每次劑量則有區別。它每天至少3次以上(偶有應用4次的報導)每次間隔3~4小時,3次劑量總和達3Gy以上(一般在4.5Gy以下),自80年代至開展AF以來其近期療效和遠期療效均優於CF。其近期、遠期併發症與HF相同,近期反應略大於HF。但無論超分割、加速超分割也好,都是建立在腫瘤細胞和正常細胞組織間的放射生物學特點差異基礎上的,放射治療劑量的提高,局部控制的好壞完全離不開這些基本條件,因此這種方法仍是有一定限度。在美國Anderson醫院和一部分地區試用所謂:輔助野超分割治療,(Hyperfraction Boost field),其方法為全程採用每天二次治療中首次使用較大劑量,間隔4~6小時後加入輔助小野,拋開該大野中之淋巴預防區,其效果在於增加對原發灶打擊,對淋巴區照射則限於常規分割劑量,增加原發灶的損傷。幾年來試驗結果,其優點明顯,原發灶控制與HF和AF很接近,但近期反應較輕,很受臨床歡迎。
3)傳統的治療
術前放療仍在應用,過去多提倡術前給予常規治療根治量的1/2~2/3後手術,由於術中粘連多,故有些試驗降低術前放療量為全量照射的1/3,如食管癌術前放療由過去的GT30~40Gy降至30Gy以下再手術,日本學者的觀察未發現其遠地轉移增多,但術後併發症少,生存率略有提高,因例數太少,無隨機,故說服力不大。
應用超分割及加速分割作術前放療已有嘗試,但術後併發症多,與其近期副作用多是一致,故目前為術前作CF比做HF或AF多。
4、放療其他新技術進展
對放射治療的技術學和方法學研究以及基礎理論研究,其中對於乏氧細胞和射線粒子的放射原理,放射生物學研究提供了一些基礎,例如快中子對乏氧細胞的作用,高LEF射線的Bragg峰的優越物理生物作用的利用,重粒子的使用,都對放射治療技術有很大吸引力,目前仍在不斷地發展中,質子加速器是開重粒子治療的先河,目前已有質子加速器應用於臨床上。高LET射線物理防護,遠期放射生物效應,後遺症等也不可忽視。精確定位,精確設計,精確治療的統一應用是腫瘤放射治療技術的必然發展趨勢,也是從事放射治療工作的追求目標,21世紀給放射新技術既提出了機遇也提出了挑戰,讓我們面對這種形勢努力創造條件,提高檔次和水平,追趕世界先進潮流,達到更高水平。
腫瘤治療中許多學科互相交叉,互為借鑒,目前血液病學和化學治療中提出了高劑量化療或全身放療來殺滅全身的惡性細胞,其中全身放療(TBI,Total Body Irradiation)在血液病骨髓侵犯病人中應用比較成功。為此許多人認為對於容易轉移的實體瘤,如未分化癌,原發灶較小的癌腫採用癌灶區加全身放療再加以骨髓移植或幹細胞移植(Stem Cell Transplant)作為對付這種疾患的辦法。目前在國外(日、美、法、英)有個別研究,先將周圍血中或骨髓中的幹細胞在未治療前抽出分離保存,再給予原發灶的根治性治療,後採用TBI或HDC(Hyper-Dose Chemotherapy)治療使WBC達到接近0,再在層流病房將原病人的幹細胞(周圍血或骨髓血)返輸,配合應用G-CSF(Granulocyte Colony Stimulation factor)集落刺激因子,渡過白血球減少的感染關,期望達到痊癒,以使潛在於骨髓、脾臟器官中的隱蔽惡性腫瘤細胞無藏身之處,達到防止轉移根治痊癒目的。由於小灶性的分化差腫瘤採用此種辦法代價很大。故往往不易被患者所接受,但目前尚有個別試驗成功例子。作為一種新的方法目前仍未全面應用臨床,但從理論和實際上是有探討及研究價值的餘地。但對於已廣泛轉移的實體瘤應用這種方法應該是沒有效果的。從這一方法的側面借鑒,使腫瘤整體治療取得更大的效果,這也是放射治療應該注意的問題。
放療有何缺點
腫瘤治療中,主要手段是手術、放療和化療; 放療雖然有很多的優點,但缺點也不少。放療不能減輕化療的毒性作用,化療也不能減少放療的損傷作用,如化療抑制全身的骨髓,放療也產生局部的骨髓抑制,病人常常因骨髓抑制血相低而無法繼續治療。在做胸部腫瘤放療時,化療後的病人放射性肺炎或肺纖維變、放射性心包炎的發生明顯增多,有時不得不減少放療劑量,增加了放療的難度。化療對肝腎胃腸道的毒性很大,放療對這些部位的損傷也相當大,所以綜合治療時,放療的劑量受到很大限制,對不敏感的腫瘤難以提高劑量,效果就差。化療後對身體免疫力影響也較大,身體情況也受到很大損傷,使放療時無法用較大的治療野。所以,綜合治療時應盡量選擇對所放療臟器毒性小的化療藥物。
放射物和輻射病專題
主條目: 輻射
放射線 從原子核中放射出來的有穿透性的粒子束。最常見的有α射線、β射線、γ射線、X射線(倫琴射線) 等
輻射強度單位是貝可勒爾(becquerel)簡稱貝可。比活度指放射源的放射性活度與其質量之比。
輻射相關症状和疾病:
環境問題: 放射性廢物
相關圖書:
| 關於「放射治療」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |