彌散性血管內凝血
| A+醫學百科 >> 彌散性血管內凝血 |
彌散性血管內凝血(DIC)是一個症候群,不是一個獨立的疾病,是在各種致病因素的作用下,在毛細血管、小動脈、小靜脈內廣泛纖維蛋白沉積和血小板聚集,形成廣泛的微血栓。導致循環功能和其他內臟功能障礙,消耗性凝血病,繼發性纖維蛋白溶解,產生休克、出血、栓塞、溶血等臨床表現。過去曾稱為低纖維蛋白原血症,消耗性凝血病,最近有人認為以消耗性血栓出血性疾病為妥,但最常用的仍為彌散性血管內凝血。
目錄 |
病因
造成DIC的病因很多。根據資料分析,在我國以感染最常見,惡性腫瘤(包括急性白血病)次之,兩者占病因的2/3。國外報告則以惡性腫瘤,尤其是有轉移病變的占首位。廣泛組織創傷、體外循環及產科意外也是DIC發病的常見病因。
DIC的病因有涉及血液本身的及血液以外的因素,可以歸納如下:
血管內皮損傷和組織創傷
1.感染各種嚴重的細菌感染〈如金黃色葡萄球菌、革蘭氏陰性桿菌、中毒性菌痢、傷寒等〉均可導致DIC。細菌本身及其毒素均可損傷組織及血管內皮細胞,激活因子Ⅻ激肽釋放酶及緩激肽,由此進一步激活凝血系統,後者還有強烈的舒血管作用,能使血管擴張,血壓下降引起休克。激肽系統對凝血過程有強化作用。補體與凝血、纖溶及血漿激肽系統也有密切關係,也是血栓形成的因素之一。最近發現,白細胞在激活凝血的機理中也占重要地位,它受內毒素影響,可釋放組織因子,與因子Ⅶ合在一起能激活因子X促進凝血。病毒感染〈如流行性出血熱、重症乙型腦炎等〉、惡性瘧疾、鉤端螺旋體病、立克次體病及立克次體感染也均可引起DIC。其發病的機理與細菌感染大致相似。感染是最常見的致病因素。
2.抗原-抗體複合物的形成各種免疫反應及免疫性疾病能損傷血管內皮細胞,激活補體,也能引起血小板聚集及釋放反應,激活凝血機制,如系統性紅斑狼瘡,移植物排斥反應或其他免疫性疾病。
3.其他如體溫升高、酸中毒、休克或持續性低血壓、缺氧等均可損傷血管壁內皮細胞。
大量促凝物質進入血液循
環常見於產科意外,如羊水栓塞、胎盤早期剝離、死胎滯留等病例。由於羊水、胎盤等釋放的組織因子大量進入血循環,誘發DIC。嚴重創傷也是常見的DIC病因,如嚴重燒傷、廣泛性外科手術、擠壓症候群、毒蛇咬傷等均可由受損的組織中釋放出大量組織因子進入血液,促發凝血。此外,在癌腫廣泛轉移及組織壞死〈尤其是胰、胃、前列腺及支氣管癌〉,腫瘤細胞含有的組織凝血活性物質,激活外源性凝血系統,產生大量凝血酶而促發凝血。腫瘤細胞中的蛋白酶類物質也可以激活凝血因子,起促凝作用。化療及放療殺滅腫瘤細胞釋出其中促凝物質,DIC更容易發生。
磷脂類物質
大量紅細胞、血小板及白細胞的破壞或損傷紅細胞及血小板破壞後釋放類似組織因子的磷脂類物質,紅細胞破壞後還釋出紅細胞素,有類似組織凝血活酶活性,血小板破壞後也可釋出一系列促凝活性物質。最近發現中性粒細胞的損傷也是DIC發病機理中重要一環,還可能是形成微血栓的必要條件。中性粒細胞參與DIC的發生可能與因子Ⅻa激活補體的作用有關。補體被激活後可損傷粒細胞,從中釋出蛋白酶類凝血活性物質,促進血液凝固。
其他因素
1.單核巨噬細胞功能受損可促進DIC的發生。在正常情況下,單核-巨噬細胞系統包括肝臟的枯否氏細胞能吞噬或清除進入血液中的促凝物質,如凝血酶、纖維蛋白顆粒及內毒素等。急性肝壞死或肝硬化等病有肝功能損害,其吞噬及清除功能減弱,易發生DIC。長期使用大量腎上腺皮質激素容易誘發DIC這與單核-巨噬細胞系統受阻有關。
2.原健康狀態患者原來的健康狀態也有重要影響,如妊娠婦女常有高凝傾向,營養不良尤其是糖代謝紊亂,容易發生DIC。
3.纖維蛋白溶解系統受抑制如長期大量使用抗纖溶藥物,如6-氨基己酸、止血環酸、對羧基苄胺,可誘發DIC。
還有血流瘀滯、體內酸鹼不平衡、電解質紊亂和內分泌失調等,均與DIC的發生有關。
發病機理
當人體受到某些致病因子的作用時,體內凝血系統被激活,血液的凝血活性增高,在微循環內發生血小板聚集及纖維蛋白沉積,形成播散性微血栓。本徵也稱為:①去纖維蛋白症候群;②消耗性凝血病;③血管內凝血--纖維蛋白溶解症候群。目前統稱"播散性血管內凝血"。
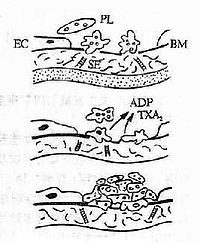
正常人體內有完整的凝血、抗凝及纖維蛋白溶解系統。凝血及抗凝,既對立又統一,保持著動態平衡。在正常人的血液中,如果有少量活性凝血中間產物形成,就迅速被單核--巨噬細胞系統消除,或被血液中的抗凝物質中和。纖溶系統能不斷溶解在小血管破損處所形成的少量纖維蛋白。DIC的發生是由於在各種致病因素的作用下,血循環內出現了促動和激活凝血的過程,產生過量的凝血酶。血液的凝固性過高,破壞了體內凝血與抗凝的平衡。其病理變化包括:①全身微血管內有廣泛的纖維蛋白沉著,形成微血栓,造成微循環障礙、紅細胞機械性損傷及溶血;②當微循環內發生凝血時,大量血小板和凝血因子被消耗,從而使高凝狀態轉變為低凝狀態;③體內的繼發性纖維蛋白溶解產生大量纖溶酶,使纖維蛋白原裂解為X和A、B、C裂片,再進一步裂解為Y、D、E裂片。這些纖維蛋白(原)降解產物的抗凝作用可加重出血。除大量出血外,微循環內的血栓可引起微循環阻塞,導致肺、腎、肝、腦、心等器官的功能衰竭。
病理
約90%的DIC病例屍解時可發現血管內有微血栓形成或纖維蛋白沉著,以肺、腎、胃腸道、腎上腺等
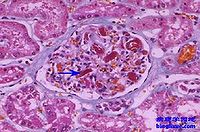
較常見。在一組52例的屍解結果中,肺栓塞的發生率為54.6%,腎臟36.5%,胃腸道34.6%,較小的微血栓在蘇木素-伊紅染色時易被忽略,需要用Mallory磷鎢酸蘇木素等染色或用電鏡檢查加以證實。微血栓有時可僅在某些局部器官中見到,而在循環血液中則不被發現,也有一些臨床上證實為DIC的病例,屍檢中卻無血栓形成,可能是死亡後發生纖維蛋白溶解所致。如用電鏡,結合特殊染色則仍可發現血管內皮表面有纖維蛋白沉著。腎臟的病變可表現為局限性腎小管壞死或兩側嚴重腎皮質壞死,少數病例的肺部有非栓塞性內膜炎或肺部透明樣病變。
分類及分期
凝血發病快慢和病程長短
1.急性型其特點為:①突發性起病,一般持續數小時或數天;②病情兇險,可呈暴髮型;③出血傾向嚴重;④常伴有休克;⑤常見於暴髮型流腦、流行型出血熱、病理產科、敗血症等。
2.亞急性型其特點為:①急性起病,在數天或數周內發病;②進展較緩慢,常見於惡性疾病,如急性白血病(特別是早幼粒細胞性白血病),腫瘤轉移,死胎滯留及局部血栓成。
3.慢性型臨床上少見:①起病緩慢;②病程可達數月或數年;③高凝期明顯,出血不重,可僅有淤點或淤斑。
DIC生理特點和發展過程
(一)高凝期:各種病因導致凝血系統被激活,凝血酶生成增多,微血栓大量形成,血液處於高凝狀態。
(二)消耗性低凝期:凝血酶和微血栓的形成使凝血因子和血小板因大量消耗而減少,同時因繼發性纖溶系統功能增強,血液處於低凝狀態,有出血表現。
(三)繼發性纖溶亢進期:凝血酶及XIIa等激活了纖溶系統,使大量的纖溶酶原變成纖溶酶,加上FDP形成,使纖溶和抗凝作用大大增強,故此期出血十分明顯。
臨床表現
DIC的發病原因雖然不同,但其臨床表現均相似,除原發病的徵象外,主要有出血、休克、栓塞及溶血四方面的表現。
DIC分急性、亞急性和慢性三種,其中急性佔大多數,常見於革蘭氏陰性桿菌感染、敗血症、流行性出血熱、產科意外、急性溶血、輸血血型不合、毒蛇咬傷、廣泛大手術、體外循環、重度擠壓傷及複合創傷,病勢兇險。亞急性DIC見於白血病、各種癌腫及癌轉移或死胎滯留,病情較緩和。慢性者少見,臨床表現可為原發性疾病所掩蓋,容易漏診或誤診,常在屍解中發現,多見於系統性紅斑狼瘡、卵巢癌腫,巨大血管瘤,晚期糖尿病等。
DIC的臨床表現主要為出血,多臟器功能障礙,休克和貧血。其中最常見者為出血。急性DIC時以前三種症状為多見:
出血
DIC患者約有70%-80%以程度不同的出血為初發症状,如紫癜、血泡、皮下血腫、采血部位出血、手術創面出血、外傷性出血和內臟出血等。出血的機制與下述四方面因素有關。
(1)凝血物質大量消耗:廣泛微血栓形成使各種凝血因子包括Fbg、FV、FⅧ、FIX、FX和血小板大量消耗,故DIC又稱為消耗性凝血病(consumptive coagulopathy)。
(2)繼發性纖溶功能增強:纖溶功能增強產生大量PLn,PLn不但能降解Fbn/Fbg,還能水解各種凝血因子,使凝血因子進一步減少,加劇凝血功能障礙並引起出血。
(3)纖維蛋白(原)降解產物的抗凝作用:PLn降解Pbs/Fbn生成各種分子大小不等的多肽組分,總稱為纖維蛋白(原)降解產物(fibrin/fibrinogen degradation products,FgDP/FDP),其中多數成分有強大的抗凝作用:①X、Y片段可與纖維蛋白單體(FM)形成可溶性FM複合物(soluble fibrin monomer complex,SFMC),阻礙FM相互間交聯以形成可溶性纖維蛋白;D片段對FM交聯聚合有抑制作用。②片段Y、E有抗凝血酶作用。③大部分成分能抑制血小板粘附和聚集。FgDP/FDP各種成分的這類作用,使機體止、凝血功能明顯降低,是DIC時引起出血的重要機制。
(4)血管損傷:DIC發生髮展過程中,各種原始病因和繼發性引起的缺氧、酸中毒、細胞因子和自由基等多種因素的作用可導致微小血管管壁損傷,也是DIC出血的機制之一。
多系統器官功能衰竭
由於DIC發生的原因和受累臟器及各臟器中形成微血栓的嚴重程度不同,故不同器官系統發生代謝與功能障礙或缺血性壞死的程度也可不同,受累嚴重者可導致臟器功能不全甚至衰竭。臨床上常同時或相繼出現兩種或兩種以上臟器功能障礙的不同症状,如呼吸困難、少尿、無尿、噁心、嘔吐、腹部或背部疼痛、發熱、黃疽、低血壓、意識障礙(嚴重者發生昏迷)及各種精神神經症狀。DIC時引起多器官功能衰竭(MSOF)的機制,與微血栓形成和微循環灌流障礙、缺血再灌注損傷、白細胞激活和炎症介質的損傷作用,以及器官功能障礙作為後果對其它臟器產生的影響等有關。MSOF常是DIC引起死亡的重要原因。
休克
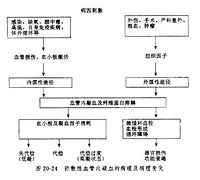
某些病因既可引起DIC也可引起休克,如內毒素血症、嚴重燒傷等:由於不同個體內在條件的差異和病因性質、作用時對凝血-抗凝血平衡或微循環功能影響的嚴重程度不同,可以首先出現DIC或者休克的特徵性病理變化,也可幾乎同時地出現這兩種病理變化。DIC或休克在發展過程中也能產生一些因素分別引起休克或DIC。如前述由暴髮型腦膜炎球菌敗血症引起休克時,可伴有皮膚大片瘀斑等體征,其本質屬於典型的DIC。
DIC病理過程中有許多因素與引起休克有關。①微血栓形成,使回心血量減少。②出血可影響血容量。③DIC時可引起腎上腺素能神經興奮;也可通過激活激肽和補體系統產生血管活性介質如激肽和組胺,使外周阻力降低,引起血壓下降。④FDP小片段成分A、B、C能增強激肽和組胺的作用,使微血管擴張,通透性增高,血漿外滲。⑤心功能降低。除心內微血栓形成直接影響心泵功能外,肺內微血栓形成導致肺動脈高壓,增加右心後負荷;DIC時因組織器官缺血、缺氧可引起代謝性酸中毒,酸中毒可使心肌舒縮功能發生障礙。由於前述的因素使血容量減少、回心血量降低、心功能降低和心輸出量減少,加上血管擴張和外周阻力降低,則血壓可明顯降低。
微血管病性溶血性貧血
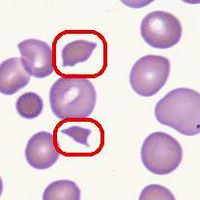
DIC時紅細胞可被阻留於微血管內。當紅細胞通過沉著的Fbn細絲或VEC裂隙處時受到血流衝擊、擠壓,引起對紅細胞的機械性損傷,因而在循環中出現各種形態特殊的變形紅細胞或呈盔形、星形、多角形、小球形等不同形態的紅細胞碎片,稱為裂細胞(schistocyte)。這些紅細胞及細胞碎片的脆性明顯增高,很易破裂發生溶血。DIC早期溶血較輕,不易察覺,後期易於在外周血發現各種具特殊形態的紅細胞畸形。外周血破碎紅細胞數大於2%對DIC有輔助診斷意義,但這種紅細胞碎片並非僅見於DIC。慢性DIC及有些亞急性DIC往往因出現溶血性貧血的臨床症状,被稱為微血管病性溶血性貧血(microangiopathic hemolydc anemia)。
實驗室輔助檢查
DIC的檢查項目繁多,但缺乏特異性、敏感性高而又簡便、快速的方法。有些試驗比較精確,但化費時間太多,難以適合急症診斷的要求。由於DIC病情發展快,變化大,化驗結果必須及時正確,必要時還要反覆檢查,作動態觀察,因為在DIC的不同階段其檢驗的結果不盡相同,由於機體代償功能強弱不同所致。當檢驗結果與臨床表現不一致時,要恰當評價檢驗結果的意義。有時臨床表現可能比陽性的檢驗結果更為重要。DIC的實驗室檢查主要分以下幾種:
消耗性凝血障礙
1.血小板減少約95%的病例都有血小板減少,一般低於10萬/mm3。如在動態觀察中發現血小板持續下降,診斷的意義較大。如DIC未經徹底治療,雖經輸鮮血或血小板,血小板計數仍不增加。反之,如血小板數在15萬/mm3以上,表示DIC的可能性不大。有些肝病或白血病患者,血小板在DIC發生前已有明顯降低,因此血小板計數無助於DIC的診斷。
2.凝血酶原時間延長當外源系統因子Ⅱ、Ⅴ、Ⅶ、X大量消耗,血漿中纖維蛋白原降解產物及抗凝物質增多,凝血酶原時間即明顯延長,陽性率可達90%以上。除非在DIC發生的極早期,凝血酶原時間測定正常,一般不支持DIC的診斷。正常凝血酶原時間為12.0±0.1秒,延長3秒以上則有意義。
3.纖維蛋白原減少約在70%左右的DIC病例,纖維蛋白原低於200mg/dl。在原有較高纖維蛋白水平或DIC的早期階段,纖維蛋白原降低不顯著,定量測定正常,動態觀察就可見到纖維蛋白原有持續減少的傾向,一般低於150mg/dl時,即有診斷意義。纖維蛋白原滴定度半定量的方法簡便,有實用價值。
4.其他如出血時間延長、凝血時間延長、血塊退縮不良、部分凝血時間延長,對診斷也有參考意義,有助於DIC的診斷。
纖維蛋白溶解亢進
1.凝血酶時間延長纖維蛋白原明顯減少或纖維蛋白(原)降解產物(FDP)增多時,均使凝血酶時間延長,但測定的結果可受到肝素治療的影響。採用連續凝血酶時間是診斷FDP的一項較敏感的指標。
2.血漿蛇毒致凝時間用從蛇毒中提取的酶(Reptilase)代替凝血酶進行凝血酶時間測定。當FDP增多時,凝血時間延長,本方法的優點是不受肝素的影響。
3.纖維蛋白降解產物的檢查正常人血清中僅有微量FDP。如FDP明顯增多,即表示有纖維蛋白溶解亢進,間接地反映出DIC。測定的方法很多,包括免疫法Fi試驗(即乳膠顆粒凝集試驗,正常滴度<1∶8),FDP絮狀試驗、放射免疫擴散法、葡萄球菌蝟集試驗(正常FDP值為0.57±0.1μg/dl,DIC時可高達60μg/dl)、鞣酸比紅細胞間接血凝抑制試驗(正常血清FDP值<10μg/dl,DIC時超過20μg/dl),酶膜免疫吸附技術等。如果FDP增多,表示有急性DIC的可能。
4.血漿魚精蛋白副凝固試驗(簡稱3P試驗)及乙醇膠試驗這是反映血漿內可溶性纖維蛋白複合體的一種試驗。當血管內凝血時,FDP與纖維蛋白的單體結合形成可溶性複合物,不能被凝血酶凝固。魚精蛋白可使複合物分離,重新析出纖維蛋白單體。結果發生纖維蛋白單體及FDP的自我聚合,形成肉眼可見的絮狀沉澱,稱為副凝固試驗。乙醇膠試驗與3P試驗的原理相同,國內資料報告,3P試驗陽性率為72.6~88.2%,乙醇膠的陽性率低。兩種方法均可有假陽性或假陰性結果。相比之下,乙醇膠試驗敏感性差,但較可靠;而3P特異性差,假陽性多,如FDP裂片分子量較小時,3P試驗也可為陰性。最好能把兩者相互參考比較,意義就更大。
5.優球蛋白溶解時間優球蛋白是血漿在酸性環境中析出的蛋白成份,其中含纖維蛋白原、纖維蛋白溶解原及其活化素,但不含纖維蛋白溶解抑制物,可用以測定纖維蛋白溶酶原激活物是否增加。正常值應超過2小時。如在2小時內溶解,表示纖維蛋白溶解亢進。纖溶亢進時,纖溶酶原減少,纖溶酶增多,優球蛋白被大量纖溶酶加速溶解。國內資料報告陽性率為25~42.9%。
微血管病性的溶血
在血清中可見到畸形紅細胞,如碎裂細胞、盔甲細胞等。血片檢查見破碎及變形的紅細胞比例超過2%時,對DIC的診斷有參考價值。
其他新的實驗方法包括
①抗凝血酶Ⅲ(ATⅢ)的含量測定:DIC中,ATⅢ大量消耗,早期即有明顯減少,測定結果不受FDP的影響,其測定方法有凝血活性及瓊脂擴散法免疫活性兩種方法。②用51Cr標記血小板或用125I標記纖維蛋白原測定血小板壽命是否縮短。③血小板β球蛋白(β-TG)及血小板第4因子(PF4)含量的測定:血小板聚集時β-TG及PF4可被釋放至血循環中。β-TG及PF4增高反映血管內血小板功能亢進,消耗時則見降低。④纖維蛋白分解產物的測定:當血管內有凝血及凝血酶活性增高時,纖維蛋白原的分解增加,纖維蛋白肽A(FPA)增加。可用放射免疫法測定。在色譜分析中可發現有纖維蛋白單體、雙體及多聚體增加。
鑒別診斷
1、重症肝病:因有多發性出血、黃疸、意識障礙、腎功能衰竭、血小板和纖維蛋白原下降,凝血酶原時間延長,易與DIC混淆。但肝病無血栓表現,3P試驗陰性,FDP和優球蛋白溶解時間正常。
2、血栓性血小板減少性紫癜:本病是在毛細血管廣泛形成微血栓:具有微血管病性溶血、血小板減少性紫癜、腎臟及神經系統損害,極似DIC。但本病具有特徵性透明血栓,血栓中無紅、白細胞,不涉及消耗性凝血,故凝血酶原時間及纖維蛋白原一般正常,有時亦可異常,病理活檢可以確診。
3、原發性纖溶亢進:本病極罕見。鏈激酶和尿激酶治療是典型實例。本病和DIC極難鑒別,因為①兩者可由同一病因同時誘發;②兩者均有纖溶特點:出血,FDP升高。兩者區別主要是纖溶部位,DIC繼發纖溶是對血栓形成生理性反應,典型部位局限於微循環;原發纖溶是在大血管,內皮細胞釋放致活因子。
治療
DIC的病情嚴重,病勢兇險,發展迅速,必須積極搶救,否則病情即可發展為不可逆性。原發病與DIC兩者互為因果,治療中必須同時兼顧,嚴密觀察臨床表現及實驗室化驗結果的變化。
(一)消除病因及原發病的治療治療原發病是治療DIC的根本措施,控制原發病的不利因素也有重要意義,例如積極控制感染、清除子宮內死胎、以及抗腫瘤治療等。其他如補充血容量、防治休克、改善缺氧及糾正水、電解質紊亂等,也有積極作用。輸血時更應預防溶血反應。在去除病因後,病情可迅速緩解,消除DIC的誘因也有利於防止DIC的發生和發展。
(二)肝素治療肝素和血液中的抗凝血酶Ⅲ (ATⅢ)形成複合體,加強ATⅢ對凝血酶及活性凝血因子Ⅸa、Ⅹa、Ⅺa及Ⅻa的滅活,發生抗凝作用。故在肝素治療時,必須考慮到血中的ATⅢ水平。如ATⅢ水平過低時,即使給予大量肝素也不易見效。近年來發現肝素也有促進纖溶和阻礙血小板聚集的作用。關於肝素應用的指征包括:①DIC診斷明確,包括原發病或病因不能控制或去除時,在後者作為DIC的對症治療;②如已證實發生DIC而準備去除病因時,為防止術中或術後促凝物質進入血循環而加重DIC,也可短期適當使用;③當準備應用纖維蛋白溶解抑制劑或補充凝血物質時,如有促凝物質已在血液中發揮作用,也應先用肝素,後給纖溶抑制劑、輸血及纖維蛋白原等。對急性DIC,特別是伴有新鮮創口、創面等病情較複雜的病例,肝素的應用要謹慎,如果使用不當,有加重出血的危險;對慢性或亞急性DIC,沒有血管損傷及新鮮創面,使用比較安全。對疑似DIC的病人,例如有DIC的傾向而3P試驗或其他化驗檢查陰性,或3P試驗陽性而無臨床出血症状者,可暫不用肝素,待檢查結果及臨床表現明確支持DIC時,即用肝素治療。目前對肝素應用的指征,看法尚無統一,但大多數人認為,凡診斷明確並有用藥指征的,應爭取早用。據上海瑞金醫院1986年組47例DIC用肝素治療的病例報導中,產科意外的治癒率高達72.2%,感染性疾病為42.2%。除上述疾病外,大多數DIC病例用肝素治療並無幫助,有時甚至有害。肝素治療失敗的因素包括:①用藥指征不當,尤其是診斷不甚明確;②用藥時間過晚,病情已成為不可逆性;③體內的ATⅢ耗竭,使肝素不能發揮正常的作用;④劑量掌握不當;⑤酸中毒未糾正,使肝素喪失活性。
有下列情況時,應用肝素要特別謹慎,以免加重出血:①在DIC後期,病理變化已轉為以纖維蛋白溶解為主而出血主要涉及纖溶及大量FDP的關係,而不是凝血因子的消耗;②手術創口尚未癒合;③原有嚴重出血如肺結核咯血、潰瘍病出血或腦溢血等;④有明顯肝腎功能不良者;⑤原有造血功能障礙和血小板減少者。
肝素的劑量及用法:一般採用中等劑量,每4~6小時靜脈注射50mg或連續靜脈滴注(每小時滴10mg左右)。24小時用量為200~300mg(每100mg=12500u),每次靜注前需測凝血時間(試管法),使控制在20-30分鐘之間,適當調整肝素劑量,一直用至DIC檢查指標恢復正常。最近有主張肝素用量不宜太大,日本多用80~120mg/d,對仍不能控制者,可能由於ATⅢ減少,要給輸血及血漿以提高AT-Ⅲ的水平,才能奏效。關於肝素小劑量治療方面,有人提出用肝素5000ul次,每日皮下注射2~3次。也可靜脈給藥。用小劑量肝素後,血中濃度在15-60分鐘後開始上升,1~5小時達高峰,7小時後逐漸消失,個體間可有差異。小劑量肝素治療的優點是無出血併發症,不需要實驗室的監測。有人提出對預防血栓採用超低劑量也可有效,每公斤小時皮下注射1單位。對肝素治療有效者,一般在凝血缺陷糾正後,臨床情況好轉,如血壓穩定,紫紺消失,方可停藥。如果凝血時間延長超出30分鐘,出血加重,說明為肝素過量,應即停藥,並靜脈輸入硫酸魚精蛋白中和,其用量相當於最後一次肝素用量或為其1/2量,每8~12小時1次,1-2次後即可糾正。停藥後要隨訪凝血時間連續3~5天,了解有無複發情況。急性DIC經用肝素有效者,凝血酶原時間可在24小時內恢復正常,纖維蛋白原等在1-3天內上升,血小板上升較慢,約需7天左右。
(三)抗血小板凝集藥物常用者為潘生丁,400~600mg/d,分3次口服,或將100~200mg置於100ml葡萄糖液體中靜脈滴注,每4-6小時重複1次。阿司匹林1.2~1.5g/d,分3次口服。兩者合用則需減少劑量。適用於輕型DIC或高度懷疑DIC而未能肯定診斷者。低分子右旋糖酐降低血液粘滯度,抑制血小板聚集,一般用量為500~1000ml靜脈滴注,主要用於早期DIC,診斷尚未完全肯定者,也可與潘生丁合用。
(四)AT-Ⅲ濃縮劑及合成抗凝血酶劑的應用實驗證明,AT-Ⅲ下降到一定水平時,即使增加肝素量也不能提高其抗凝作用,有人認為AT-Ⅲ水平低至正常的50%時,就應補充AT-Ⅲ。日本有人在靜滴肝素10000u/d,同時靜脈滴注AT-Ⅲ1500u/d,相當於血漿1500ml的含量。
日本最近合成抗凝血製劑,其作用與AT-Ⅲ無關。對DIC有明顯的療效,而且副作用少。
(五)補充血小板及凝血因子在未用肝素前輸血或給纖維蛋白原時,可為微血栓提供凝血的基質,促進DIC的發展。但如凝血因子過低時,應用肝素可加重出血。應當輸血(最好鮮血)或補充纖維蛋白原,後者每克製劑可提高血漿纖維蛋白原25mg/dl,纖維蛋白原濃度超過100mg/dl時才有止血作用。
(六)抗纖溶藥物的應用在DIC早期,纖溶本身是一種生理性的保護機制,故一般不主張應用抗纖溶藥物。早期使用反使病情惡化可能。但在DIC後期繼發性纖溶成為出血的主要矛盾時,則可適當應用抗纖溶藥物。這類藥物應在足量肝素治療下應用。只有當已無凝血消耗而主要為繼發性纖溶繼續進行時,方可單獨應用抗纖溶藥物。常用的藥物包括6氨基己酸(6EACA)2-6g/d,靜脈滴注,抗纖溶芳酸(對羧基節胺,簡稱PAMBA)200~400mg/d,或止血環酸(AMCHA)200~500mg/d,用葡萄糖液稀釋後緩慢靜脈滴注或注射。有人主張血中有大量纖溶酶時可採用抑肽酶,試用劑量為8~10萬u,靜脈注射,好轉後減量,每2小時用1萬u。
(七)中醫中藥常用的為活血化瘀的中藥藥物如復方丹參、肝芎嗪、參附註射液及刺參酸性粘多糖等,對治療DIC中有一定療效。
(八)其他國內在治療DIC並發休克的病例中,有人報導用山莨菪鹼,東莨菪鹼或酚苄明能解除血管痙攣。低分子右旋糖酐對疏通血脈有良好療效。也有人提出用尿激酶、換血、血漿去除術、血液透析等各種不同療法,但療效尚難肯定,有待進一步研究。
防治原則
由於DIC病情複雜,應採用綜合措施進行防治。主要原則是要恢復體內正常的凝血和抗凝血的平衡,具體原則如下:
治療原發病 預防和去除引起DIC的原發性疾病,終止促凝物質入血為首位的治療原則。如及時有效地控制感染、去除滯留在官腔內的死胎、切除腫瘤等。
改善微循環 及時糾正微循環障礙,改善組織灌流是治療DIC時的第二位的治療原則,其中包括補充血容量、糾正酸中毒、應用血管活性藥物、增強心功能。
恢復凝血和纖溶的正常的動態平衡 臨床上DIC時凝血和纖溶兩個病理過程往往交錯在一起,但治療以抗凝為主,即使在後期以纖溶為主的DIC病人也不主張單獨使用抗纖溶藥物。應用最廣的抗凝血藥物是肝素,它不僅可以抑制凝血系統的活化,還能促進纖溶、保護內皮細胞和減輕炎症反應。肝素對已形成的血栓無清除作用。繼發性纖溶帶來大量出血時,可應用纖溶抑制劑來抑制纖溶酶活性。臨床上常將肝素與6-氨基已酸(纖溶酶抑制劑)並用,治療持續性凝血和過度纖溶,以便恢復正常的凝血與纖溶的平衡。
參看
| 血液 |
|---|
| 白血病 和 白血球 |
| 淋巴系統: 淋巴性白血病 (急性, 慢性) | 淋巴瘤 (霍奇金淋巴瘤, 非霍奇金淋巴瘤) | 淋巴增生 | 骨髓癌 (多發性骨髓癌, 質漿細胞瘤) |
| 骨髓: 骨髓性白血病 (急性, 慢性) | 骨髓增殖性疾病 (原發性血小板增多症, 紅血球增多症) | 骨髓成形不良症候群 | 骨髓纖維化 | 嗜中性白血球過低症 |
| 紅血球 |
| 貧血 | 血色病 | 鐮狀細胞貧血 | 地中海貧血 | 溶血性貧血 | 再生不良性貧血 | 蠶豆症 | 遺傳性球形紅細胞增多症 | 遺傳性橢圓形紅血球增多症 | 其他血紅蛋白病 |
| 凝血因子和血小板 |
| 血栓形成 | 深靜脈血栓形成 | 肺栓塞 | 血友病 | 自發性血小板缺乏紫斑症 | 血栓性血小板缺乏紫斑症 | 彌散性血管內凝血 |
| 關於「彌散性血管內凝血」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |