外科學總論/臟器移植
| 醫學電子書 >> 《外科學總論》 >> 器官移植 >> 臟器移植 |
| 外科學總論 |
|
|
根據全球移植中心登記名錄的資料統計,到1992年底,全世界有1 406個中心在開展臨床器官移植:腎移植,506個中心,移植294 292例次,最長有功能存活29年11個月。骨髓移植,263個中心,移植44 996例次,最長有功能存活24年。肝移植,157個中心,26 371例次,最長有功能存活22年11個月。心移植,226個中心,移植25 331例次,最長有功能存活21年7個月。列入記錄的還有胰腎聯合移植(102個中心,3 071例次),單純胰腺移植(78個中心,1 424例次),肺移植(74個中心,1 830例次)。
(一)腎移植 腎移植是臨床各類器官移植中療效最穩定和最顯著的。一般而言,親屬供腎較屍體腎移植為佳,自80年代以來,由於HLA配型的進展,現代外科技術和麻醉的進步,新免疫抑制劑環孢素A、單株抗體OKT3等的應用,有的屍體腎移植1年有功能存活率達80%以上,病人存活率達90~95%。長期存活者工作、生活、心理、精神狀態均屬滿意。我國腎移植開始於70年代,到1993年底已達11 971例次,已有2個單位(北京友誼醫院、上海長征醫院)累積超過1 000例次。近3年來每年連續超過100例次的單位有5個(上海長征醫院、北京友誼醫院、武漢同濟醫院、廣州南方醫院和中山醫科大學附屬一院)。移植腎1年有功能存活率達86.5%。我國腎移植以屍體腎移植為主。
一般來說,凡是慢性腎功能衰竭已發展到終末階段,經一般治療無明顯效果時(如尿素氮持續在35.7mmol/L以上,血肌酐707~884μmol/L以上,肌酐清除率低於5~10ml/min),都是腎移植的適應徵。原發疾病常見的是慢性腎小球腎炎,還有慢性腎盂腎炎、多囊腎,以及腎硬化、糖尿病性腎小球硬化和因外傷或疾病以致喪失孤立腎或雙明等少見疾病。澱粉樣變性、結節性動脈周圍炎和彌濕性血管炎等禁忌作腎移植。一般要求年齡在55歲以下。活動性感染、心肺肝等重要器官明顯損害和全身情況不能忍受移植術者也屬禁忌。
腎移植手術已定型,移植腎放在髂窩,腎動脈與髂內動脈端端吻合,腎靜脈與髓外靜脈端側吻合。輸尿管經過一段膀胱粘膜下隧道與膀胱吻合,以防止尿液迴流。
(二)肝移植 肝移植的適應證在兒童多為先天性膽道閉鎖、某些先天性肝代謝障礙(肝豆狀核變性、α1抗胰蛋白酶缺乏,高酪氨酸血症);在成人則末期非酒精性肝硬變、膽汁性肝硬變、慢性侵襲性肝炎、累及兩側的原發性肝癌等。長期以來認為肝移植屬於擇期性手術,急性肝功能衰竭不能施行急診肝移植。但近年來,陸續有應用肝移植治療急性肝昏迷獲得成功的。肝移植標準術式是原位移植。但鑒於供肝來源缺乏,陸續有許多新的術式創製,多數著眼於充分利用或開拓供肝渠道,如①減體積性肝移植:切取成人屍體部分肝,移植給患兒。②活體部分肝移植:實際上是一種供直來自活體的減體積性肝移植,供者絕大多數是親屬;為了保證供者安全,切取移植的部分肝僅限於肝左外葉(Ⅱ~Ⅲ段)。③劈離式肝移植:將一個屍體供割成兩半,同時分別移植給兩個不同受孝順,簡稱「一肝二受」。④背馱式原位肝移植:即保留受者下腔靜脈的原位肝移植。手術時將肝置於原位,其肝中、肝左靜脈共乾和受者所保留的同名共干作端端吻合,而供肝的肝下下腔靜脈遠端則自行縫閉。移植完畢後,新植入的肝,外觀如被受者肝下下靜脈馱著,故取該名(圖17-1)。此術式只適用於肝的良性病變,不適於肝癌。肝移植術後早期死亡多由於技術併發症,晚期多由於膽道併發症、全身感染、癌腫複發、排斥反應等。
(三)心移植 適應證是:晚期的心臟不治之症,估計存活期在半年以內者,原發病為冠狀動脈疾患、自發性心肌病變、多瓣膜病變合併心肌病等。受者有嚴重的對血管擴張劑無反應的肺性高血壓[肺動脈壓高於8.0kPa(60mmHg)和肺血管阻力超過8WoodU]、活動性感染、新近有心肌梗塞、嚴重糖尿病,有嚴重腦或周圍血管疾病和精神狀態不穩者均屬忌證。近來獲得較好進展的原因是:嚴格控制適應證,應用免抗人胸腺細胞球蛋白作免疫抑制,用T-淋巴細胞監測或經靜脈作右室心內膜活檢來診斷早期排斥反應和及時的心再次移植。
(四)胰腺移植 術式頗多,主要涉及胰管處理,這是胰腺移植的關鍵。胰腺有外分泌(胰液)和內分泌(胰島素)兩種功能,供胰植入後只要求恢復後者。但如胰管處理不當,就會使有強大消化能力的胰液冷飲溶解植入胰和腹內肘器,發生嚴重併發症而導致移植失敗。胰管有採用化學粘合劑予以阻塞或引流至空腸、膀胱,後者因其能觀察尿澱粉酶突然下降而早期診斷急性排斥,已成為熱門術式。目前多採用的是全胰帶十二指腸段膀胱吻合術式(圖17-2)。胰腺移植適應證是藥物治療失效的胰島素信賴型糖尿病(Ⅰ型糖尿病);年青患者已發生腎功能衰竭者,應作胰腎聯合移植。
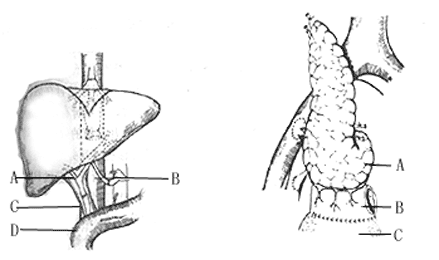
圖17-1 背馱式肝移植
圖17-2 全胰帶十二指腸段膀胱吻合術式
A.供胰 B.十二指腸 C.膀胱
(五)脾移植 帶血管同種脾移植國外共施行8例,因效果不佳而放棄。屍體脾移植最長有功能1例僅44天;父親供脾移植治療血友病甲,術後有功能4天,因移植脾破裂而切除。我國同濟醫科大學應用屍體脾移植治療重症血友病甲3例,最長有功能1年,1989年改用活體供脾已4例(親母3例、親父1例),移植後均有功能存活,凝血因子Ⅷ:C自術前0%上升,並維持於10%以上,自發性出血停止,最長1例迄今已3年,創造了國際最佳紀錄。
供者與受者 移植用的器官可來自活體或屍體;成對器官如腎,可來自同胞(同胞移植)或父母(親屬移植),自願獻出一個健康腎,或雖是單一器官,也可獻出部分而功能足夠的臟器,如肝、胰腺,但也可取自屍體。單一而又不能分割的器官,如心,則屍體是唯一來源。
(一)供者選擇
1.免疫學方面的選擇 有兩大類抗原系統的器官移植排斥中起明顯作用,即ABO血型抗原和白細胞抗原。兩者都是組織相容性抗原。人的活性細胞(包括各種器官細胞)的表現,都有這兩類抗原。因此,同種異體間器官移植都會發生排斥反應。為了預防過劇的、甚至致命的排斥反應,移植術前應作下列檢查:
(1)血型:ABO血型必須相同。不同血型間的同種移植,特別是腎移植,絕大多數會迅速發生超急性排斥反應。
(2)交叉配合與細胞毒性試驗:交叉配合是指受者、供者間的血清與淋巴細胞的相互交叉配合。細胞毒性試驗是指受者的血清與供者淋巴細胞之間的配合,也是交叉配合的一個組成部分。細胞毒性試驗是臨床上必須作的。如果受者以前曾經受過輸血或有過妊娠,很可能其血清內已有預選形成的抗本(所謂「已致敏血清」),則細胞毒性試驗可呈陽性,器官移植術後,就會發生超急性排斥反應。一般說來,腎移植淋巴細胞毒性試驗必須<10%或陰性,才能施行。
(3)混合淋巴細胞培養:將供者與受者的淋巴細胞放在一起培養,觀察其轉化率,是組織配型的試驗中最可靠的一生中 。有單相法和雙相法,而以前者為佳。將續完絲裂黴素或照射處理的、已不會轉化但仍保留其抗原特性的供者淋巴細胞和未經過處理的受者淋巴細胞放在一起培養的,稱為單相法;如果放在一起培養的供者和受者的淋巴細胞,都是沒有處理過的,則叫做雙相法。淋巴細胞轉化率如超過20%~30%,說明供受者的淋巴細胞抗原不同,即應放棄作器官移植。此法的缺點是觀察結果需5~6日,為期太久,限制了它的實際應用價值。
(4)人類白細胞抗原(HLA抗原)的血清學測定(HLA配型):國際標準是直接測定供者與受者HLA-A、HLA-B與HLA-DR共6個位點。歷來統計表明,HLA6個位點配型與親屬腎移植、骨髓移植的存活率有較密切關係。從近年資料來看,HLA與屍體腎移植預後也有很大的關係,如有報告3002 屍體腎移植5年功能率,在HLA-A、B完全相符者為55.6%,而有3、4位點不相符者為39.6%。資料還表明:HLA-DR配型對屍體腎移植的預後更為重要,HLA-A、B和DR完全相符時,一年移植腎存活率高達93%,而HLA-DR相符而HLA-A、B有一個位點不符時,一年移植存活仍高達89%,但如HLA-A、B完全相符而HLA-A、DR有一個位點不符時,一年腎存活率下降到70%。
但是,其他器官移植(如肝移植)和另有一些人屍體腎移植的效果,不符合上述規律,甚至出現相反結果,這顯然與下列情況有關:①器官移植排斥並不單純由HLA配型決定;②就HLA抗原系統來說,目前的認識也遠不完善。最新資料發現HLA抗原中Ⅱ類抗原:HLA-D、-DR、DQ在排斥反應中起主要作用,但Ⅰ類抗原仍有影響。近來,國內外的先進單位已採用多聚酶鏈反應(PCR)技術,把HLA配型提高到DNA分子水平。
此外,尚有血小板補體結合試驗、花環試驗、花結抑制試驗等的組織配型方法。
2.非免疫學方面的選擇 年齡不超過50~55歲。沒有血管性疾病、高血壓、血液病、肝炎或惡性腫瘤。有全身感染和局部化膿性疾病者都不宜選用。心、肝、腎功能要良好。體重與身體應與受者相仿,供移植用的器官的體積,要和切除的病人的器官相等或略小,不宜過大。
(二)受者選擇 應嚴格遵守手術適應證。年齡不宜超過55~60歲。除需切除的有病器官外,其他重要器官功能應良好,一般情況應能忍受大手術。沒有感染性疾病。
以前認為腎移植術前輸血可以導致超急性排斥,目前看法有了改變。70年代以來許多統計表明:術前輸血反應而能延長存活,提高成功率20%;至於輸血次數、間隔時間,意見尚未一致。
供移植用臟器的保存
1.保存原則 器官移植要求移植一個活的器官。但是,以手術切取的、已沒有血液供應的器官,在35~37℃的常溫下(稱為熱缺血)短期內即趨向死亡。因此,要延長供移植用器官存活時間的關鍵,在於中斷血液循環後迅速降溫,盡量縮短熱缺血時間。換言之,迅速變熱缺血為冷缺血。目前,供移植用臟器的保存,都是應用「低溫」原則。
2.保存方法 目前通用的方法是冷貯存法,也叫單純低溫灌洗保存法。將切取的臟器,用一種特製的冷溶液(0~4℃)先作短暫的沖洗,使其中心降溫到10℃以下,然後保存於2~4℃,直至移植。1969年Collins等人應用「仿細胞內液型」溶液(是一種高鉀、高鎂而低鈉的高滲溶液)作冷灌洗,臨床上能安全地保存人腎20~24小時,移植後腎功能恢復良好。國際上運用仿細胞內液型溶液原理而研製的通用的保存液有Collins C2液歐洲Collins液、Ross液和我國上海的的HC-A液、武漢的WMO-1號液。但是,Collins類型保存液對肝、胰腺等其他臟器的冷保存時間遠沒有腎那樣長,肝不能超過10小時,胰腺宜在6小時內,極不理想,也說明保存液對臟器有特異性。
1988年國Wisconsin大學Belzer創製了一新保存液,為紀念學校面取名為UW液,其配方業已公布(表17-1)。UW液的特點有:①不含葡萄糖,而用乳糖鹽作為非滲透陰離子,加棉糖作為附加的滲透支持。②含羥乙基澱粉,作為有效膠體發揮其滲透壓力,可以阻止有害的細胞間隙擴大。③以磷酸鹽預防酸中毒。④用谷胱甘肽、別嘌噙醇對抗氧自由基。臨床證實UW液可保存胰腺、腎達72小時,保存肝20~24小時。現在,UW液及其各種UW型改良液已在國際上日益廣泛應用,有替代Collins類型溶液的明顯趨勢。
表1217-1 UW冷保存液的組成
| 成分 | 每L含量 | 成分 | 每L含量 |
| 乳糖鉀鹽 | 100mmol | 胰島素 | 100U |
| KH2PO4 | 25mmol | 青黴素 | 40U |
| MgSO4 | 5mmol | 地塞米松 | 8mg |
| 棉糖 | 30mmol | 別嘌呤醇 | 1mmol |
| 腺苷 | 5mmol | 羥乙基澱粉 | 50g |
| 谷胱甘肽 | 3mmol |
註:此溶液在室溫下用NaOH調至pH7.4,最後濃度為:Na+:30±mmol,K+:120±5mmol,滲透量:320±5mmol/L
同種異體移植術後排斥反應 分為三類:超急性、急性和慢性排斥。這種分類不單純是時間概念,它包含著不同的發生機理、臨床和組織學上的特點。
1.超急性排斥 在移植術後24小時,甚至幾分鐘、幾小時內出現。超急性排斥發生在:①受者、供者的ABO血型不合;②由於有過妊娠;已做過其他器官移植,受體血清內已有抗體形成。從免疫學來說,是由於移植器官細胞膜上的抗原和受者的循環抗體之間發生對抗所致。因為這些抗體都是預先存在於受體內,所以,超急性排斥反應在移植術後便迅速發生。在組織學的表現,主要是移植器官的小血管腔內有血小板、中性粒細胞聚積和纖維蛋白沉著所造成的廣泛血栓、血管阻塞和組織梗死;其切面可見嚴重的瀰漫性出血。臨床上,移植器官功能迅速衰竭,如移植腎立即中止排尿,出現無尿。
超急性排斥反應的預防,在於供者與受者血型必須相同,並且不要在抗淋巴細胞抗體強陽性、交叉配合陽性時作器官移植。
2.急性排斥 發生在移植器官功能恢復後,往往在術後幾日、幾周以內或術後一年內多次重複出現。主要症状產突然發生的寒戰、高熱,因移植體腫大所致的局部脹痛,一般情況變差和移植器官功能減退,如腎移植時出現排尿驟停、血肌酐和尿素氮增加;肝移植有明顯的黃疸加深,血轉氨酶、膽紅質迅速上升。組織學的主要表現為瀰漫性間質性水腫和圓細浸潤,後者包括漿細胞、小淋巴細胞、巨噬細胞、單核細胞和中性粒細胞等。移植體的小動脈和毛細血管肉用纖維蛋白和血小板沉澱而引起的梗死。
急性排斥反應是移植器官細胞的HLA抗原和受者的致敏淋巴細胞之間發生對抗所致。這種排斥反應歷經連續性階段:①移植術後,移植器官活性細胞所帶有的HLA抗原,被受體的胸腺信賴淋巴細胞(T-淋巴細胞)所「認辨」為異物;②淋巴細胞受到「激化」而進入「致敏」狀態;③致敏淋巴細胞大量增殖;④增殖的致敏淋巴細胞對移植器官進行攻擊,即為排斥反應。每一階段都需要一定的時間,因此,首次急性排斥最早約在移植術後幾日(約為5~14日)內發生。
3.慢性排斥 發生在移植術後幾年中。從腎移植來看,慢性排斥的主要臨床表現是:腎功能減退、蛋白尿和高血壓。其組織學的病變可歸納為三大類:①腎小球病變,複發性或排斥性腎小球炎,出現上皮細胞肥大、空泡樣變,伴有上皮細胞足突的局灶性副合;②非常緻密和瀰漫的進行性間質纖維化;③彌散性纖維性動脈內膜炎,伴有管腔閉塞。
急性排斥反應的防治 臨床常用的免疫抑製藥有:環孢素A、腎上腺皮質類固醇類藥、抗淋巴細胞球蛋白、單株抗體、硫唑嘌噙和環磷醯胺等幾種。最近,FK506已獲生產銷售批准。
1.環孢素A 已被公認為新一代的強有力的免疫抑制劑而被首選。是臨床上各種同種器官移植術後聯合用藥藥方案中的最主要抗急性排斥反應的藥物。環孢素A是一種從孢子木黴菌中分離得到的不溶於環狀十一肽,其作用是抑制T淋巴細胞活化所需的、由T輔助細胞所產生的白細胞介素-2。臨床應用於腎、肝、心、胰、脾等移植,都獲相當滿意的免疫抑制效能,據國際文獻報告腎移植的最初劑量是每日~15mg/kg,每月遞減2mg/kg,直到每日~6mg/kg作為維持量。臨床上常與小劑量腎上腺皮質類固醇類藥聯用,也有再加硫唑嘌呤成三聯。環孢素A由瑞士Sandoz藥廠生產,商品名為山地明(Sandimmun),最近該廠又有新的劑型出台,名為瓣山地明(Sandimmun Neoral),是一種山地明微乳劑,有利於穩定吸收。環孢素A毒性較小,幾無抑制骨髓的作用,主要副反應是有一定腎、肝毒性和多毛症,或說使淋巴瘤發病率有所增加。
2.腎上腺皮質類固醇類藥 常用的有甲基強的松龍、琥珀酸氫化可的松、強的松龍、強的松和地塞米松等,前二者靜脈注射,後三者常作口服。此類藥物常在術前、術中開始應用,但對術後急性排斥危象特別有效,常作短期大劑量衝擊療法,如連續幾天靜脈滴注琥珀酸氫化可的松,用量可達3g以上或短期用強的松3~4mg/kg。
皮質類固醇類藥的作用是多方面的,如抑制吞噬作用,抑制蛋白、核糖核酸、抗體的合成,具有淋巴溶解和強有力的抗炎作用。它對T-淋巴細胞的作用較對B-淋巴細胞為強。常見的副作用是促進感染,引起消化道應激性潰瘍導致上消化道出血,糖尿病和長期服用後出現柯興症候群面容。
3.硫唑嘌呤 它是6-巰基嘌呤咪唑衍生物,是一種抗代謝藥物。常用的口服製劑,吸收迅速,主要經腎排出。一般在術前3日開始,在術後繼續,並終身使用。腎移植用量開始每日~5mg/kg,以後維持量約為2mg/kg。肝移植用較小量,如0.5~1mg/kg。硫唑嘌呤的副作用為抑制骨髓生長,以致白細胞計數減少;其次對肝有一定的毒性,引起膽汁鬱積和肝炎。也有報導認為能助長惡性腫瘤的發生。
4.抗淋巴細胞球蛋白(ALG) 臨床應用的抗淋巴細胞蛋白製劑的血清,大都來自馬、羊、豬或家兔;用作抗原的淋巴細胞取自胸導管、周圍血液、淋巴結、胸腺和脾臟。抗淋巴細胞球蛋白能直接作用於循環血液中的淋巴細胞,特別是T-淋巴細胞予以溶解或經調理後被網狀內皮系統所清除。
抗淋巴細胞球蛋白有肌內注射靜脈滴洋兩種製劑。副作用有因馬血清引起的過敏現象,如蕁麻疹、全身不適、高熱、低血壓、甚至過敏性休克。肌肉注射時可以引起局部疼痛、紅腫炎性硬塊。
5.單株抗體(單抗) 全稱應為抗人淋巴細胞及其亞群(表現抗原決定簇)的單株抗體。是將人類T淋巴細胞懸液免疫的小鼠手的抗體生成細胞與小鼠骨髓瘤細胞在體外融合所獲得的,並在美國由Ortho藥品公司製成商品製劑,被稱為OKT系列單株抗體。國外廣泛用於臨床。0的是OKT3,其靶分子是人類成熟T細胞所特有的T3抗原(國際命名CD3),能抑制其增殖與殺傷功能。國內,系列單抗已由武漢生物製品研究所試製成功,並由同濟醫科大學首先應用於腎移植。在環孢素A三聯基礎上,加用單抗能逆轉難治性急性排斥,單抗對預防也有作用。療程為10天,不超過2周。
6.環磷醯胺 是一種烷化劑,常用來代替硫唑嘌呤,常用量為1.5~3mg/kg。
7.FK506 是日本藤澤公司從tsukubaensis鏈黴菌中提取的大環內酯類物,其分子式為C44H60NO12H2O,其免疫作用在於抑制T細胞的活性和多種細胞因子的產生與表達,其中最主要的是白細胞介素-2和γ干擾素。FK506主要應用於肝移植和小腸移植,對各種器官移植後頑固性排斥也有效。先靜脈滴注,首次為0.15mg/kg,以後改為0.025mg/kg,12小時1次。2~3天後改口服,劑量為0.15mg/kg,每天2次,亦可與小劑量激素聯用。FK506具有輕度腎毒性以及頭痛、噁心、皮疹、震顫、失眠和毛髮脫落等副作用。
此外,在國外還有RS-61443亦已進入臨床,主要應用於腎移植、肝移植術後以環孢素、激素和硫唑嘌呤維持的,並以大劑量激素、OKT3作衝擊而未能逆轉的難治性急性排斥者。RS-61443口服劑量為2g/d,有腹瀉、白細胞減少、瘀膽、關節痛等副反應。作用是抑制T和B細胞增殖及抗體形成。
| 關於「外科學總論/臟器移植」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |