營養學/蛋白質的生化
| 醫學電子書 >> 《臨床營養學》 >> 蛋白質 >> 蛋白質的生化 |
| 臨床營養學 |
|
|
蛋白質分子是生物大分子,分子量約從5,000到數百萬。其基本單位是胺基酸,通式為:
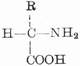
由於氨基和羧基都在α-C上,故稱為α-胺基酸。式中R表示側鏈。側鏈不同,胺基酸的種類就不同。組成蛋白質的胺基酸一共有20種,各胺基酸按一定的排列順序由肽鍵(醯胺鍵)聯結成長鏈。肽鍵是由一個胺基酸殘基的α-羧基和另一個胺基酸殘基的α-氨其組成,如下所示:
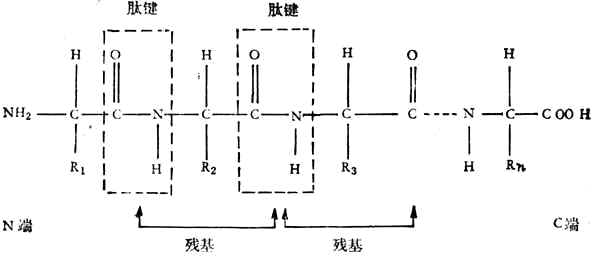
一個蛋白質分子由一個或幾個肽鏈組成,每個鏈大約含有20到幾百個胺基酸殘基。肽鏈的氨基端稱為N-端、羧基端稱為C-端。蛋白質有一級結構、二級結構、三級結構、四級結構。一級結構只指肽鏈中胺基酸排列的順序,二至四級結構表明主、側鏈空間排列的關係。分子量超過1,000,000的蛋白質都有四級結構。
按照胺基酸側鏈及氨基與羧基的數量,可將20種胺基酸分為三類(表2-1)。
這20種胺基酸在體內能參與蛋白質合成,都是人體所不可缺少的。其中異亮氨酸、亮氨酸、賴氨酸、蛋氨酸、苯丙氨酸、蘇氨酸、色氨酸、纈氨酸、組氨酸(表2-1)9種,在體內不能自行合成,或合成速率不能滿足機體需要,必須由食物供給。這些胺基酸稱為必需胺基酸。9種中的組氨酸是嬰幼兒必需胺基酸,嬰兒缺乏時患濕疹。其餘11種在體內能自行合成,稱為非必需胺基酸。但是半胱氨酸和酪氨酸在體內能分別由蛋氨酸和苯丙氨酸合成,這兩種胺基酸如果在膳食中含量豐富,則有節省蛋氮酸與苯丙氨酸兩種必需胺基酸的作用,因此有時稱為半需胺基酸。
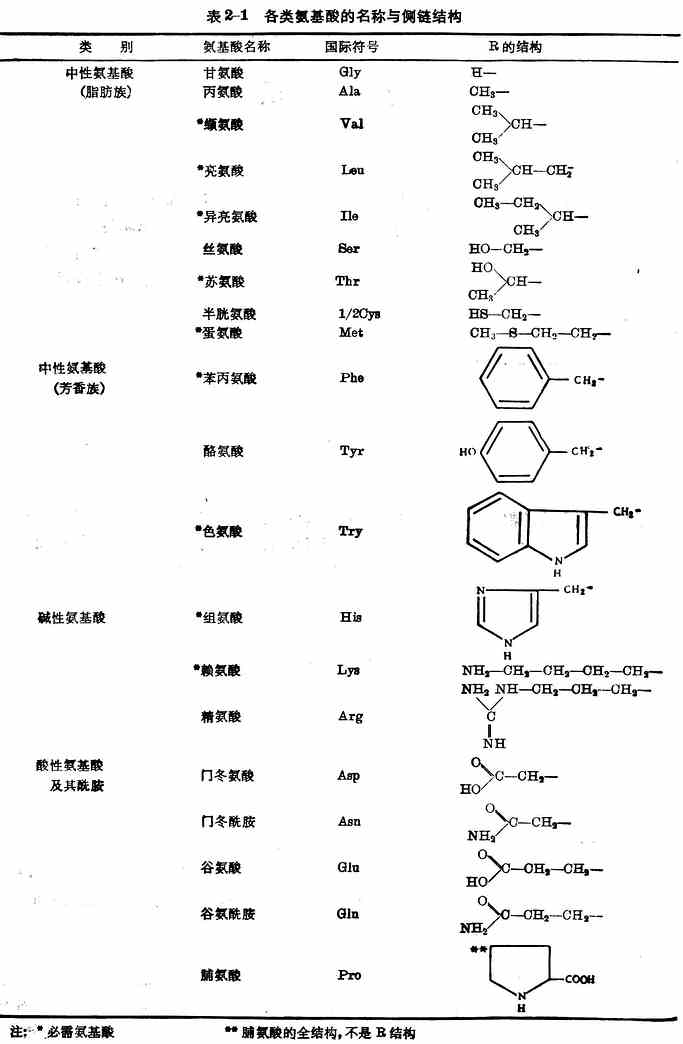
註:*必需胺基酸 **脯氨酸的全結構,不是R結構
蛋白質合成後,分子中某些胺基酸的衍生物。如兩個半胱氨酸可借二硫鍵結合形成一個胱氨酸;膠原中的賴氨酸可羥基化成為羥賴氨酸;肌肉蛋白中的組氨酸經甲基化合成3-甲基組氨酸等。這些衍生物或者被排泄或繼續分解代謝,不能再合成蛋白質。
從胺基酸的結構看,除甘氨酸外,其餘胺基酸的α-碳原子都是不對稱的,因而都具有旋光性。將α-碳原子的構型和甘油醛比較,可以見到蛋白質中的胺基酸都是L型的。L型和D型胺基酸的代謝反應不同,人體能利用所有的L型胺基酸而對D型的僅限於蛋氨酸和苯丙氨酸。
胺基酸分子上含有氨基和羧基,故稱兩性電解質,每一種胺基酸都有特定的等電點。胺基酸能與金屬離子或酸生成鹽、與醇生成酯、與有機酸形成醯胺化合物。胺基酸分子上還含有不少特殊基團,可與種種物質進行化學反應,參與機體代謝作用。在生化檢驗中,胺基酸能與某些試劑生成有色化合物,構成胺基酸定性、定量測定的基礎。如大多數胺基酸與茚三酮反應生成藍紫色化合物。
蛋白質由胺基酸組成,除具有與胺基酸相似的化學性質外,還有膠體性質和凝固、變性等現象。蛋白質顆粒大,且表面帶有許多極性基團,在溶液中有高度的親水性。因此蛋白質水溶液是一種較穩定的親水膠體。少量的親水膠全可以和大量水分結合,形成各種流動性不同的膠體系統,這就形成了各種組織細胞不同的形狀、彈性和粘度。
蛋白質的分類方法很多。為了從不同角度了解蛋白質的概況,現將幾種分類方法簡介如下。
按照蛋白質中必需胺基酸的含量分類:
(1)完全蛋白 蛋白質組成中含有全部的人體必需胺基酸,如酷蛋白、卵蛋白。
(2)不完全蛋白 蛋白質組成中缺乏一種或幾種人體必需胺基酸,如白明膠。
按照蛋白質的結構和溶解度分類:
(1)簡單蛋白 包括動、植物組織中的白蛋白、球蛋白和植物組中的谷蛋白、麥醇溶蛋白,還有動物組織中含鹼性胺基酸比較多的魚精蛋白、組蛋白。
(2)硬蛋白 包括溶解度最低、不易消化的毛髮、指甲、蹄、角中的角蛋白和皮膚、骨胳中的膠原蛋白、彈性蛋白。
(3)結合蛋白 包括在蛋黃中與磷酸組成的磷蛋白、與脂肪或類脂組成的脂蛋白和在骨胳、肌腱、消化液中與糖結合的粘蛋白、糖蛋白,與核酸、血紅素、金屬結合的核蛋白、血紅蛋白、金屬蛋白等。
按照蛋白質的功能分類:
(1)活性蛋白 包括在生命活動過程中一切有活性的蛋白質:如酶、激素蛋白、輸送和儲存蛋白、肌動蛋白、受體蛋白等。
(2)非活性蛋白 包括不具活性的、擔任生物保護和支持作用的蛋白質:如膠原、角蛋白、彈性蛋白等。
以上各種分類方法都有一定的局限性,隨著科學研究的發展,將不斷補充修正。
2.2.2 游離胺基酸代謝庫
體內胺基酸有結合型和游離型兩種。結合型的濃度平均為2mol,而游離型約0.01mol,為結合型的0.5%。從幼年大鼠組織中胺基酸的分布看出,游離型必需胺基酸在組織和血漿中的濃度都很低,而丙氨酸、谷氨酸、谷氨醯胺和甘氨酸四種非必需胺基酸在組織中較高、血漿中則低(表2-2)。說明這幾種非必需胺基酸能廣泛在細胞內合成和儲留。將體內游離必需胺基酸的濃度與大鼠每日胺基酸需要量比較(表2-2),游離胺基酸庫每日必須轉換數次才能滿足大鼠生長的需要量。
表2-2 幼鼠(50g)體內胺基酸濃度和必需胺基酸需要量
| 蛋白質 | ||
| g.100g-1食物* | KJ.100kJ-1食物** | |
| 蘋果 | 0.3 | 2.8 |
| 稻米(上白梗) | 6.7 | 7.8 |
| 帶魚 | 18.1 | 52.1 |
| 小麥粉(富強粉) | 9.4 | 10.7 |
| 土豆 | 2.3 | 11.9 |
| 花生米 | 26.2 | 19.2 |
| 瘦豬肉 | 16.7 | 20.2 |
| 雞蛋 | 14.7 | 34.6 |
| 黃豆 | 36.3 | 35.2 |
| 豆腐(北) | 7.4 | 41.1 |
| 牛肉 | 20.1 | 46.7 |
血漿游離胺基酸經細胞膜進入組織細胞。在細胞上膜上具有轉運中性、鹼性、酸性各種類別胺基酸的載體,各類中不同胺基酸之間具有相互競爭的作用。
胺基酸在體內代謝途徑可以歸納為三種:①摻入組織蛋白。經過一段時間後,隨著組織蛋白的分解,又重入游離胺基酸庫;②進行分解代謝。其碳架形成CO2呼出、或轉化為糖原和脂肪蓄積,其氨基形成尿素排出;③合成其他含氮化合物,如嘌呤鹼、肌酸、腎上腺素。這些物質繼續降解不再返回遊離胺基酸庫。此外,還合成其他非必需胺基酸。
2.2.3 胺基酸轉變為生理活性物質
胺基酸在體內主要是用來合成蛋白質,少量用於合成其他一些有生理活性的物質。
合成非必需胺基酸:酪氨酸和半胱氨酸分別由苯丙氨酸和蛋氨酸衍生而來,其他非必需胺基酸可由檸檬酸循環所產生的α-酮戊二酸或其他胺基酸與酮酸形成(圖2-1)。
上述合成不普遍存在於各種組織,如苯丙氨酸只在肝臟受羥化酶催化而形成酪氨酸。
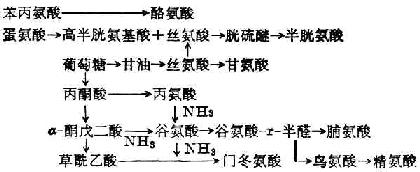
圖2-1 非必需胺基酸的合成
嘌呤和嘧啶的生物合成:嘌呤和嘧啶鹼可從食物供給,也能在體內自行合成。合成的主要原料是門冬氨酸、谷氨醯胺、甘氨酸等。
肌酸和肌酸酐的生物合成:肌酸由食物供給,也可以在體內從蛋氨酸、甘氨酸和精氨酸合成。肌酸由血液送至肌肉,被主動吸收,每天轉換率為2%。體內大部分肌酸以肌酸和磷酸肌酸的形式儲於骨胳肌。在靜止的肌肉中則以磷酸肌酸為主,而在疲勞的肌肉中,磷酸肌酸濃度卻很低。這是由於磷酸肌酸在磷酸肌酸轉移酶的作用下,轉變為肌酸和ATP的結果:
![]()
這個反應使肌肉在無氧條件下,能從磷酸肌酸獲得附加的但數量有限的ATP。不論肌酸或者磷酸肌酸主要通過非酶脫水反應緩慢而不可逆地形成肌酸酐。肌酸酐不被利用,進入血液隨尿排出,每日肌酸酐生成的量相當恆定,約為總肌酸庫的1.7%。
2.2.4 蛋白質的生物合成和周轉
蛋白質有高度的特異性。食物蛋白必須經過消化水解成為胺基酸而吸收,再合成人體所需要的各種蛋白質。蛋白質的合成體系主要由信使核糖核酸(mRNA)、轉運核糖核酸(tRNA)、核糖核蛋白體核酸(rRNA)和某些蛋白質因子共同組成。mRNA是蛋白質合成的模板,tRNA是搬運胺基酸(原料)的工具,rRNA相當於裝配機,促進胺基酸相互以肽鍵相結合。各種胺基酸在各自的搬運工具攜帶下,在裝配機上按照模板的要求有次序地相互結合,生成具有一定胺基酸排列順序的特定多肽鏈。合成後的多肽鏈,有的經過一定處理,有的與其他多肽鏈、糖、脂質等結合後形成具有生物活性的蛋白質。當合成原料(特別是必需胺基酸)供給不足時,可引起細胞內蛋白質合成減緩或停止。
每日蛋白質合成的量取決於生長、合成各種酶和修補組織細胞的需要。各種組織細胞合成與分解的速率差異很大,如小腸粘膜每1~2天更新一次而紅細胞的壽命則約為120天;又如用同位素研究表明每天能合成血漿白蛋白10g、纖維蛋白2g,而幼年大鼠骨胳中膠原的生物半壽期卻長達300天。用給予人體標記15N胺基酸方法估計不同年齡組成蛋白質合成的速率,得出體重約70kg的成年男子每日蛋白質合成量大於200g(表2-3)。這個數量超過成人每日蛋白質需要量或攝入量若干倍,因而可以理解陳舊蛋白質分解產生的胺基酸仍能用於蛋白質的再合成。
表2-3 不同年齡組總蛋白質合成率
| 年齡組 | 人數 | 體重(kg) | 年齡(範圍) | 總蛋白質合成率(g.kg-1.d-1) |
| 新生兒(早產) | 10 | 1.94 | 1~46天 | 17.46 |
| 嬰兒 | 4 | 9.0 | 10~20月 | 6.9 |
| 青年 | 4 | 71 | 20~23歲 | 3.0 |
| 老年 | 4 | 56 | 69~91歲 | 1.9 |
2.2.5 胺基酸的降解
各種胺基酸按照特定的化學反應進行降解。圖2-2表明大鼠體內胺基酸降解的主要場所和產物。

圖2-2 胺基酸主要降解場所與產物
有7種必需胺基酸主要在肝臟降解,其餘異亮氨酸、亮氨酸、纈氨酸3種必需胺基酸(支鏈胺基酸)主要在肌肉中以及腎、腦中降解。支鏈胺基酸在肌肉中經轉氨基作用變為丙酮酸和谷氨酸,繼而分別形成丙氨酸和谷氨醯胺,再經血循環分別送到肝臟和腸。在腸壁轉變為丙氨酸和谷氨酸。丙氨酸經門靜脈送入肝臟,其氨基形成尿素、碳架經糖原異生作用轉為糖(圖2-3)。
尿素的形成幾乎全部局限在肝臟中,因肝臟是唯一含有精氨酸酶的組織。首先是氨和CO2合成氨甲醯磷酸,然後經過瓜氨酸、精氨(酸代)琥珀酸、精氨酸等一系列合成反應(圖2-4),最後精氨酸在精氨酸酶的催化下分解為尿素和鳥氨酸。鳥氨酸重返尿素合成的循環,尿素隨尿排出。
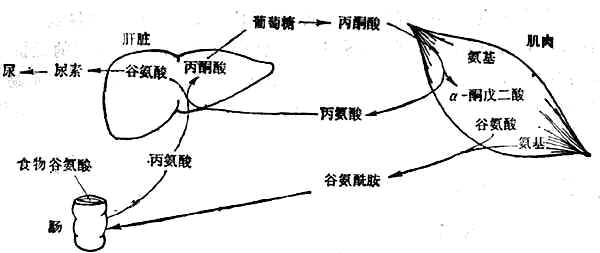
圖2-3 葡萄糖-丙氨酸循環
CO2+NH3+ATP
↓
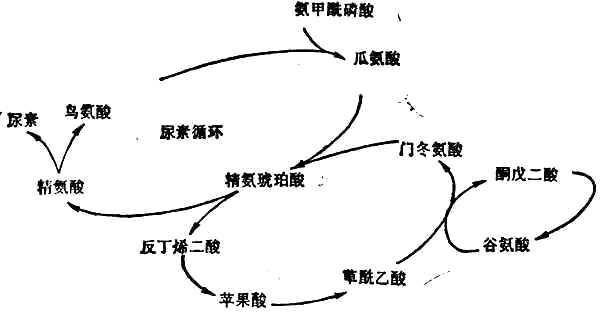
圖2-4 尿素合成的途徑
尿氨是蛋白質代謝的最終產物之一,在腎臟合成。由血漿送來的谷氨醯胺,在腎臟的近曲小管上皮細胞中,經谷氨醯胺酶催化水解為氨和谷氨酸鹽。谷氨酸鹽在谷氨酸脫氫酶的催化下,又產生氨和α-酮戊二酸。氨隨尿排出;α-酮戊二酸經糖原異生作用形成葡萄糖,送入血循環重新利用。在飢餓或糖尿病等發生酸中毒的情況下,尿氨增多,腎臟既排泄氨又成了供給葡萄糖的場所。氨的形成也使身體保存了鈉離子,否則鈉離子將用於中和酸而被排出。
| 關於「營養學/蛋白質的生化」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |