21-羥化酶缺陷症
| A+醫學百科 >> 21-羥化酶缺陷症 |
多囊卵巢的激素測定為腎上腺DHEAS生成增加,21羥化酶或11β羥化酶缺陷。多囊卵巢症候群是一種卵巢增大並含有很多充滿液體的小囊,雄激素水平增高、不能排卵的內分泌疾病。最顯著的特徵是無排卵。
目錄 |
21-羥化酶缺陷症的原因
一、遺傳學因素 PCOS是一種常染色體顯性遺傳,或X一連鎖(伴性)遺傳,或基因突變所引起的疾病。多數患者染色體核型46,XX,部分患者呈染色體畸變或嵌合型如46,XX/45,XO;46,XX/46,XXq和46,XXq。
二、腎上腺萌動假說 Chom(1973)認為,PCOS起源於青春前腎上腺疾病,即當受到強烈應激刺激時網狀帶分泌過多雄激素,並在性腺外轉化為雌酮,反饋性地引起HP軸GnRH-GnH釋放節律紊亂,LH/FSH比值升高,繼發引起卵巢雄激素生成增多,即腎上腺和卵巢共同分泌較多雄激素致成高雄激素血症。高雄激素血症在卵巢內引起被膜纖維化增厚、抑制卵泡發育和卵,造成卵巢囊性增大和慢性無排卵。
(一)發病原因
PCOS的病因尚不清楚。一般認為與下丘腦-垂體-卵巢軸功能失常、腎上腺功能紊亂、遺傳、代謝等因素有關。少數PCOS患者有性染色體或常染色體異常,有些還有家族史。近來發現某些基因(如CYP11A、胰島素基因的VNTR)與PCOS發生有關,進一步肯定了遺傳因素在PCOS發病中的作用。
(二)發病機制
PCOS的發病機制複雜,已被公認的事實是:①高LH伴正常或低水平的FSH;②雄激素增多;③恆定的雌激素水平(E1比E2高);④胰島素抵抗(高胰島素血症);⑤卵巢組織形態學上有多個囊性卵泡和間質增生。
1.促性腺激素釋放異常 PCOS患者的血LH升高,而FSH正常或降低,LH/FSH≥2~3,靜脈注射GnRH後LH可出現過度反應,認為可能原發於下丘腦-垂體功能失調。在下丘腦中多巴胺能和阿片肽能神經對GnRH神經元的抑制作用失控,可導致LH分泌增加。但更可能是雌激素的反饋抑制異常所致。非周期性的腺外轉化而來的雌激素(雌酮E1)將導致對LH分泌的正反饋和對FSH分泌的負反饋抑制。LH刺激卵泡細胞增生,產生大量雄激素,雄激素不能全部轉化成雌激素,進一步增加腺外芳香化E1的生成。過多雄激素使卵泡閉鎖、卵巢包膜纖維化和包膜增厚。由於缺乏月經周期中期的LH峰值,出現排卵障礙(圖1)。此外,有人發現PCOS患者的卵巢也可能分泌「抑制素」,抑制FSH的分泌,影響卵泡的發育成熟,出現較多囊狀卵泡,近年發現高胰島素血症和增高的IGF也可使LH分泌增多。
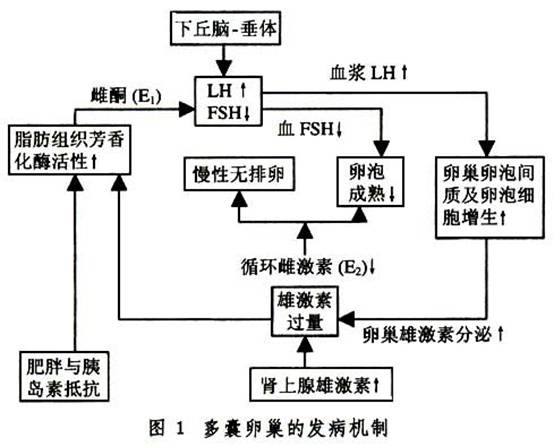
2.雄激素過多 在PCOS中,幾乎所有的雄激素生成均增多。而性激素結合球蛋白(SHBG)減少,游離雄激素增多,活性增強。至於過多的雄激素來源於卵巢或腎上腺眾說不一。大劑量GnRH激動劑可降低促性腺激素,雄烯二酮和睾酮減少,而對來源於腎上腺的DHEAS無影響。據報導大約70%的PCOS患者為卵巢源性雄激素所致:①由於類固醇激素所需酶系功能紊亂,如芳香化酶缺乏,3β-醇甾脫氫酶不足或活性下降,P45OC17A調節異常,雌激素合成障礙,大量雄激素在外周(脂肪、肝、腎內)轉換為雌酮。也有人認為卵巢發育不充分使芳香化酶的活性下降。②LH脈衝頻率及振幅升高,刺激卵泡膜細胞及間質細胞增生和雄激素的生成。過多的雄激素促使卵泡閉鎖,卵巢粒層細胞早期黃素化,生長停止,不能排卵,形成PCOS。
本病多發生在青春期月經初潮後,推測可能起因於性成熟前期,腎上腺功能失調,持續分泌過多雄激素。此外,在應用地塞米松前後測定卵巢和腎上腺靜脈血中的各種雄激素水平,其結果支持卵巢和腎上腺是PCOS過多雄激素的共同來源,發現50%PCOS患者有腎上腺源性雄激素增多。
3.雌酮過多 PCOS婦女用孕酮等藥物有撤退性子宮出血,服氯底酚胺可導致卵泡成熟排卵,月經來潮,這提示PCOS患者不但雄激素水平高,而且雌激素也增多。體內活性雌激素包括雌二醇(E2)和雌酮(E1),E2主要來源於卵巢,E1則來自卵巢、腎上腺及周圍組織的轉換。PCOS患者非周期性E1明顯增多,E1/F2比率增高(正常E1/F2≤1),特別是肥胖者的脂肪多,芳香化酶活性高,外周組織轉換增多,E1水平可更高,而且來源於外周組織的E1不受垂體促性腺激素的調節,無周期性變化。持續高水平的雌激素對下丘腦-垂體的反饋調節是不正常的。
4.細胞色素P450C17A調節失常 PCOS主要缺陷是下丘腦-垂體接受異常的反饋信號。這可能與卵巢和腎上腺本身的自分泌、旁分泌調節機制障礙有關。PCOS患者常伴17-羥孕酮(17-OHP)升高,這是由於卵泡膜細胞內或腎上腺網狀帶內P450C17A的調節機制失常所致。P450C17A具有17-羥化酶和17,20-鏈裂酶的雙重活性,在△4將孕酮轉換為17-OHP和雄烯二酮,在△5將孕烯醇酮衍變為17-羥孕烯醇酮和DHEA。
17-羥孕酮既是腎上腺合成皮質醇的重要前體物質.也是卵巢合成性激素特別是雄激素的重要前體。若給予PCOS患者GnRH-A或HCG(特別在用地塞米松抑制後),17-羥孕酮、雄烯二酮明顯升高;而ACTH興奮試驗又能促使腎上腺的DHEA與17-OHP同時增多,提示卵巢和腎上腺網狀帶的P450C17A活性增高。因此,P450C17A活性調節異常是腎上腺和卵巢雄激素過量分泌的重要原因。但為什麼會出現類固酮合成的調節異常尚不清楚。胰島素/IGFs系統可刺激卵巢和腎上腺P450C17A mRNA表達及其活性。此外,CYP11A的側鏈裂解酶基因編碼區與產生過多雄激素有關。
5.胰島素抵抗與高胰島素血症 PCOS患者不論有無肥胖,多有不同程度的胰島素抵抗與高胰島素血症。近期發現大約有半數PCOS患者的發病與胰島素受體絲氨酸磷酸化缺陷有關。因而認為胰島素在其發病中佔有重要地位。胰島素與IGF-1通過IGF-1受體作用於卵泡膜細胞,促使雄烯二酮和睾酮合成。近年的研究發現,垂體鄰近部位有胰島素受體,或者同時存在的高IGF-1血症可促進LH刺激的卵泡膜細胞增生,導致雄激素過多和卵泡過早閉鎖(圖2)。Hasegawa用胰島素增敏劑Troglitazone治療PCOS,可使胰島素水平降低,LH和雄激素水平相應降低也支持這一觀點。胰島素升高對調節SHBG的代謝有重要作用,可使肝臟SHBG生成減少,游離睾酮升高。此外,胰島素受體絲氨酸磷酸化可抑制胰島素受體活性,促進P450C17A的17,20-鏈裂酶活性。近年對位於染色體11pl5.5的胰島素基因的5'-端可變數串聯重複順序(VNTR)的研究發現,胰島素基因的VNTR是PCOS的一個主要易感位點(特別是排卵性PCOS)。說明胰島素VNTR多態性是PCOS的遺傳學因素。
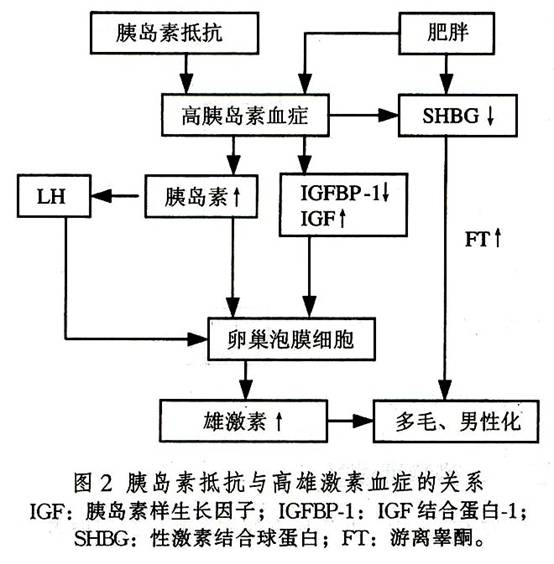
6.肥胖 PCOS伴肥胖者(BMI≥25)佔20%~60%。體脂分布不均勻。現知脂肪組織是類固醇激素的重要代謝場所,脂肪組織中的芳香化酶將外周雄激素轉換為E1和E2。研究證實,雄烯二酮轉換為E1的量與脂肪組織總量相關,高雄激素血症時SHBG下降,游離E2增加。雌激素使脂肪細胞生長、增殖。不同的內分泌環境能造成不同的肥胖體態,雄激素升高表現為上身肥胖(即男性型肥胖),而雌激素增多者為下身肥胖(即女性型肥胖)。體重增加常伴血胰島素升高和SHBG及IGFBP下降,從而使游離性激素和IGF-1增多。這類患者常伴有糖耐量異常或2型糖尿病。
近來,Rouru等提出肥胖-瘦素-NPY軸可能是部分PCOS患者下丘腦-垂體-LH過度分泌的病因,即肥胖婦女的瘦素分泌增多,後者抑制下丘腦NPYmRNA表達和NPY的分泌,解除NPY對LH的抑制,促使LH大量釋放。
7.高泌乳素血症 高泌乳素血症與PCOS的關係尚待進一步研究。PCOS高泌乳素血症的發生率為10%~15%,但確診為PCOS者的PRL都輕度或中度升高,更高水平的PRL多與垂體PRL瘤有關。引起高PRL的機制尚不清楚。可能是:①PRL升高與血雌酮增多有關。②下丘腦多巴胺相對不足,用多巴胺激動劑(如溴隱亭)治療PCOS無排卵或多毛症可獲得成功。高PRL血症者卵巢對外源性促性腺激素無反應。
8.PCOS與卵巢自身免疫 研究發現,某些PCOS與卵巢自身免疫有關。PCOS患者卵泡中有淋巴細胞浸潤,並存在抗卵巢細胞抗體,但Rojansky等對31例PCOS患者的研究顯示,抗卵巢抗體與PCOS無相關。Luborsky等用酶免分析檢測24例PCOS的抗卵巢抗體,25%PCOS患者為陽性,絕經期婦女組與育齡婦女組的陽性率分別為22%和19%,3組陽性率無差異。因此,關於PCOS是否與卵巢自身免疫有關尚無一致結論。
卵巢病理:典型的PCOS患者有雙側卵巢對稱性增大,體積可達正常的2~4倍,表面皺褶消失,平滑,呈灰白色,富含血管,包膜肥厚,包膜下有多量大小不等的卵泡,最大直徑可達1.5cm,囊壁薄,囊泡周圍的卵泡膜細胞增生伴黃素化,包膜增厚則是長期不排卵的結果,包膜厚度與血LH水平及男性化程度呈正相關。
21-羥化酶缺陷症的診斷
1.月經異常 月經稀少、閉經,少數可表現為功能性子宮出血。多發生在青春期,為初潮後不規則月經的繼續,有時伴痛經。
2.多毛 較常見,發生率可達69%。由於雄激素升高,可見上唇、下頜、胸、背、小腹正中部、大腿上部兩側及肛周的毳毛增粗、增多,但多毛的程度與雄激素水平不成比例(受體數、雌激素、SHBG及毛囊對雄激素的敏感性等多種因素影響)。同時可伴痤瘡、面部皮脂分泌過多、聲音低粗、陰蒂肥大、出現喉結等男性化徵象。
3.不孕 由於長期不排卵,患者多合併不孕症,有時可有偶發性排卵或流產,發生率可達74%。
4.肥胖 體重超過20%以上,體重指數≥25者佔30%~60%。肥胖多集中於上身,腰/臀比例>0.85。多自青春期開始,隨年齡增長而逐漸加重。
5.卵巢增大 少數病人可通過一般婦科檢查觸及增大、質地堅韌的卵巢,大多需輔助檢查確定。
6.雌激素作用 所有病人都表現為雌激素作用良好。檢查時,可見宮頸黏液量多。持續、大量雌激素作用可出現內膜增生過快,非典型性增生,甚至癌變。
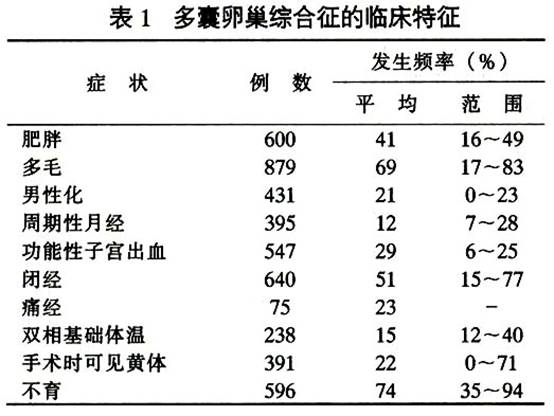
多囊卵巢症候群的臨床特徵見表1。
1.臨床診斷 初潮後多年月經仍不規則、月經稀少和(或)閉經,同時伴肥胖與多毛、婚後不孕等,應疑診PCOS。典型病例具有上述各種症状及體征,即月經失調、多毛、痤瘡、肥胖、不孕等。非典型病例可表現為:①單純性閉經不伴有肥胖、多毛及卵巢腫大,排除其他各種疾病,而孕酮試驗陽性者,仍應考慮為PCOS。②排卵型功能失調性出血。③月經異常合併多毛。④月經異常伴男性化症状,無明顯肥胖。⑤功能失調性子宮出血伴不育。
對於不典型病例需詳細詢問有關病史,如起病年齡、生長發育情況,起病經過,用藥史,家族史,個人生活習慣,既往有無全身性疾病。結合輔助檢查,排除其他疾病,並經B超等檢查明確診斷。
2.診斷標準 由於本病的異質性,診斷標準尚未統一,多數學者根據青春期發病、月經和排卵異常、多毛、血LH和(或)LH/FSH比值升高,結合一種雄激素水平過高,超聲檢查有多囊卵巢徵象,排除其他類似疾病後,可確定本症的診斷。
日本婦產科學會生殖內分泌委員會於1993年提出PCOS診斷標準如下:
(1)臨床症状:①月經異常(閉經、月經稀發、無排卵月經等);②男性化(多毛、粉刺、聲音低調、陰蒂肥大);③肥胖;④不孕。
(2)內分泌檢查所見:①LH高值、FSH正常值;②注射GnRH後LH分泌增多,FSH分泌正常;③雌酮/雌二醇比值升高;④血中睾酮或雄烯二酮升高。
(3)卵巢所見:①B超見多個卵泡囊性變;②雙合診及B超見卵巢腫大;③腹腔鏡見卵巢內膜肥厚及表面隆起;④鏡下見卵泡膜細胞層肥厚增殖和間質增生。
以上的(1)、(2)、(3)項是必有的項目,3項均具備時可診斷為PCOS,其他項目做為參考,若所有必備和參考項目均具備,則為典型PCOS病例。
此外,亦有人提出的診斷標準如下:①臨床症状:包括:A.閉經(60天以上);B.功能性子宮出血或持續無排卵(3個月以上);C.不孕;D.男性化體征;E.肥胖。②治療性診斷:一度閉經,以氯米芬或加HCG療法,於月經周期第5天開始,氯米芬50mg/d,連服5天,多可恢復排卵功能。無效時,可於停氯米芬後第2~4天加用HCH1000U,1次/d,共3天,治療3個療程以上仍未見排卵。③內分泌檢查:包括:A.血中LH較高(20~50mU/ml)及GnRH過度反應,血FSH在正常範圍或較低;B.血睾酮升高(60%以上);C.HMG(人絕經期促性腺激素)225U/d,用3天後,於用藥的第6天尿中的雌激素呈過度增高反應(150µg/24h以上);D.地塞米松4mg/d,口服,於第5天的尿中11-去氧-17-酮類固醇增高(600µg/24h以上)。④卵巢形態(包括內鏡所見):肉眼所見:A.無新鮮黃體形成;B.卵巢包膜增厚;C.卵巢增大;D.囊狀腫大的卵泡並列於包膜下。組織所見:卵泡膜細胞及間質細胞黃素化。
21-羥化酶缺陷症的鑒別診斷
細胞色素C氧化酶缺乏症:是范科尼症候群的一種,范科尼(Fanconi)症候群是一種遺傳性或獲得性疾病。常與胱氨酸病相伴發,其特徵是近端腎小管功能異常,引起葡萄糖尿,磷酸鹽尿,胺基酸尿及碳酸氫鹽尿。本病較罕見,多於成年出現症状,有腎性糖尿、多種胺基酸尿、高鈣尿症、腎丟失鈉、低磷血症、近端腎小管性酸中毒、低尿酸血症、腎小管性蛋白尿,低鉀血症(肌無力、軟癱、周期性癱瘓等),低鈣血症(手足搐搦症)等。
海藻糖酶缺乏:屬於二糖酶缺乏症臨床分類之一。本病又稱雙糖不耐受症,系指各種先天性或後天性疾病,使小腸黏膜刷狀緣雙糖酶缺乏,使雙糖的消化、吸收發生障礙,進食含有雙糖的食物時發生的一系列症状和體征。
溶酶體酶缺陷:溶酶體內的酶都是水解酶,而且一般最適pH為5,所以都是酸性水解酶。溶酶體內的酶如果釋放會把整個細胞消化掉。一般不釋放到內環境,主要進行細胞內消化。先天性溶酶體病是由於染色體上某些基因發生突變,而先天缺乏某種溶酶體酶而導致的一類代謝性遺傳病。患者因酶缺失或酶結構缺陷,致使細胞中相應的底物無法降解而貯存,堆積在次級溶酶體中,造成細胞代謝障礙,故又稱溶酶體貯積病。粘多糖貯積病是一組由於溶酶體酶缺陷造成的酸性粘多糖分子(氨基葡聚糖)不能降解,導致組織中大量粘多糖沉積和尿中粘多糖排泄增加而發生的疾病。
1.月經異常 月經稀少、閉經,少數可表現為功能性子宮出血。多發生在青春期,為初潮後不規則月經的繼續,有時伴痛經。
2.多毛 較常見,發生率可達69%。由於雄激素升高,可見上唇、下頜、胸、背、小腹正中部、大腿上部兩側及肛周的毳毛增粗、增多,但多毛的程度與雄激素水平不成比例(受體數、雌激素、SHBG及毛囊對雄激素的敏感性等多種因素影響)。同時可伴痤瘡、面部皮脂分泌過多、聲音低粗、陰蒂肥大、出現喉結等男性化徵象。
3.不孕 由於長期不排卵,患者多合併不孕症,有時可有偶發性排卵或流產,發生率可達74%。
4.肥胖 體重超過20%以上,體重指數≥25者佔30%~60%。肥胖多集中於上身,腰/臀比例>0.85。多自青春期開始,隨年齡增長而逐漸加重。
5.卵巢增大 少數病人可通過一般婦科檢查觸及增大、質地堅韌的卵巢,大多需輔助檢查確定。
6.雌激素作用 所有病人都表現為雌激素作用良好。檢查時,可見宮頸黏液量多。持續、大量雌激素作用可出現內膜增生過快,非典型性增生,甚至癌變。
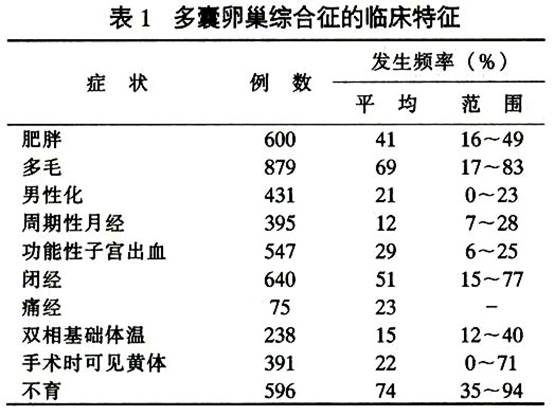
多囊卵巢症候群的臨床特徵見表1。
1.臨床診斷 初潮後多年月經仍不規則、月經稀少和(或)閉經,同時伴肥胖與多毛、婚後不孕等,應疑診PCOS。典型病例具有上述各種症状及體征,即月經失調、多毛、痤瘡、肥胖、不孕等。非典型病例可表現為:①單純性閉經不伴有肥胖、多毛及卵巢腫大,排除其他各種疾病,而孕酮試驗陽性者,仍應考慮為PCOS。②排卵型功能失調性出血。③月經異常合併多毛。④月經異常伴男性化症状,無明顯肥胖。⑤功能失調性子宮出血伴不育。
對於不典型病例需詳細詢問有關病史,如起病年齡、生長發育情況,起病經過,用藥史,家族史,個人生活習慣,既往有無全身性疾病。結合輔助檢查,排除其他疾病,並經B超等檢查明確診斷。
2.診斷標準 由於本病的異質性,診斷標準尚未統一,多數學者根據青春期發病、月經和排卵異常、多毛、血LH和(或)LH/FSH比值升高,結合一種雄激素水平過高,超聲檢查有多囊卵巢徵象,排除其他類似疾病後,可確定本症的診斷。
日本婦產科學會生殖內分泌委員會於1993年提出PCOS診斷標準如下:
(1)臨床症状:①月經異常(閉經、月經稀發、無排卵月經等);②男性化(多毛、粉刺、聲音低調、陰蒂肥大);③肥胖;④不孕。
(2)內分泌檢查所見:①LH高值、FSH正常值;②注射GnRH後LH分泌增多,FSH分泌正常;③雌酮/雌二醇比值升高;④血中睾酮或雄烯二酮升高。
(3)卵巢所見:①B超見多個卵泡囊性變;②雙合診及B超見卵巢腫大;③腹腔鏡見卵巢內膜肥厚及表面隆起;④鏡下見卵泡膜細胞層肥厚增殖和間質增生。
以上的(1)、(2)、(3)項是必有的項目,3項均具備時可診斷為PCOS,其他項目做為參考,若所有必備和參考項目均具備,則為典型PCOS病例。
此外,亦有人提出的診斷標準如下:①臨床症状:包括:A.閉經(60天以上);B.功能性子宮出血或持續無排卵(3個月以上);C.不孕;D.男性化體征;E.肥胖。②治療性診斷:一度閉經,以氯米芬或加HCG療法,於月經周期第5天開始,氯米芬50mg/d,連服5天,多可恢復排卵功能。無效時,可於停氯米芬後第2~4天加用HCH1000U,1次/d,共3天,治療3個療程以上仍未見排卵。③內分泌檢查:包括:A.血中LH較高(20~50mU/ml)及GnRH過度反應,血FSH在正常範圍或較低;B.血睾酮升高(60%以上);C.HMG(人絕經期促性腺激素)225U/d,用3天後,於用藥的第6天尿中的雌激素呈過度增高反應(150µg/24h以上);D.地塞米松4mg/d,口服,於第5天的尿中11-去氧-17-酮類固醇增高(600µg/24h以上)。④卵巢形態(包括內鏡所見):肉眼所見:A.無新鮮黃體形成;B.卵巢包膜增厚;C.卵巢增大;D.囊狀腫大的卵泡並列於包膜下。組織所見:卵泡膜細胞及間質細胞黃素化。
21-羥化酶缺陷症的治療和預防方法
早期診斷、早期治療、注意隨訪觀察、積極防治並發的腫瘤及心血管疾病。 近年來,對PCOS的治療觀念已不僅僅限於促排卵和妊娠。PCOS與糖尿病、高血壓、心血管疾病、子宮內膜癌等之間的肯定關係,使保健問題進入了這類研究其重要性日益突出。使用胰島素增敏劑,如美迪康和曲格列酮,不僅可改善機體胰島素抵抗,而且可明顯改善排卵和受孕,而其蘊涵的真實意義可能還遠不至於此。因為增進機體組織細胞的敏感性和穩定性,比單純的促排卵重要的多。
參看
| 關於「21-羥化酶缺陷症」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |