核與化學損傷/全身中毒性毒劑
| 醫學電子書 >> 《核武器與化學武器損傷》 >> 全身中毒性毒劑 |
| 核武器與化學武器損傷 |
|
|
全身中毒性毒劑(systemic agents)主要包括氫氰酸(hydrogen cyanide,HCN)和氯化氰(cyanogen chloride,CICN)。化合物分子中含CN-,故屬氰類毒劑(cyanide agents)。施放後呈蒸氣態,經呼吸道吸入,作用於細胞呼吸鏈末端細胞色素氧化酶,使細胞能量代謝受阻,供能失調,迅速導致機體功能障礙,是一類速殺性毒劑。
氫氰酸及其鹽類,平時廣泛用於化纖,電鍍,合成橡膠,有機玻璃、製藥、肥料、冶金、滅鼠及殺蟲等。在生產和使用時違反操作規程或不注意安全防護,常有中毒發生。自然界以苦扁桃仁甙(Amygdalin)形式存在於苦杏仁,櫻桃、李、杏以及木薯塊和根等。食後在體內酶催化作用下分解,放出氫氰酸。如100g苦杏仁分解釋放氫氰酸100~250mg。氫氰酸致死劑量為60mg,故口服十幾顆苦杏仁即可引起兒童中毒。
1916年7月1日,法軍在Somme河戰役中,首先對德軍使用了氫氰酸,但因炮彈爆炸引起燃燒、蒸氣比重較空氣輕、揮發度大,有效戰鬥濃度維持時間短等原因,未能造成人員傷亡。目前,由於彈藥和施放技術的改進,在短時間內可造成2~3mg/L的染毒濃度,在此濃度下,暴露15~30秒,中毒人員可迅速死亡。
全身中毒性劑施放時呈蒸氣態,有效濃度維持時間短,已居次要地位。但作為化學戰劑,氫氰酸具有較強隱蔽的性和速殺作用、易透過防毒面具、平時作為化工原料有大量生產和貯存、來源豐富、戰時可直接轉化為化學戰劑,外軍仍較重視。
一、主要理化性質
(一)主要物理性質(表14-1)
表14-1 氫氰酸和氯化氰的主要物理性質
|
|
|
|
|
|
|
|
|
mg/L) |
|
||
|
|
|
|
|
||||||||
| 氫氰酸 |
27.02 |
無色液體 |
苦杏仁味 |
-14.0 |
26.0 |
0.69 |
0.94 |
81.7 |
904.1 |
任意混溶 |
能溶 |
| 氯化氰 |
61.48 |
無色液體 |
胡椒味刺激 |
-7.0 |
13.0 |
1.18(0℃) |
2.1 |
133.6 |
3362 |
易溶 |
易溶 |
(二)主要化學性質
1.聚合作用:純氫氰酸性穩定,在有少許水或鹼,特別有氨存在時易聚合,形成無毒的三聚體和四聚體,並釋放大量熱能和氣體,致使貯存容器或彈藥爆炸。為了確保貯存和運輸安全,將氯化氰和氫氰酸混合,即在氫氰酸中加入8%~15%氯化氰或在氯化氰中加入5%~10%氫氰酸,可防止聚合反應。
2.水解反應:常溫下,氫氰酸在水中緩慢水解,生成甲酸及其它產物,最後溶液變黑,有時可極出棕色沉澱。
加熱可加速氫氰酸水解並使之揮發,故在煮沸消毒時,應注意安全防護。
氯化氰常溫下水解慢,加熱時反應加快,生成氰酸和氯化氫,最後生成二氧化碳和氯化銨。
CLCN+H2O—→HOCN+HCL—→CO2+NH4CL
(氰酸)
3.與鹼反應:氯化氰與強鹼作用生成無毒的氯化物和氰酸鹽。
CLCN+2NaOH—→NaOCN+NaCL+H2O
(氰酸鈉)
與氨作用生成氰化銨和氯化銨。
CLCN+2NH3—→NH4CN+NH4CL
(氰化銨)
所以,可用鹼性溶液或氨水消除氯化氰。
4.氧化反應:與氧化劑反應生成無毒產物。燃燒時,生成二氧化碳和水:
4HCN+5O2—→4CO2+2H2O+2N2
所以,氫氰酸爆炸時引起燃燒,使毒劑大量損失。如在TNT炸藥中按重量1∶1加入消焰劑氯化鉀,可防止燃燒。
5.與硫反應:氫氰酸與供硫化合物硫代硫酸鈉(Na2S2O3)在硫氰酸生成酶催化下,生成毒性低的硫氰酸鹽。
HCN+S—→HSCN
6.與醛、酮反應:氯氰酸與醛、酮化合物發生加成反應,生成無毒的腈醇化合物,故葡萄糖、α-酮戊二酸等有一
定的抗毒作用。
二、毒性
氫氰酸和氯化氰戰鬥狀態為蒸氣態,吸入毒性見表14-2。
表14-2 氫氰酸和氯化氰吸入毒性
| 暴露時間(min) | LC50(mg/m3) | LC90(mg/m3) | ||
| HCN | CLCN | HCN | CLCN | |
| 0.25 |
2400~2700 |
3000~3500 |
||
| 0.5 |
1000~1500 |
4000~5000 |
2000~2500 |
7000~8000 |
| 1 |
700 |
1700~1900 |
1500 |
2100~2500 |
| 5 |
200~300 |
400~500 |
440 |
|
| 15 |
150~200 |
300 |
300 |
370 |
氯化氰對眼和呼吸道有強烈刺激,濃度1.00mg/m3時,有刺激感;2.5mg/m3時,暴露數分鐘即大量流淚。其毒性約為氫氰酸的4/5,光氣的1/2,沙林的1/36。
氫氰酸的毒性作用與濃度關係甚為密切,其LCt值隨濃度降低、暴露時間延長而增大,或隨濃度增高、暴露時間縮短而減少。
液體氫氰酸經口中毒的半數致死劑量為0.9mg/kg,氰化鈉和氰化鉀經口中毒的致死劑量分別為100mg和144mg。
氫氰酸液滴落入眼內,除有局部刺激作用外,吸收後可危及生命,其半數致死劑量為1~2mg/kg。
液態氫氰酸經皮膚吸收的半數致死劑量約為100mg/kg。野戰情況下氫氰酸蒸氣通過皮膚吸收中毒的可能性極小,高溫和出汗能促進皮膚對氫氰酸蒸氣的吸收。
三、體內代謝
氫氰酸在水溶液中的離解常數很小(K=7.2×10-10,25℃),有利於透過細胞膜,故易通過肺泡壁、腸粘膜、眼睛和傷口吸收,大劑量也可通過皮膚吸收。
氫氰酸及其鹽類在體內的分布因中毒途徑而異。除直接接觸的組織氰含量較高外,CN-易與紅細胞結合,故血液氰含量最高,依次為腦和心臟,其它組織則較少。人、狗吸入氫氰酸,死後各組織氰含量肺最高,依次是血、腦、心和腎、肝、肌肉和胃壁較少。狗KCN胃腸道中毒,CN-含量以胃腸道最高,血液、肺、肝、腦、腎、心、肌肉等依次遞減。
氫氰酸進入體內後,通過多種代謝途徑失去毒性,其中絕大部分(80%以上)在硫氰酸生成酶(rhodanese)的催化下與體內供硫化合物(胱氨酸、半胱氨酸和β-巰基丙酮酸)作用形成硫氰酸鹽(thiocyanate)從腎臟排出。硫氰酸生成酶主要分布在細胞線粒內,酶活性以肝、腎最高,腦次之,肺、脾、肌肉和血液甚微。此解毒作因體內供硫物不足而受到限制。此外,體內的硫氰酸氧化酶卻促使硫氰酸鹽釋放出CN-,致使血液和組織中常有微量CN-存在。
剩餘氫氰酸可呈原形由呼吸道和分泌腺排出,經氰酸鹽變成CO2或參與單碳代謝。此外,HCN還可與B12(hydroxocobalamin羥鈷胺素)結合形成維生素B12(cyanocobalamin氰鈷胺)、與葡萄糖結合形成無毒的腈醇化合物。
CN-在體內代謝、排泄途徑,概括如下圖:
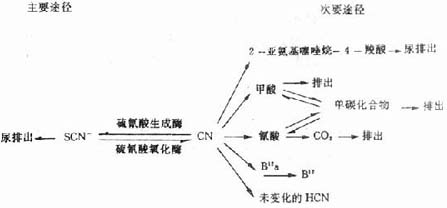
圖14-1 氰化物體內代謝途徑
|
||||||||||||||
| 關於「核與化學損傷/全身中毒性毒劑」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |