核與化學損傷/神經性毒劑的中毒機理
| 醫學電子書 >> 《核武器與化學武器損傷》 >> 神經性毒劑 >> 神經性毒劑的中毒機理 |
| 核武器與化學武器損傷 |
|
|
|
神經性毒劑對機體的作用主要有三個面:一是選擇性抑制膽鹼酯酶活性,使乙醯膽鹼(Ach)在體內蓄積,引起膽鹼能神經系統功能紊亂;二是毒劑作用於膽鹼能受體;三是毒劑對非膽鹼能神經系統的作用。
一、對膽鹼酯酶的抑制作用
膽鹼酯酶根據其水解基質的專一性和速度不同分真性膽鹼酯酶和假性膽鹼酯酶,前者又稱乙醯膽鹼酯酶(AchE),後者包括丁醯膽鹼酯酶(BuchE)和丙醯膽鹼酯酶(PrchE)。
真性膽鹼酯酶與膽鹼能神經的生理功能極為密切。它主要存在於神經細胞、神經肌肉接頭、紅細胞及電魚的電器官等部位。其生理功能是,當神經衝動到達膽鹼能神經末梢時,突觸小泡內的Ach外排至突觸間隙,作用於突觸後膜的膽鹼能受體,引起下一級神經元或效應器的激發。在正常生理條件下,Ach完成傳遞衝動作用後,隨即被突觸後膜上的AchE在數毫秒內水解,生成乙酸和膽鹼。此一水解過程分兩步進行:即與Ach形成乙醯酶,然後乙醯酶脫乙醯基,酶恢復原有活性。
乙醯膽鹼酯酶的活性狀態是維持神經系統正常功能的重要條件,當AchE活性受到抑制時,就會導致一系列的神經功能紊亂。
(一)神經性毒劑對AchE的抑制機理
神經性毒劑特別是V類毒劑,對AchE的抑制作用與酶催化水解Ach的過程非常相似,神經性毒劑分子中含有親電子的正磷原子(Pδ+),它與Ach分子中的正碳原子(Cδ+)同樣具有親電子性質。但神經性毒劑的親電子能力此Ach強,這是因為毒劑分子中,P=O和P-F鍵上的O、F原子相對電負性比P原子大得多(相對電負性P=2.1,O=3.5,F=4.0,C&S=2.5)。因此,相對電負性大的O、F原子吸收電子成為負極,使P成為低電子密度的正極,即P原子帶有較多的正電荷和更強的親電子能力。所以神經性毒劑對AchE有更大的親和力和抑制力。
神經性毒劑抑制AchE的過程如圖12-2所示,G類毒劑的離開基團是短鏈的酸性基團F或-CN,無膽鹼類似結構。因此,G類毒劑與AchE的結合不涉及負性部位。由毒劑分子中親電子的正磷原子與被活化的絲氨酸羥基氧原子以共價鍵相結合,同時酯解部位的酸基提供一個質子(H+)給離開基團-F或-CN,並使之脫落,從而形成穩定的膦醯酶(phosphorylated enzyme),此一過程稱酶的膦醯化(phosphorylation),見圖12-2A。
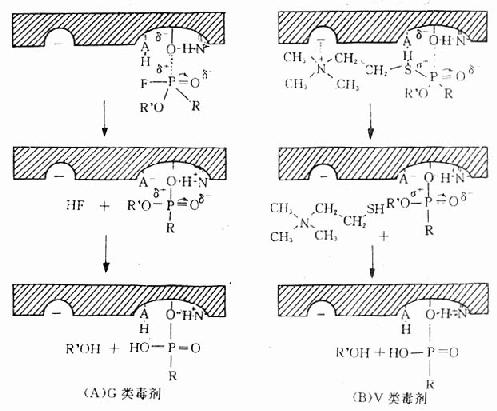
圖12-2 神經性毒劑與AchE作用示意圖
V類毒劑抑制AchE的過程與酶對Ach的作用非常相似。V類毒劑的離開的基團近似於Ach中的膽鹼部分,依靠疏水性吸附和(或)靜電引力與負性部位結合,毒劑的磷醯基與酯解部位結合,在羧基和鹼基協同作用下,P-S鍵斷裂,Pδ+與絲氨酸Oδ+形成共價鍵,產生穩定的膦醯酶(圖12-2B)。
G類和V類神經毒與AchE結合形成的膦醯酶非常穩定,一般無自發水解作用。故稱此類毒劑為不可逆性膽鹼酯酶抑制劑。
另一類藥物,如氨基甲酸酯類化合物的新斯的明、吡啶斯的明、毒扁豆鹼等為可逆性膽鹼酯酶抑制劑,分子結構中均含一氨基甲醯基和一季銨氮(毒扁豆鹼為叔胺)。與酶作用時,首先氨基甲酸酯中的季銨氮陽離子頭定位於酶的負性部位,氨基甲醯基則與酯解部位中的絲氨酸羥基氧結合,酯鍵斷裂後形成氨基甲醯酶(carbamylated enzyme)。此一過程稱酶的氨基甲醯化(carbamylation)。酶氨基甲醯化後即阻止乙醯化酶的形成,因此它也能使AchE失去水解Ach的能力,從而呈現一定的毒性作用。不過氨基甲醯酶可以自發水解,脫去氨基甲醯基後,酶即自行恢復。因此,當體內一部分AchE氨基甲醯化後,酶即被「保護」起來,從而避免神經性毒劑對它的攻擊。這就是氨基甲酸酯類藥物用著酶保護劑的基本原理。
綜上所述,膦醯酶、氨基甲醯酶和乙醯酶三種醯化酶自動恢復酶活性的速度完全不同。膦醯酶是醯化酶中自動恢復活性最慢的一種,氨基甲醯酶次之,乙醯酶最快。這三種醯化酶自發半活性恢復期(t1/2)分別為:數小時至數天;數分鐘;數毫秒。
由此可見,神經性毒劑嚴重中毒時,依靠酶活性的自動恢復很難解救嚴重中毒的病人。
(二)膦醯酶的轉歸
神經性毒劑與AchE形成的膦醯酶並非是完全不可逆的,也不是反應的終止。隨著時間和條件的改變,膦醯酶可以繼續發生質和量的變化。這些變化有:酶活性的自動恢復;酶老化和在重活化的劑的作用下發生重活化(圖12-3)。
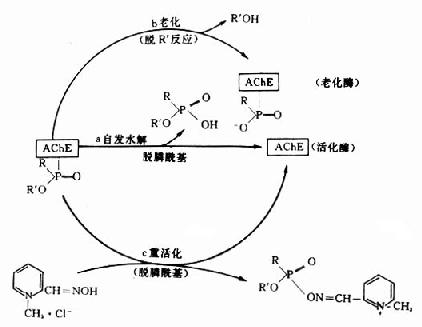
圖12-3 膦醯酶的轉歸
1.自動恢復酶活性:酶活性的自動恢復是由弱親核試劑水分子的陰離子OH-與膦醯酶中膦醯基的Pδ+發生親核反應,使酶與膦醯基間的共價鍵斷裂,從而使膦醯基從酶分子上水解下來(圖12-3a)。根據毒劑結構不同,各種神經性毒劑與酶形成的膦醯酶,其自動恢復速率有很大差別。有的恢復較快(如VX),有的恢復較慢(如GB),有的幾乎不能恢復(如GD)。
2.膦醯酶老化:膦醯酶經一定時間後,烷氧基上的烷基(R')發生脫落,即脫落烷基反應(deakylation)。脫落R'後的膦醯酶就失去了重活化的能力。中毒酶從能被重活化的狀態轉變為不能被重活化的狀態,這一過程叫酶「老化」(aging)。老化的實質是中毒酶負性部位帶質子的酸(H+)和膦醯氧形成氨鍵,促使烷氧鍵(R'-O)斷裂,於是烷基(R')脫落(圖12-3b)。
不同中毒酶的老化速度取決於毒劑的種類。梭曼中毒酶老化速度最快,而且幾乎無自動恢復現象;VX中毒酶不僅自動恢復快,老化也很慢(表12-4),這主要與毒劑的烷氧基結構有關(烷氧基的α及β碳原子無取代基,不易老化,如VX中毒酶;被甲基取代後則易老化,如沙林中毒酶;甲基數愈多,老化愈快,如梭曼中毒酶)。
表12-4 神經性毒劑中毒酶的自動恢復和老化速度*
|
毒劑種類 |
24h自動恢復(%) |
半老化期(h) |
|
VX |
~70 |
60 |
|
塔崩 |
- |
31 |
|
沙林 |
4 |
12 |
|
梭曼 |
0 |
<0.04 |
*酶原:人紅細胞,25℃,pH7.1~7.3
老化酶一經形成,非但不能自行水解,自動恢復酶活性,而且也失去酶重活化劑對其重活化的作用。老化酶不能重活化,原因之一是烷基(R')脫落後,老化酶的P原子正電性降低,與帶負電的肟基(=NO-)親和力也隨之降低;此外,老化酶帶負電的羥基氧(![]() )與帶負電的肟基具有相互排斥作用,進一步影響肟基與P原子的結合。
)與帶負電的肟基具有相互排斥作用,進一步影響肟基與P原子的結合。
梭曼的烷氧基較大,能遮蓋酶的負性部位,造成空間障礙。在使用酶重活化劑時,碩大的烷氧基能阻礙重活化劑與酶的負性部位結合,這也是梭曼中毒酶難以重活化和重活化劑對梭曼中毒療效較差的原因之一。
3.膦醯酶重活化:應用重活化的劑使膦醯基從酶的結合部脫落下來,恢復酶活性已得到實際應用。目前常用的重活化劑多為肟類化合物(oximes),如氯磷定、雙復磷、甲磺磷定、雙磷定等。其分子結構中均含有肟基和季銨氮,它們能大大加速脫膦醯基反應的速度,加速酶的活性恢復(圖12-3c、圖12-4)。反應原理是:
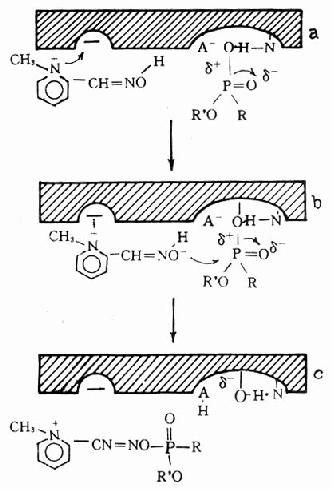
圖12-4 氯磷定對中毒酶重活化示意圖
(1)首先,肟類藥物(如氯磷定)分子中季銨氮借靜電引力結合在酶的負性部位,從而使整個分子固定在最有利於向Pδ+原子攻擊的位置圖(12-4a)。
(3)負性肟基(=NO-)對中毒酶的Pδ+原子進行親核性攻擊,形成膦醯肟並離開酶的活性表面,於是酶恢復為原來狀態。(圖12-4c)。
應當知道,同一種重活化劑對不同中毒酶的重活化作用強度不同的,不同的重活化劑對同一中毒酶重活化作用的相對強度也不一樣。例如氯磷定對沙林中毒酶的重活化率高於對塔崩中毒酶的重活化率;雙復磷對塔崩中毒酶的重活化效果優於氯磷定。
綜上所述,神經性毒劑能使AchE失去水解Ach的能力。在突觸部位,AchE的抑制,引起突觸後Ach的蓄積和對受體的持續作用是導致膽鹼能神經系統功能紊亂的重要原因。動物實驗和臨床中毒病人中均已證明有機磷毒劑中毒時,血液和腦組織中Ach含量均有升高,而且AchE抑製程度、Ach含量增加與中毒劑量有著平行關係。重活化劑可使酶的活性重新恢復,但在實際應用時要注意不同中毒酶的老化速度和對不同毒劑中毒採用不同的重活化劑,參見表12-5。
表12-5 幾種肟類重活化劑的抗毒效果比效
|
重活化劑 |
塔崩 |
梭曼 |
沙林 |
VX |
|
2-PAM-CL |
0 |
0 |
+ |
+ |
|
TMB-4 |
++ |
- |
++ |
++ |
|
LüH-6 |
+ |
- |
++ |
++ |
|
HI-6 |
0 |
+ |
++ |
+++ |
註:- 相反作用;0 無效;+ 效果好;++ 效果很好;+++ 效果極好
塔崩是目前唯一確證在戰爭中大規模使用的神經性毒劑,其抑制酶的能力弱於沙林、梭曼和VX。塔崩中毒酶無自動重活化作用,老化速度比沙林、梭曼等中毒酶慢得多,故老化在塔崩中毒救治過程中不佔重要地位。雙吡啶肟類藥物中僅4位肟基的化合物對其抑制的酶有一定的重活化作用,其中以TMB-4重活化作用最強,LüH-6次,研製的三種4位肟基的H系藥物均較弱;單吡啶肟類中,僅2位肟基的芐基單吡啶醛肟對塔崩中毒酶有較強的重活化作用,PAM類的重活化作用均較弱(羅春元博士論文,1993)。
二、對膽鹼能受體的作用
(一)通過Ach對受體的間接作用
1.膽鹼能受體:早先,蛙心灌注實驗證明Ach是一種神經介質,它在體內與受體結合產生作用。已有幾種方法可以分離這種受體,並證明它們是位於細胞膜上的蛋白質。經分離測得溶解狀態的膽鹼能受體蛋白質分子量為42000,它由數個亞單位構成,但對這些亞單位結構類型還有不同的看法,因此受體有不同的分子量。經推算,骨骼肌的單條纖維上平均有4.7×107個受體,每個運動終板上平均有3×106~3×107個受體。根據放射性箭毒結合受體的位點數目,推算受體的全部表面積還不到終板表面積的1%。當一個生理效應產生的時,僅是其中的一小部分受體發生興奮。實驗證明,阻斷50%的膽鹼能受體不會影響生理功能,阻斷70%時,功能才會受到明顯影響。
乙醯膽鹼受體分兩類,即毒蕈鹼樣乙醯膽鹼受體(M-AchR,簡稱M受體)和煙鹼樣乙醯膽鹼受體(N-AchR,簡稱N受體)。
(1)毒蕈鹼樣乙醯膽鹼受體:該受體能為Ach所興奮,也能為毒蕈鹼所激動。類似作用激動劑有毛果芸香鹼、檳榔鹼、氧化震顫素等。M受體主要分布在外周副交感節後纖維所支配的平滑肌和腺體包括汗腺上;在中樞則主要分布於大腦皮層錐體細胞。其典型特點是可被阿托品及其同類化合物東莨菪鹼、樟柳鹼及二苯羥乙酸-3-喹嚀環酯所阻斷。
(2)煙鹼樣乙醯膽鹼受體:也能被Ach所興奮,同樣也可被低濃度煙鹼所激動(高濃度被阻斷)。N受體主要分布在骨骼肌的神經肌肉接頭、植物神經節和腎上腺髓質等突觸後膜上。在中樞主要分布於脊髓閏紹氏細胞。據此可分為神經節型(N1-AchR)和神經肌肉接頭型(N2-AchR)兩種亞型。故其阻斷劑或拮抗劑分神經節和神經肌肉接頭兩類:前者有美加明、五烴季銨、六烴季銨;後者有十烴季銨、d-筒箭毒、a-銀環蛇毒、眼鏡蛇毒等。
在中樞神經系統,M和N兩種受體均存在,甚至同一細胞上有兩種受體,而以一種佔優勢。大腦皮層錐體細胞則以M受體為主,脊髓閏紹氏細胞則以N受體為主。丘腦的神經元則為混合型。
2.乙醯膽鹼與受體的結合方式:膽鹼能受體的分子構圖(topography)與AchE有相似之處,但又不完全相同。如M受體有兩個活性中心(負性部位、親酯部位)和疏水區。當Ach與受體接近時發生①Ach的季銨氮與受體分子的負性部位以靜電引力和范德華引力相互結合;②受體上帶部分正電荷(δ+)的基團以氫鍵方式與Ach的醚氧結合;③另一帶正電荷基團與Ach羰基氧相互作用;④親酯部位附近的疏水區與Ach的甲基以范德華引力相吸引(圖12-5)。
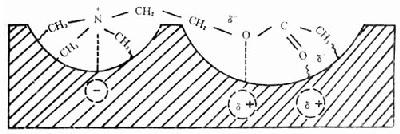
圖12-5 Ach通過靜電、偶極和疏水性相互作用與受體結合
除上述三個部位外,可能還有一個未定部位,它主要與M抗膽鹼藥物的羥基結合。還有人認為M受體的親酯部位有兩個帶電荷相反的基團,一是帶部分負電荷的基團,另一是帶部分正電荷的基團。
N受體的活性中心也由三個部位組成,第一是負性部位,這是最主要的,帶有完整的負電荷,它與煙鹼樣物質或Ach的陽離子頭結合;其次是帶部分負電荷的親酯部位,主要與Ach的酯基部位結合(靜電吸引),第三是輔助陰離子部位,此部位不與Ach發生作用,但能與雙季銨類化合物的第二個季銨陽離子頭以離子鍵方式結合。
Ach與受體結合後,引起受體分子立體構型改變,進而激起細胞內氧化磷酸化和細胞膜對Na+、K+電漿通透性改變,從而引起一系列生理效應。
(二)毒劑對受體的直接作用
神經性毒劑抑制酶活性,Ach在突觸處積聚並作用於膽鹼能受體,引起一系列神經功能紊亂,這是毒劑的間接作用,是導致中毒的主要原因。但也發現許多與此相矛盾的現象:如酶活性抑製程度與臨床表現並非完全一致;事先用酶抑制劑將某些離體器官的AchE活性完全抑制,然後再次或重複應用毒劑,仍能引起毒性效應。還有,中毒動物毒性症状消失與酶活性恢復不成平行關係等。這些事實說明,毒劑除對AchE有抑制作用外,可能對受體還有直接作用。如梭曼、VX、沙林、塔崩與大鼠心肌M2受體有很高的親和力,它們結合在M2受體Ach結合部位上能夠抑制[3H]CD(一種與M2受體有很高親和力的化合物)與M2受體的結合;二苯羥乙酸-3-喹嚀環酯(QNB)作為配體,能與M受體產生物異性結合,大鼠梭曼中毒後,皮層、海馬M受體與[3H]QNB結合數則明顯減少,從而表明梭曼也能與M受體直接結合。此外,VX與N受體的直接結合,國內也有報導。神經性毒劑對周圍神經節和神經肌肉接頭也有影響,而且也是通過對受體的直接作用產生的。可是神經性毒劑對受體的直接作用所需劑量比抑制酶活性的劑量要大得多。因此,它在毒理作用中的實際意義如何,尚難斷定。不過,受體在毒劑中毒發生和發展過程中在某些方面可能起重要作用。如毒劑引起的中樞神經性呼吸麻痹、血壓下降、心律失常等與毒劑直接作用於呼吸中樞和相關受體有一定關係。此外,受體對中毒後重要器官功能的自動恢復也起著重要作用,這是因為受體在中毒過程中產生了脫敏效應和受體數目減少有關。
三、對非膽鹼能系統的作用
在接近LD50劑量時,神經性毒劑能影響中樞非膽鹼能系統的活動。如神經性毒劑中毒引起的中樞性驚厥和小腦環-磷酯鳥苷(cGMP)濃度的迅速升高,阿托品對之無效,而安定則可使驚厥消失以及cGMP濃度下降。γ-氨基丁酸(GABA)是一種與驚厥發生有關的重要物質,對中樞神經元普遍的抑制效應。實驗表明梭曼引起的驚厥,原因是它能干擾GABA能受體對GABA的親和力和利用率,而安定等苯並二氮雜卓類化合物則能增強受體對GABA的親和力和利用率,故有抗驚作用。
此外,還觀察到塔崩、沙林和梭曼還作用於腺苷酸環化酶和磷酸二酯酶導致腦內環—磷酸腺苷(cAMP)和cGMP含量的改變。
|
||||||||||||||
| 關於「核與化學損傷/神經性毒劑的中毒機理」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |