營養學/癒合與營養
| 醫學電子書 >> 《臨床營養學》 >> 外科創傷與營養 >> 癒合與營養 |
| 臨床營養學 |
|
|
若術前營養狀況良好,術後進入至創傷反應第二階段時,儘管機體尚處於負氮平衡時期,傷口或切口若無感染,則可迅速開始癒合,表現傷口佔有「優惠地位」,以身體其他部位的組織和肌肉為營養素的提供者,用來合成膠原以使傷口癒合。在創傷後第三階段,若外源營養素供給充裕,則一方面傷口仍處於「優惠地位」,不斷攝取營養素;另一方面,身體其它組織和器官可減少消耗,並且也獲得營養補充,則能轉為正氮平衡,身體逐日康復。
若術前營養不良,術後又未注意營養支持,則即使傷口處於「優惠地位」,因缺少物質基礎也難以癒合。營養不良時,機體的免疫功能受損,易繼發感染。若感染未很好控制,營養又未很好補充,持續過久,則傷口癒合緩慢,甚至停頓。如臨床所見的延遲不愈的腸瘺,燒傷病人屢次植皮失敗以及骨折病人骨不連合等。
對於未感染的手術切口,術後7天左右,癒合的切口,其抗張強度已達到病人可從事一般的活動。污染的較大傷口,經清創暴露後,一般於傷後第5~15天為二期癒合*的良好時機,在Ⅲ°燒傷,傷後第12~21天為植皮良好時機,超過30天以上,則植皮的成活率受影響。若能得到及時的營養支持,則能改善其情況。
下面將討論傷口癒合與骨折癒合與營養的關係。
37.5.1 傷口癒合與營養
(1)傷口癒合的組織形態學變化
①炎症:組織損傷後,損傷處即出現炎症反應。毛細血管擴張、滲透性增加、淋巴管為纖維蛋白所阻塞、出現輕微紅腫的現象。對合傷面間隙中的血液、淋巴液及組織滲出液凝結成血塊,使兩側傷面粘合,並使傷面滲血停止。滲出的白細胞等將細胞破片和碎屑除去。清潔的切口,急性炎症一般在幾天內即消失。
②上皮形成:於傷後24h內,緊靠傷口邊緣的上皮開始增厚。邊緣的基底細胞失去對下面真皮的堅固附著,經迅速的有絲分裂,向下增殖,並跨過缺隙處。在48h內,整個傷口表面重新上皮化。
③細胞期:當炎症反應消退和上皮的表面增厚時,傷口深部出現成纖維細胞,從傷後第2天或第3天開始到第10天,即在細胞總數中佔優勢。成纖維細胞合成並分泌膠原分子。在電子顯微鏡下,成纖維細胞的外觀是典型的。除了彌散的高爾基體和粗大不規則嵴的粒線體之外,含有一個明顯發育和擴張的粗面內質網。長而互通的池,由彎曲的雙排多體畸形形成邊界,附著在漿膜上。
除成纖維細胞外,在縫合24h後,傷面組織內的毛細血管內皮細胞向凝塊內生長,形成新的毛細血管網,供應新生組織所需營養並排出代謝產物。
④纖維組織形成:到第4或第5周,成纖維細胞的絕對數量明顯減少,並且也不再具有活躍的內質網,而膠原纖維卻成了佔優勢的結構表現。最初的膠原纖維出現在第4~5天。傷口間隙很快充滿了小而雜亂定向的纖維束。纖維束逐漸增大,並形成大量緻密的膠原組織(瘢痕),將切斷的組織牢固地縛地一起。豐富的毛細血管網縮小為少數成形的毛細血管系統,貫穿瘢痕終生。
以上變化可簡括為:對合的切面首先出現炎症,間隙被滲出物所填充,繼之成纖維細胞增多,生成膠原纖維組成結締組織,將兩側連接起來,同時上皮覆蓋,完成癒合。
(2)傷口癒合的生化變化與營養的關係
①炎症:20世紀初期以來,一系列研究說明,由損傷部位的肥大細胞、顆粒細胞和血小板釋放的組織胺,能引起局部血管擴張和增加小血管通透性,是炎症反應的主要介質。近來,更認識到組織損傷時釋放出的激肽和前列腺素(主要是前列腺素E1和E2)在導致急性炎症中起決定性作用。
已知人和哺乳動物體內含有三種激肽,即緩激肽、胰激肽和蛋氨醯胰激肽。這三種激肽分子內部都含有緩激肽的9肽結構(H.精—脯—脯—甘—苯丙—絲—脯—苯丙—精.OH),因而有相類的作用,其中緩激肽的活性最強。當組織損傷時,由於血管內皮暴露出膠原或組織蛋白酶的釋放,可引起一系列的酶促反應,使血漿或組織中的激肽原(由肝臟以胺基酸及糖類為原料合成而來)轉變為緩激肽。
前列腺素最初在前列腺中發現,後來知道,幾乎身體內一切組織都可以不飽和脂肪酸為原料在激肽系統影響下轉變為前裂腺素。前列腺素E1及E2即分別由花生三烯酸及花生四烯酸轉變而來。
②結締組織:從組織學看,結締組織是由包埋於無定形而內含組織液的基質中的細胞和細胞外的纖維所組成。即結締組織主要由細胞、基質及纖維所組成。基質是無定形的膠狀物質,其化學成分主要是蛋白多糖(即粘蛋白)。纖維包括膠元纖維、網狀纖維及彈性纖維。在傷口癒合中以膠元纖維為主。現分別討論蛋白多糖及膠原纖維:A.蛋白多糖,其分子結構是一條肽鏈上聯結許多條氨基多糖鏈,象瓶刷的形狀。故分子中蛋白質比例小而多糖鏈的比例大。結締組織中常見的氨基多糖有以下數種(表37-2)。
從表中可見,除透明質酸不含硫酸外,其他皆含硫。已知氨基多糖是在成纖維細胞的粗面內質網,當新合成的多肽鏈在內質網移行時,各種單糖及其衍生物(N-乙醯氨基已糖及葡萄糖醛酸),受相應的糖基轉移酶的催化,按一定的順序連接到肽鏈的一定部位而合成氨基多糖。硫酸的摻入是在硫酸轉移酶的催化下,將活性硫酸(3′—硫酸腺苷—5′—磷酸硫酸)中的硫酸轉移到新合成的氨基多糖鏈上去。實驗證明維生素A缺乏時,硫酸轉移酶的活性下降,故缺乏維生素A時,氨基多糖合成受阻,這可能是維生素A缺乏時,傷口癒合遲緩,以及生長期的動物,組織生長及發育障礙的原因;B.膠原纖維,其化學成分是膠原蛋白,簡稱膠原,是由成纖維細胞合成。它是由許多原膠原分子整齊地定向排列,並通過共價鍵交聯所形成的穩定而不易溶解的膠原分子。它在電子顯微鏡下呈現原纖維的形態。原纖維平行聚集成束就是膠原纖維。每個原膠原分子都由三條α-肽鏈以三股螺旋狀結構所組成。
原膠原分子中的α-肽鏈,在組成和結構中有如下兩個特點:A.在胺基酸排列順序中,每隔兩個其他胺基酸(以x及y代表)即有一個甘氨酸,故肽鏈結構基本上可用(甘-x-y)n來表示。從這一公式中可看出甘氨酸在膠原分子中所佔的比重;B.組成的胺基酸中含有約11~12%的羥脯氨酸和羥賴氨酸,以及脯氨酸和羥脯氨酸合在一起約佔21~22%,甘氨酸、脯氨酸、羥脯氨酸三者總和約佔50~53%,這在其他蛋白質中是很少見的。這從表37-3中即可看出這兩個特點。
表37-2 結締組織中常見的氨基多糖
| 名稱 | 基本結構單位 |
| 透明質酸 | 葡萄糖醛酸,N-乙醯氨基葡萄糖 |
| 硫酸軟骨素A | 葡萄糖醛酸,4-硫酸-N-乙醯氨基半乳糖 |
| 硫酸軟骨素C | 葡萄糖醛酸,6-硫酸-N-乙醯氨基半乳糖 |
| 硫酸軟骨素B | 艾杜糖醛酸,4-硫酸-N-乙醯氨基半乳糖 |
| 硫酸角質素 | 半乳糖,6-硫酸-N-乙醯氨基葡萄糖 |
註:肝素也屬於氨基多糖,主要存在於肺、皮膚、肝、腸等肥大及啫鹼性白細胞內。
從表37-2可見,在胺基酸品種方面 除羥賴氨酸和羥脯氨酸外,膠原所含有的胺基酸,肌球蛋白及肌動蛋白都含有,而羥賴氨酸和羥脯氨酸在膠原合成中,可以賴氨酸和脯氨酸為原料。賴氨酸為必需胺基酸,而脯氨酸為非必需胺基酸,很容易從谷氨酸轉變而來。所以,以肌球蛋白及肌動蛋白作為胺基酸的提供者以合成膠原時,在胺基酸品種上是可以滿足的。只是在各種胺基酸的比例上,由於膠原較肌球蛋白及肌動蛋白富含甘氨酸、脯氨酸、丙氨酸和羥脯氨酸。因此,將消耗遠遠多於所合成膠原的量,才能提供所需的各種胺基酸。在進食量不足,依靠內源性肌肉蛋白來完成傷口癒合是不經濟的。故術後應儘可能早地使病人得到外源蛋白質,並且考慮到胺基酸品種上的特點,適當給以富含甘氨酸、脯氨酸、丙氨酸和羥脯氨酸的食物,或直接給以富含膠原的豬皮或豬蹄之類作成的食物,如豬皮凍或豬蹄湯(包括湯和豬蹄皮),是有極大益處的。
表37-3 肌球蛋白、肌動蛋白及膠原的胺基酸含量比較表(mol.105g-1)
| 胺基酸種類 | 肌球蛋白 | 肌動蛋白 | 膠原 |
| 賴氨酸 | 94 | 47 | 31 |
| 組氨酸 | 17 | 18 | 5 |
| 精氨酸 | 46 | 38 | 49 |
| 門冬氨酸 | 82 | 86 | 47 |
| 蘇氨酸 | 36 | 62 | 19 |
| 絲氨酸 | 45 | 53 | 32 |
| 谷氨醯胺 | 166 | 99 | 77 |
| 脯氨酸 | 20 | 46 | 131 |
| 甘氨酸 | 41 | 70 | 363 |
| 丙氨酸 | 75 | 72 | 107 |
| 胱氨酸 | 8 | 12 | - |
| 纈氨酸 | 42 | 48 | 29 |
| 蛋氨酸 | 24 | 38 | 5 |
| 異亮氨酸 | 42 | 64 | 43 |
| 亮氨酸 | 86 | 65 | 43 |
| 酪氨酸 | 17 | 38 | 5 |
| 苯丙氨酸 | 30 | 30 | 15 |
| 羥賴氨酸 | - | - | 7 |
| 羥脯氨酸 | - | - | 107 |
膠原的合成與含硫胺基酸的關係:實驗研究以及臨床上早已觀察到蛋白質缺乏影響傷口癒合,通過補給含硫胺基酸(甲硫氨酸或醯氨酸)可獲得改善(圖37-3)。最近證明在膠原的合成過程中,最初在細胞內合成的肽鏈,比可以聚集為膠原分子的肽鏈要長得多,約長30~40%(原膠原)。其堅硬中心的兩端非螺旋形的肽含有半胱氨酸。非螺旋形端的迅速聯合以及雙硫鍵的形成,促進定位和堅硬中心的螺旋形集合,然後在前膠原肽酶的作用下,含半胱氨酸的非螺旋形部位從分子上脫落下來,中心成螺旋交聯部分即為膠原。故膠原分子中不含半胱氨酸,但卻是合成過程所必需。
膠原的合成與Cu2+的關係:三和要肽鏈組成的原膠原分子,在最初階段,其張力強度是較弱的。隨著時間的推移,在三條肽鏈之間或鄰近分子之間形成共價鍵,張力強度才得以增加。雖然膠原纖維中的分子內和分子間的共價鍵的性質還在研究之中,但某些鍵反應已被確定。如二條肽鏈之間賴氨酸的交叉連接。賴氨酸先轉變為醛,二條肽鏈上的醛基藉醛醇縮合反應而連接起來。
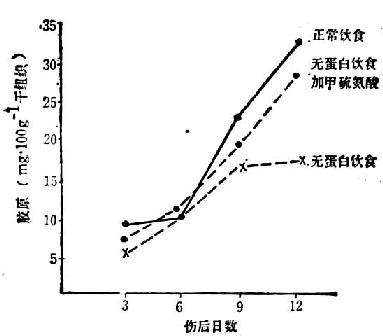
圖37-3 傷口癒合與蛋白質的關係
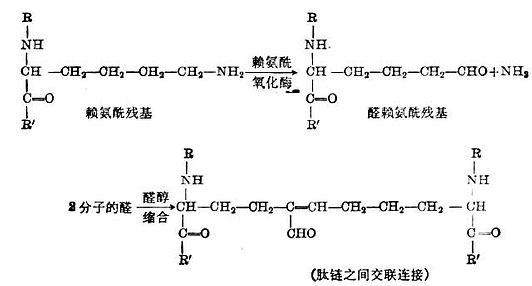
在賴氨醯氧化酶催化賴氨酸變成δ-半醛-α-胺已二酸的反應中需要銅離子為輔助因子。銅的耗竭或不足將影響醛醇縮合及交聯連接。
膠原的合成與Fe2+和抗環血酸的關係:膠原合成中還有一個特點,即脯氨酸或賴氨酸不是先羥基化為羥脯氨酸或脯氨酸或羥賴氨酸之後再合成膠原,而是脯氨酸或賴氨酸參與合成原膠原以後,再由脯氨醯羥化酶使肽鏈上的脯氨酸羥基化。羥基化過程中,羥基中的氧原子來自空氣中的分子氧,以及脯氨醯羥化酶需要-α酮戊二酸作為基質和二價鐵為輔助因子,還需要抗壞血酸作為電子供體。故鐵和抗壞血酸是傷口癒合所必需。一般未感染的切口,術後7天左右,其膠原形成,已使病人從事一般的活動而不至裂開。此時可拆線出院,但傷口膠原的形成和交聯可持續數月或經年,這時期仍需不斷補充抗壞血酸,若缺乏出現壞血症,切口在外力作用下,尚有裂開的可能。
傷口癒合與鋅的關係:由於鋅是體內許多種酶的成分或輔酶的成分,特別鋅是DNA聚合酶、RNA聚合酶的輔酶成分,對細胞的分裂生長以及蛋白質的合成都有密切的關係。與傷口癒合密切相關的蛋白多糖和膠原纖維,在化學成分上都屬於蛋白質。故鋅也影響它們的合成。不僅如此,鋅對傷口年上皮的形成,影響更為顯著。這從鋅影響細胞分裂、生長及蛋白質合成以及體內20%的鋅存在於皮膚中,尤其集中在上皮組織可得到解釋。經許多學者研究肯定,機體處於低鋅狀態時,補鋅是有促進作用的。而應激時(如手術)隨尿氮、尿磷、尿硫等排出增加,尿鋅排出也是增加的。術後恢復期,機體無疑處於低鋅狀態。臨床上有的以硫酸鋅或醋酸鋅補充外,食物中,動物皮膚含量都很高,當以豬皮或豬蹄作為獲得甘氨酸、脯氨酸的來源時,同時也獲得了較多量的鋅。
綜上所述,可見傷口癒合與含硫胺基酸、甘氨酸、脯氨酸(羥脯氨酸)、賴氨酸(羥賴氨酸)、維生素A、抗壞血酸以及鐵、銅、鋅的密切關係。而蛋白質豐富、熱量充裕的完全而平衡的營養對術後機體恢復和保證傷口癒合的重要性是無需贅述的。
37.5.2 骨折修復與營養
先從骨的結構和組成,再結合骨折修復及影響因素來討論應注意的營養問題。
(1)骨的結構和組成
①骨的大體結構:用肉眼或一般的放大鏡觀察,可把骨分為兩種類型——松質骨和密質骨。松質骨由分枝的骨小梁的主體網格構成,形成一個間隙互相連通的錯綜複雜的系統,內面充滿骨髓。密質骨呈實心的連續體,在顯微鏡下才能看到其中的間隙。
②骨的微細結構:如用顯微鏡觀察長骨骨幹薄磨片,可觀察到密質骨主要由鈣化了的骨基質所組成,稱為骨板。在骨基質中均勻地遍布著腔隙,稱為骨陷窩。每一個骨陷窩中有一個骨細胞。從每個骨陷窩向四周輻射狀伸出骨小管,與鄰近骨陷窩的骨小管相吻合,形成廣泛的纖細通道。並與最近的血管周圍間隙相通以獲取營養、交換離子、維持骨的正常代謝。上述密質骨的骨板常圍繞骨內的縱行血管通道呈同心圓排列,形成圓柱形結構單位,稱為哈弗系統。松質骨也由骨板組成,但骨小梁較細,一般沒有血管進入,故沒有哈弗系統。骨細胞的營養從骨內膜表面,經微細的骨小管彌散而來。
從以上所述,可知骨主要由細胞和骨基質兩部分組成。
①骨的細胞:包括骨細胞、成骨細胞、破骨細胞及其他細胞等。是由間充質細胞根據骨化的不同情況,所分化出不同形態和不同功能的細胞。成骨細胞是合成骨基質中的膠原和蛋白多糖的細胞。在合成作用旺盛時呈方形,細胞內可見合成蛋白質以供分泌的超微結構——發達的粗面內質網和高爾基體。膠原和蛋白多糖由粗面內質網合成後,由細胞表面排出到細胞外,無機物借膠原而沉積。當成骨細胞一旦被新合成的基質完全包圍,它就在骨陷窩中成為骨細胞。破骨細胞僅出現在骨質吸收和骨分解時骨的表面,能分泌膠原蛋白酶、蛋白水解酶等使膠原纖維分解,骨基質解聚。骨折後骨折部位也出現破骨細胞,以清除被損骨質的殘屑和鈣鹽。其他細胞有網狀細胞、骨內膜細胞(實質上是靜止的成骨細胞)以及成纖維細胞(當它增值時,將合成膠原)。
②骨基質:又可分為有機物和無機物兩部位。其中有機物大部分為膠原,稱為骨膠原,骨膠原的結構和普通結締組織的膠原基本一樣,也是以等距離橫紋的纖維形式出現,由轉化來的成骨細胞的粗面內質網所分泌而進入細胞間隙的。在成熟的板層狀骨內,膠原纖維的排列非常規整。在哈費系統的每一塊骨板內,膠原纖維平行排列,有機物中除膠原外則為無定形基質,包括硫酸軟骨素A、硫酸軟骨素C、硫酸軟骨素B、硫酸角質素以及透明質酸,也由成骨細胞所分泌。至於無機物則占骨基質乾重的50~65%,主要成分是磷酸鈣(佔84%),其他碳酸鈣佔10%,檸檬酸鈣佔2%,磷酸鎂佔1%,磷酸氫二鈉佔2%。無機物中有60%以結晶的羥磷灰石[Ca10(PO4)6(OH)2]的形式存在。其餘40%為無定形的磷酸氫鈣,Ca2+、Mg2+、Na+、Cl-、HCO3-、F-以及檸檬酸根可吸附在羥磷灰石微細結晶的晶格之間。電鏡下見羥磷灰石晶體呈長條狀結晶,位於膠原原纖維側畔,並經常被一層無定形基質所包裹。羥磷灰石的表面離子是同水結合的,形成一個水化層,利於晶體和體液進行離子交換。
以上是正常情況,骨折時新骨的形成及修復的過程如下:
(2)骨折修復
①骨痂形成的組織學變化:骨折後血腫充滿組織間的裂隙。斷端附近的骨細胞因受傷和缺血而壞死。鄰近斷端的骨外膜於骨折後24h即出現組織學變化。深層的細胞增加,胞核增大。一周後在增厚的骨外膜中,出現於骨幹平行並緊密相連的片狀骨樣組織。
②此時,由於血腫尚未機化,新生的細胞血管尚未深入,故骨外膜處的成骨細胞的分泌和活動只能沿著血腫外圈向骨折處推進。隨著血腫的機化,骨折處骨內膜也出現組織學變化,逐漸骨折兩端由骨外膜生成的外骨痂和由骨內膜生成的內骨痂分別會合。最終血腫完全機化,內外骨痂會合成橋樑骨痂。當完全融合併完全骨化時則達到臨床癒合。以後經過塑形期,骨痂密度加大,骨折間隙完全消失,則達到骨性癒合。
(3)骨折修復的生化變化與營養的關係
①成骨細胞分泌無定形基質蛋白多糖以及膠原,其生化變化與切口癒合中成纖維細胞的生化過程相同。
②在膠原上沉積無機物使成為骨樣組織。由於鈣在無機物中占的比例最大,故這一過程稱為骨的鈣化。要使體液中離中狀態的無機鹽轉為固體沉積下來,首先在鈣化的局部要有足量的鈣和磷酸根離子,這就涉及到膳食中的攝入量是否豐富以及維生素D是否充裕,或接受紫外光線或日光是否充足。然後由於鹼性磷酸酶的作用(在腺三磷的協同下),使膠原鈣化。鈣化最先在交錯排列的膠原原纖維末端之間的空隙處開始,先沉積的鈣鹽結晶很小,隨著不斷地沉積慢慢加大,填充在基質內。
鹼性磷酸酶能水解多種磷酸酯,使無機磷離子濃度升高,並使鈣化抑制劑焦磷酸鹽水解,解除對鈣化的抑制,故在鈣化中的作用很重要。而鹼性磷酸酶是含鋅的酶,鋅的充裕與否影響其活性。家兔骨折實驗中,供鋅組骨痂中鋅含量明顯高於對照組,並且骨折癒合加快,抗拉伸性能優於對照組。組織學檢查觀察到細胞增強活躍,軟骨及新骨豐富,X線顯示豐富的外骨痂。並觀察到無論供鋅組或對照組,凡骨折的家兔,其橈骨的非骨折部位以及尺骨中的鈣和鋅的含量均明顯下降。在8周的觀察期內,骨鋅含量皆低於正常值。說明骨折後機體動員體內非骨折部位的骨鈣、骨鋅以保證骨折部位的癒合。這一實驗結果充分說明,骨折後補充鋅的重要性。鋅的作用不僅僅在於是鹼性磷磷酸酶的成分。還關係到膠原的合成。
由於骨折修復的第一步是膠原和蛋白多糖的合成,凡影響膠原和蛋白多糖合成的因素對骨折修復也有影響,如銅能促進骨折的癒合已為實驗所證實。
| 關於「營養學/癒合與營養」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |