生物化學與分子生物學/脂肪酸的氧化分解
| 醫學電子書 >> 《生物化學與分子生物學》 >> 脂類代謝 >> 脂肪酸代謝 >> 脂肪酸的氧化分解 |
| 生物化學與分子生物學 |
|
|
|
脂肪酸在有充足氧供給的情況下,可氧化分解為CO2和H2O,釋放大量能量,因此脂肪酸是機體主要能量來源之一。肝和肌肉是進行脂肪酸氧化最活躍的組織,其最主要的氧化形式是β-氧化。
目錄 |
(一)脂肪酸的β-氧化過程
此過程可分為活化,轉移,β-氧化共三個階段。
1.脂肪酸的活化
和葡萄糖一樣,脂肪酸參加代謝前也先要活化。其活化形式是硫酯:脂肪醯CoA,催化脂肪酸活化的酶是脂醯CoA合成酶(acyl CoA synthetase)。
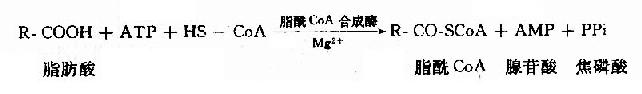
活化後生成的脂醯CoA極性增強,易溶於水;分子中有高能鍵、性質活潑;是酶的特異底物,與酶的親和力大,因此更容易參加反應。
脂醯CoA合成酶又稱硫激酶,分布在胞漿中、粒線體膜和內質網膜上。胞漿中的硫激酶催化
中短鏈脂肪酸活化;內質網膜上的酶活化長鏈脂肪酸,生成脂醯CoA,然後進入內質網用於甘油三酯合成;而粒線體膜上的酶活化的長鏈脂醯CoA,進入粒線體進入β-氧化。
2.脂醯CoA進入粒線體:催化脂肪酸β-氧化的酶系在粒線體基質中,但長鏈脂醯CoA不能自由通過粒線體內膜,要進入粒線體基質就需要載體轉運,這一載體就是肉毒鹼(carnitine),即3-羥-4-三甲氨基丁酸。
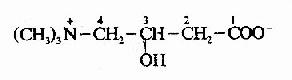
長鏈脂肪醯CoA和肉毒鹼反應,生成輔酶A和脂醯肉毒鹼,脂肪醯基與肉毒鹼的3羥基通過酯鍵相連接。
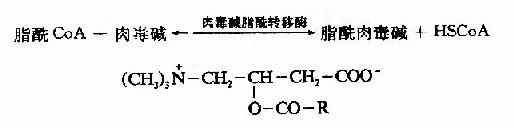
催化此反應的酶為肉毒鹼脂醯轉移酶(carnitineacyl transferase)。粒線體內膜的內外兩側均有此酶,系同工酶,分別稱為肉毒鹼脂醯轉移酶I和肉毒鹼脂醯轉移酶Ⅱ。酶Ⅰ使胞漿的脂醯CoA轉化為輔酶A和脂肪醯肉毒鹼,後者進入粒線體內膜。位於粒線體內膜內側的酶Ⅱ又使脂肪醯肉毒鹼轉化成肉毒鹼和脂醯CoA,肉毒鹼重新發揮其載體功能,脂醯CoA則進入粒線體基質,成為脂肪酸β-氧化酶系的底物(圖5-10)。
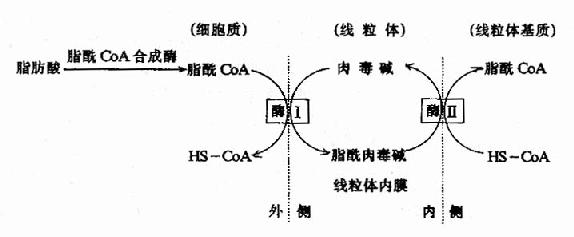
圖5-10 肉毒鹼參與脂醯輔酶A轉入粒線體示意圖
酶Ⅰ:位於粒線體內膜外側的肉毒鹼脂醯轉移酶
酶Ⅱ:位於粒線體內膜內側的肉毒鹼脂醯轉移酶
長鏈脂醯CoA進入粒線體的速度受到肉毒鹼脂醯轉移酶Ⅰ和酶Ⅱ的調節,酶Ⅰ受丙二醯CoA抑制,酶Ⅱ受胰島素抑制。丙二醯CoA是合成脂肪酸的原料,胰島素通過誘導乙醯CoA羧化酶的合成使丙二醯CoA濃度增加,進而抑制酶Ⅰ。可以看出胰島素對肉毒鹼脂醯轉移酶Ⅰ和酶Ⅱ有間接或直接抑制作用。飢餓或禁食時胰島素分泌減少,肉毒鹼脂醯轉移酶Ⅰ和酶Ⅱ活性增高,轉移的長鏈脂肪酸進入粒線體氧化供能。
3.β-氧化的反應過程:脂醯CoA在粒線體基質中進入β氧化要經過四步反應,即脫氫、加水、再脫氫和硫解,生成一分子乙醯CoA和一個少兩個碳的新的脂醯CoA。
第一步脫氫(dehydrogenation)反應由脂醯CoA脫氫酶活化,輔基為FAD,脂醯CoA在α和β碳原子上各脫去一個氫原子生成具有反式雙鍵的α、β-烯脂肪醯輔酶A。

第二步加水(hydration)反應由烯醯CoA水合酶催化,生成具有L-構型的β-羥脂醯CoA。
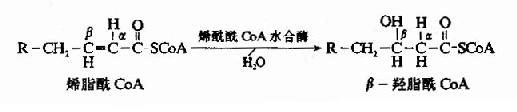
第三步脫氫反應是在β-羥脂肪醯CoA脫飴酶(輔酶為NAD+)催化下,β-羥脂肪醯CoA脫氫生成β酮脂醯CoA。
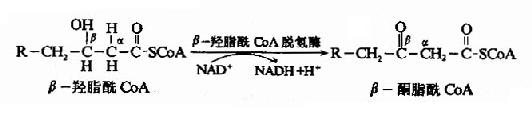
第四步硫解(thiolysis)反應由β-酮硫解酶催化,β-酮酯醯CoA在α和β碳原子之間斷鏈,加上一分子輔酶A生成乙醯CoA和一個少兩個碳原子的脂醯CoA。
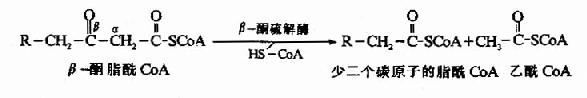
上述四步反應與TCA循環中由琥珀酸經延胡索酸、蘋果酸生成草醯乙酸的過程相似,只是β-氧化的第四步反應是硫解,而草醯乙酸的下一步反應是與乙醯CoA縮合生成檸檬酸。
長鏈脂醯CoA經上面一次循環,碳鏈減少兩個碳原子,生成一分子乙醯CoA,多次重複上面的循環,就會逐步生成乙醯CoA。
從上述可以看出脂肪酸的β-氧化過程具有以下特點。首先要將脂肪酸活化生成脂醯CoA,這是一個耗能過程。中、短鏈脂肪酸不需載體可直拉進入粒線體,而長鏈脂醯CoA需要肉毒鹼轉運。β-氧化反應在粒線體內進行,因此沒有粒線體的紅細胞不能氧化脂肪酸供能。β-氧化過程中有FADH2和NADH+H+生成,這些氫要經呼吸鏈傳遞給氧生成水,需要氧參加,乙醯CoA的氧化也需要氧。因此,β-氧化是絕對需氧的過程。
脂肪酸β-氧化的整個過程可用下圖(圖5-11)表示:
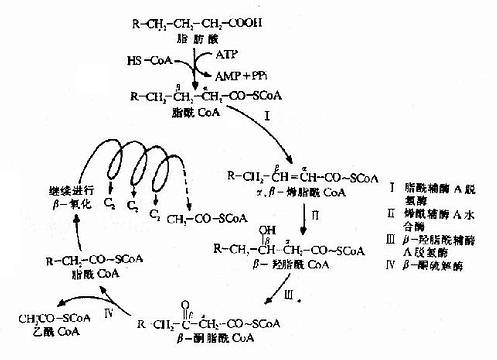
圖5-11 脂肪酸β氧化反應過程
(二)脂肪酸β-氧化的生理意義
脂肪酸β-氧化是體內脂肪酸分解的主要途徑,脂肪酸氧化可以供應機體所需要的大量能量,以十八個碳原子的飽和脂肪酸硬脂酸為例,其β-氧化的總反應為:
CH3(CH2)15COSCoA+8NAD++*CoASH+8H2O——→9CH3COSCoA+8FADH2+8NADH+8H+
8分子FADH2提供8×2=16分子ATP,8分子NADH+H+提供8×3=24分子ATP,9分子乙醯CoA完全氧化提供9×12=108個分子ATP,因此一克分子硬脂酸完全氧化生成CO2和H2O,共提供148克分子ATP。硬脂酸的活化過程消耗2克分子ATP,所以一克分子硬脂酸完全氧化可淨生成146克分子ATP。一克分子葡萄糖完全氧化可生成38分子ATP。三克分子葡萄糖所含碳原子數與一克分子硬脂酸相同,前者可提供114克分子ATP,後者可提供146克分子ATP。可見在碳原子數相同的情況下脂肪酸能提供更多的能量。脂肪酸氧化時釋放出來的能量約有40%為機體利用合成高能化合物,其餘60%以熱的形式釋出,熱效率為40%,說明人體能很有效地利用脂肪酸氧化所提供的能量。
脂肪酸β-氧化也是脂肪酸的改造過程,人體所需要的脂肪酸鏈的長短不同,通過β-氧化可將長鏈脂肪酸改造成長度適宜的脂肪酸,供機體代謝所需。
脂肪酸β-氧化過程中生成的乙醯CoA是一種十分重要的中間化合物,乙醯CoA除能進入三羧酸循環氧化供能外,還是許多重要化合物合成的原料,如酮體、膽固醇和類固醇化合物。
(三)脂肪酸的特殊氧化形式
1.丙酸的氧化:人體內和膳食中含極少量的奇數碳原子脂肪酸,經過β-氧化除生成乙醯CoA外還生成一分子丙醯CoA,某些胺基酸如異亮氨酸、蛋氨酸和蘇氨酸的分解代謝過程中有丙醯CoA生成,膽汁酸生成過程中亦產生丙醯CoA。丙醯CoA經過羧化反應和分子內重排,可轉變生成琥珀醯CoA,可進一步氧化分解,也可經草醯乙酸異生成糖,反應過程見下圖。
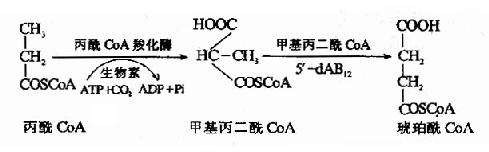
甲基丙二醯CoA變位酶的輔酶是5′-脫氧腺苷B12(5′dAB12),維生素B12缺乏或5′-dAB12生成障礙均影響變位酶活性,使甲基丙二醯CoA堆積。結果,一方面甲基丙二醯CoA脫去輔酶A,生成甲基丙二酸引起血中甲基丙二酸含量增高(甲基丙二酸血症),並從尿中排出體外(24小時排出量大於4mg時稱為甲基丙二酸尿症)。另一方面又引起丙醯CoA濃度增高,可參與神經髓鞘脂類合成,生成異常脂肪酸(十五碳、十七碳和十九碳脂肪酸),引起神經髓鞘脫落、神經變性(臨床上稱為亞急性合併變性症)。
2.ω-氧化:脂肪酸的ω-氧化是在肝微粒體中進行,由加單氧酶催化的。首先是脂肪酸的ω碳原子羥化生成ω-羧脂肪酸,再經ω醛脂肪酸生成α、ω-二羧酸,然後在α-端或ω-端活化,進入粒線體進入β-氧化,最後生成琥珀醯CoA。
3.α-氧化:脂肪酸在微粒體中由加單氧酶和脫羧酶催化生成α-羥脂肪酸或少一個碳原子的脂肪酸的過程稱為脂肪酸的α-氧化。長鏈脂肪酸由加單氧酶催化、由抗壞血酸或四氫葉酸作供氫體在O2和Fe2+參與下生成α-羥脂肪酸,這是腦苷脂和硫脂的重要成分,α-羥脂肪酸繼續氧化脫羧就生成奇數碳原子脂肪酸。α-氧化障礙者不能氧化植烷酸(phytanic acid,3、7、11、15-四甲基十六烷酸)。牛奶和動物脂肪中均有此成分,在人體內大量堆積便引起Refsum氏病。α-氧化主要在腦組織內發生,因而α-氧化障礙多引起神經症狀。
4.不飽和脂肪酸(unsaturated fatty acid)的氧化:人體內約有1/2以上的脂肪酸是不飽和脂肪酸,食物中也含有不飽和脂肪酸。這些不飽和脂肪酸的雙鍵都是順式的,它們活化後進入β-氧化時,生成3順烯脂醯CoA,此時需要順3反2異構酶催化使其生成2反烯脂醯CoA以便進一步反應。2反烯脂醯CoA加水後生成Dβ-羥脂醯CoA,需要β-羥脂醯CoA差向異構酶催化,使其由D構型轉變成L構型,以便再進行脫氧反應(只有Lβ-羥脂醯CoA才能作為β-羥脂醯CoA脫氫酶的底物)。
不飽和脂肪酸完全氧化生成CO2和H2O時提供的ATP少於相同碳原子數的飽和脂肪酸。
(四)酮體的生成與利用
酮體(acetonebodies)是脂肪酸在肝臟進行正常分解代謝所生成的特殊中間產物,包括有乙醯乙酸(acetoacetic acid約佔30%),β-羥丁酸(βhydroxybutyric acid約佔70%)和極少量的丙酮(acetone)。正常人血液中酮體含量極少(約為0.8?.0mg/dl,0.22mM),這是人體利用脂肪氧化供能的正常現象。但在某些生理情況(飢餓、禁食)或病理情況下(如糖尿病),糖的來源或氧化供能障礙,脂動員增強,脂肪酸就成了人體的主要供能物質。若肝中合成酮體的量超過肝外組織利用酮體的能力,二者之間失去平衡,血中濃度就會過高,導致酮血症(acetonemia)和酮尿症(acetonuria)。乙醯乙酸和β-羥丁酸都是酸性物質,因此酮體在體內大量堆積還會引起酸中毒。
1.酮體的生成過程:
酮體是在肝細胞粒線體中生成的,其生成原料是脂肪酸β-氧化生成的乙醯CoA。首先是二分子乙醯CoA在硫解酶作用下脫去一分子輔酶A,生成乙醯乙醯CoA。
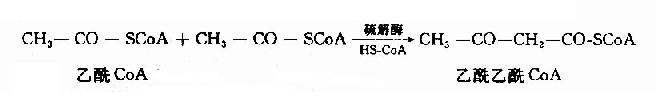
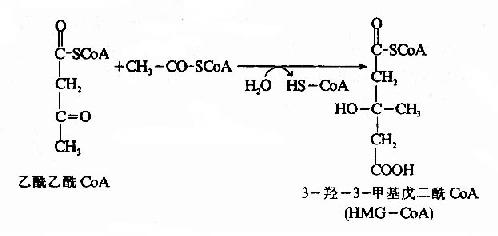
在3-羥-3-甲基戊二醯CoA(hydroxy methyl glutarylCoA,HMGCoA)合成酶催化下,乙醯乙醯CoA再與一分子乙醯CoA反應,生成HMGCoA,並釋放出一分子輔酶。這一步反應是酮體生成的限速步驟。
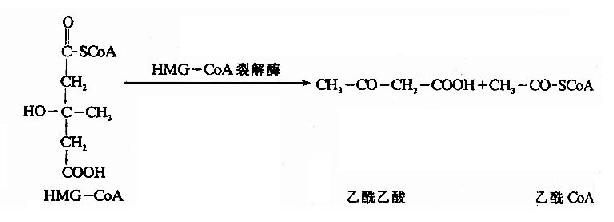
HMG-CoA裂解酶催化HMG-CoA生成乙醯乙酸和乙醯CoA,後者可再用於酮體的合成。
粒線體中的β-羥丁酸脫氫酶催化乙醯乙酸加氫還原(NADH+H+作供氫體),生成β-羥丁酸,此還原速度決定於粒線體中[NADH+H+]/[NAD+]的比值,少量乙棧酸可自行脫羧生成丙酮。
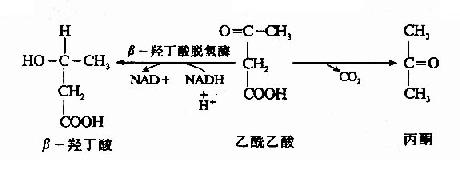
上述酮體生成過程實際上是一個循環過程,又稱為雷寧循環(lynen cycle),兩個分子乙醯CoA通過此循環生成一分子乙醯乙酸(見圖5-12)。
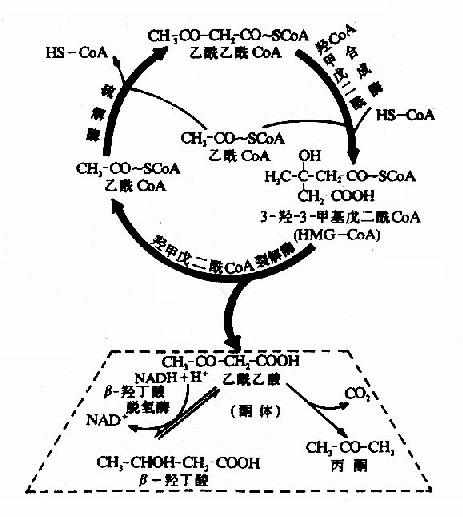
圖5-12 肝臟內酮體的生成
酮體生成後迅速透過肝粒線體膜和細胞膜進入血液,轉運至肝外組織利用。
2.酮體的利用過程
骨骼肌、心肌和腎臟中有琥珀醯CoA轉硫酶(succinylCoa thiophorase),在琥珀醯CoA存在時,此酶催化乙醯乙酸活化生成乙醯乙醯CoA。

心肌、腎臟和腦中還有硫激酶,在有ATP和輔酶T存在時,此酶催化乙醯化酸活化成乙醯乙醯CoA。
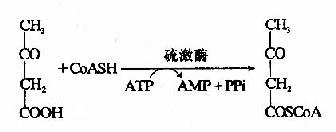
經上述兩種酶催化生成的乙醯乙醯CoA在硫解酶作用下,分解成兩分子乙醯CoA,乙醯CoA主要進入三羧酸循環氧化分解。
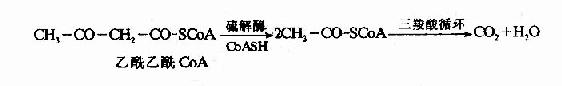
丙酮除隨尿排出外,有一部分直接從肺呼出,代謝上不佔重要地位,肝外組織利用乙醯乙酸和β-羥丁酸的過程可用下圖表示(圖5-13)。
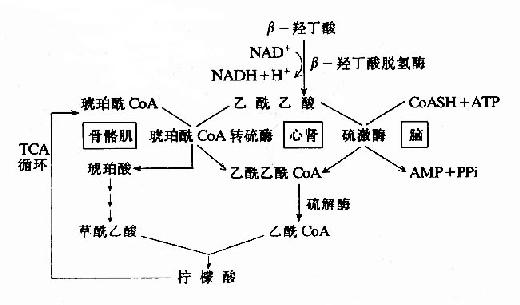
圖5-13 酮體利用過程
肝細胞中沒有琥珀醯CoA轉硫酶和乙醯乙酸硫激酶,所以肝細胞不能利用酮體。
肝外組織利用酮體的量與動脈血中酮體濃度成正比,自中酮體濃度達70mg/dl時,肝外組織的利用能力達到飽和。腎酮閾亦為70mg/dl,血中酮體濃度超過此值,酮體經腎小球的濾過量超過腎小管的重吸收能力,出現酮尿症。腦組織利用酮體的能力與血糖水平有關,只有血糖水平降低時才利用酮體。
酮體的生成和利用過程可用下圖表示(圖5-14)。
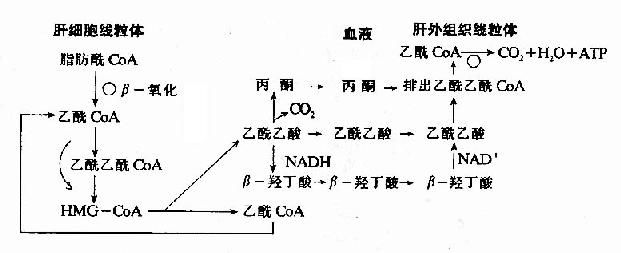
圖5-14 酮體的生成和利用
3.酮體生成的意義
(1)酮體易運輸:長鏈脂肪酸穿過粒線體內膜需要載體肉毒鹼轉運,脂肪酸在血中轉運需要與白蛋白結合生成脂酸白蛋白,而酮體通過粒線體內膜以及在血中轉運並不需要載體。
(2)易利用:脂肪酸活化後進入β-氧化,每經4步反應才能生成一分子乙醯CoA,而乙醯乙酸活化後只需一步反應就可以生成兩分子乙醯CoA,β-羥丁酸的利用只比乙醯乙酸多一步氧化反應。因此,可以把酮體看作是脂肪酸在肝臟加工生成的半成品。
(3)節省葡萄糖供腦和紅細胞利用:肝外組織利用酮體會生成大量的乙醯CoA,大量乙醯CoA
抑制丙酮酸脫氫酶系活性,限制糖的利用。同時乙醯CoA還能激活丙酮酸羧化酶,促進糖異生。肝外組織利用酮體氧化供能,就減少了對葡萄糖的需求,以保證腦組織、紅細胞對葡萄糖的需要。腦組織不能利用長鏈脂肪酸,但在飢餓時可利用酮體供能,飢餓5?周時酮體供能可多達70%。
(4)肌肉組織利用酮體,可以抑制肌肉蛋白質的分解,防止蛋白質過多消耗,其作用機理尚不清楚。
(5)酮體生成增多常見於飢餓、妊娠中毒症、糖尿病等情況下。低糖高脂飲食也可使酮體生成增多。
| 關於「生物化學與分子生物學/脂肪酸的氧化分解」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |