生物化學與分子生物學/氨的代謝
| 醫學電子書 >> 《生物化學與分子生物學》 >> 胺基酸代謝 >> 胺基酸的一般代謝 >> 氨的代謝 |
| 生物化學與分子生物學 |
|
|
(一)氨的來源
1.組織中胺基酸分解生成的氨 組織中的胺基酸經過聯合脫氨作用脫氨或經其它方式脫氨,這是組織中氨的主要來源。組織中胺基酸經脫羧基反應生成胺,再經單胺氧化酶或二胺氧化酶作用生成游離氨和相應的醛,這是組織中氨的次要來源,組織中胺基酸分解生成的氨是體內氨的主要來源。膳食中蛋白質過多時,這一部分氨的生成量也增多。
2.腎臟來源的氨 血液中的谷氨醯胺流經腎臟時,可被腎小管上皮細胞中的谷氨醯胺酶(glutaminase)分解生成谷氨酸和NH3。
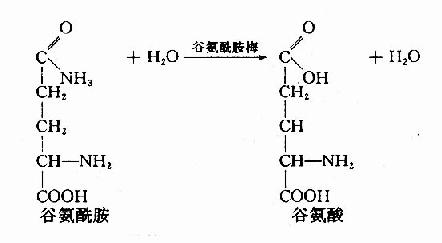
這一部分NH3約佔腎臟產氨量的60%。其它各種胺基酸在腎小管上皮細胞中分解也產生氨,約佔腎臟產氨量的40%。
腎小管上皮細胞中的氨有兩條去路:排入原尿中,隨尿液排出體外;或者被重吸收入血成為血氨。氨容易透過生物膜,而NH+4不易透過生物膜。所以腎臟產氨的去路決定於血液與原尿的相對pH值。血液的pH值是恆定的,因此實際上決定於原尿的pH值。原尿pH值偏酸時,排入原尿中的NH3與H+結合成為NH+4,隨尿排出體外。若原尿的pH值較高,則NH3易被重吸收入血。臨床上血氨增高的病人使用利尿劑時,應注意這一點。
3.腸道來源的氨 這是血氨的主要來源。正常情況下肝臟合成的尿素有15?0%經腸粘膜分泌入腸腔。腸道細菌有尿素酶,可將尿素水解成為CO2和NH3,這一部分氨約佔腸道產氨總量的90%(成人每日約為4克)。腸道中的氨可被吸收入血,其中3/4的吸收部位在結腸,其餘部分在空腸和迴腸。氨入血後可經門脈入肝,重新合成尿素。這個過程稱為尿素的腸肝循環(enterohepatin circulation of urea)。
腸道中的一小部分氨來自腐敗作用(putrescence)。這是指未被消化吸收的食物蛋白質或其水解產物胺基酸在腸道細菌作用下分解的過程。腐敗作用的產物有胺、氨、酚、吲哚、H2S等對人體有害的物質,也能產生對人體有益的物質,如脂肪酸、維生素K、生物素等。
腸道中NH3重吸收入血的程度決定於腸道內容物的pH值,腸道內pH值低於6時,腸道內氨生成NH+4,隨糞便排出體外;腸道內pH值高於6時,腸道內氨吸收入血。臨床上給高血氨病人作灌腸治療時,禁忌使用肥皂水等,以免加重病情。
(二)氨的去路
氨是有毒的物質,人體必須及時將氨轉變成無毒或毒性小的物質,然後排出體外。主要去路是在肝臟合成尿素、隨尿排出;一部分氨可以合成谷氨醯胺和門冬醯胺,也可合成其它非必需胺基酸;少量的氨可直接經尿排出體外。尿中排氨有利於排酸。
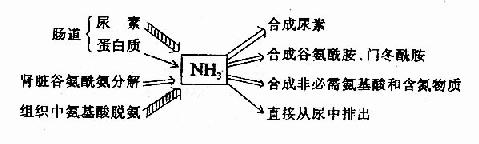
圖7-5 氨的來源和去路
(三)氨的轉運
1.葡萄糖-丙氨酸循環:肌肉組織中以丙酮酸作為轉移的氨基受體,生成丙酸經血液運輸到肝臟。在肝臟中,經轉氨基作用生成丙酮酸,可經糖異生作用生成葡萄糖,葡萄糖由血液運輸到肌肉組織中,分解代謝再產生丙酮酸,後者再接受氨基生成丙氨酸。這一循環途徑稱為「丙氨酸椘咸煙茄貳?alanineglucose cycle)。通過此途徑,肌肉胺基酸的NH2基,運輸到臟臟以NH3或天冬氨酸合成尿素。(圖7-6)
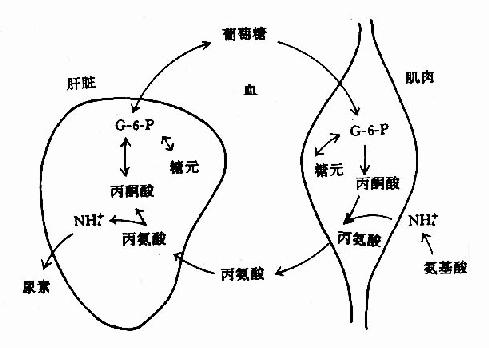
圖7-6 葡萄糖丙氨酸循環
飢餓時通過此循環將肌肉組織中胺基酸分解生成的氨及葡萄糖的不完全分解產物丙酮酸,以無毒性的丙氨酸形式轉運到肝臟作為糖異生的原料。肝臟異性生成的葡萄糖可被肌肉或其它外周組織利用。
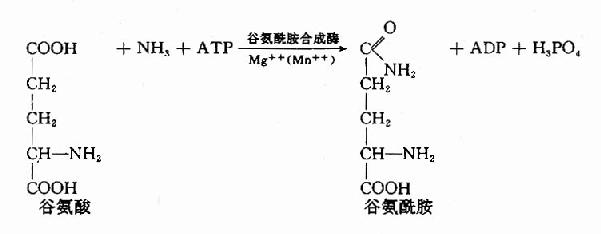
2.氨與谷氨酸在谷氨醯胺合成酶(glutamine synthetase)的催化下生成谷氨醯胺(glutamine),並由血液運輸至肝或腎,再經谷氨醯酶(glutaminaes)水解成谷氨酸和氨。谷氨醯胺主要從腦、肌肉等組織向肝或腎運氨。
(四)尿素合成
根據動物實驗,人們很早就確定了肝臟是尿素合成的主要器官,腎臟是尿素排泄的主要器官。1932年Krebs等人利用大鼠肝切片作體外實驗,發現在供能的條件下,可由CO2和氨合成尿素。若在反應體系中加入少量的精氨酸、鳥氨酸或瓜氨酸可加速尿素的合成,而這種胺基酸的含量並不減少。為此,Krebs等人提出了鳥氨酸循環(ornithine cyclc)學說。其後由Ratner和Cohen詳細論述了其各步反應。鳥氨酸循環可概括為:
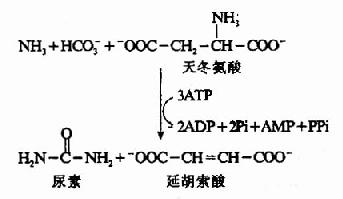
尿素中的兩個N原子分別由氨和天冬氨酸提供,而C原子來自HCO-3,五步酶促反應,二步在粒線體中,三步在胞液中進行。其詳細過程可分為以下五步:
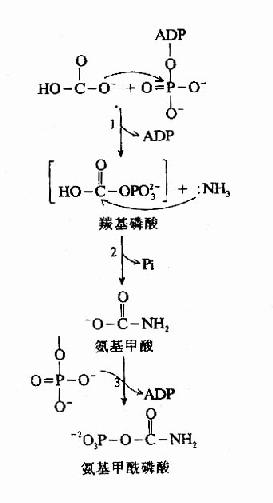
圖7-7 CPSⅠ 作用機理
氨基甲醯磷酸(carbamylphosphate)是在Mg++、ATP及N乙醯谷氨酸(Nacetyl glutamic acid,AGA)存在的情況下,由氨基甲醯磷酸合成酶I(carbamyl phosphate synthetaseI, CPSI)催化NH3和HCO-3在肝細胞粒線體中合成。
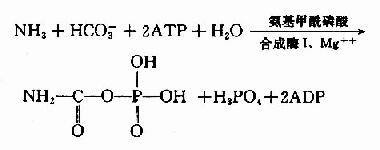
真核細胞中有兩種CPS:(1)粒線體CPS-Ⅰ利用游離NH3為氮源合成氨基甲醯磷酸,參與尿素合成。(2)胞液CPS-Ⅱ,利用谷氨醯胺作N源,參與嘧啶的從頭合成。
CPS-Ⅰ催化的反應包括下述三步(圖7-7)。
(1)ATP活化HCO-3生成ADP和羰基硫酸(carbonyl phosphate)
(2)NH2與羰基硫酸作用替代硫酸根,生成氨基甲酸(carbamate)和Pi。
(3)第2個ATP對氨甲酸磷酸化,生成氨基甲醯磷酸和ADP。
此反應是不可逆的,消耗2分子ATP。CPS1是一種變構酶,AGA是此酶變構激活劑。由乙醯CoA和谷氨酸縮合而成。
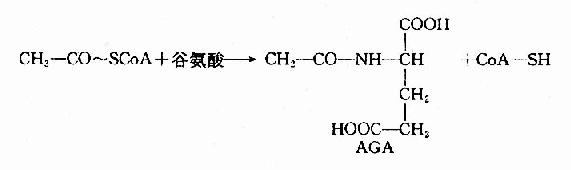
肝細胞粒線體中谷氨酸脫氫酶和氨基甲醯磷酸合成酶I催化的反應是緊密偶聯的。谷氨酸脫氫酶催化谷氨酸氧化脫氨,生成的產物有NH3和NADH+H+。NADH經NADH氧化呼吸鏈傳遞氧化生成H2O,釋放出來的能量用於ADP磷酸化生成ATP。因此谷氨酸脫氫酶催化反應不僅為氨基甲醯磷酸的合成提供了底物NH3,同時也提供了該反應所需要的能量ATP。氨基甲醯磷酸合成酶I將有毒的氨轉變成氨基甲醯磷酸,反應中生成的ADP又是谷氨酸脫氫酶的變構激活劑,促進谷氨酸進一步氧化脫氨。這種緊密偶聯有利於迅速將氨固定在肝細胞粒線體內,防止氨逸出粒線體進入細胞漿,進而透過細胞膜進入血液,引起血氨升高。
2.瓜氨酸(citrulline)的生成:
烏氨酸氨基甲醯轉移酶(ornithinetranscarbamoylase)存在於粒線體中,通常與CPS-I形成酶的複合物催化氨基甲醯磷酸轉甲醯基給鳥氨酸生成瓜氨酸。(注意:鳥氨酸,瓜氨酸均非標準α-胺基酸,不出現在蛋白質中)。此反應在粒線體內進行,而鳥氨酸在胞液中生成,所以必需通過一特異的穿棱系統進入粒線體內。

3.精氨酸代琥珀酸(Argininosuccinate)的合成。
瓜氨酸穿過粒線體膜進入胞漿中,在胞漿中由精氨酸代琥珀酸合成酶(Argininosuccinate Synthetase)催化瓜氨酸的脲基與天冬氨酸的氨基縮合生成精氨酸代琥珀酸,獲得尿素分子中的第二個氮原子。此反應由ATP供能。
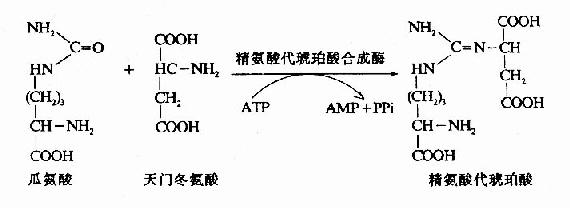
4.精氨酸(Arginine)的生成
精氨酸代琥珀酸裂解酶(Argininosuccinase)催化精氨酸代琥珀酸裂解成精氨酸和延胡索酸
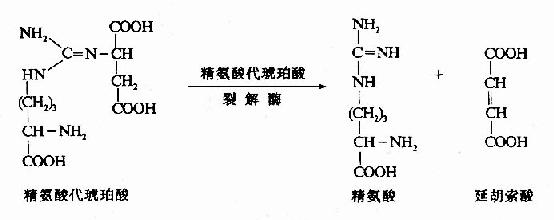
上述反應中生成的延胡索酸可經三羧酸循環的中間步驟生成草醯乙酸,再經穀草轉氨酶催化轉氨作用重新生成天冬氨酸。由此,通過延胡索酸和天冬氨酸,使三羧酸循環與尿素循環聯繫起來。
5.尿素的生成
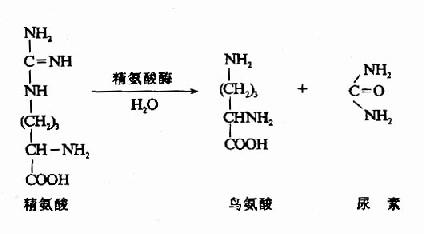
尿素循環的最後一步反應是由精氨酸酶(arginase)催化精氨酸水解生成尿素並再生鳥氨酸,鳥氨酸再進入粒線體參與另一輪循環。
尿素合成是一個耗能的過程,合成1分子尿素需要消耗4個高能磷酸鍵。(3個ATP水解生成2個ADP,2個Pi,1個AMP和PPi)。從尿素循環底物水平上,能量的消耗大於恢復。由L-谷氨酸脫氫酶催化脫氨和延胡索酸經草醯乙酸再生成天冬氨酸反應中均有NADH的生成。經粒線體再氧化可生成6個ATP(圖7-8)。
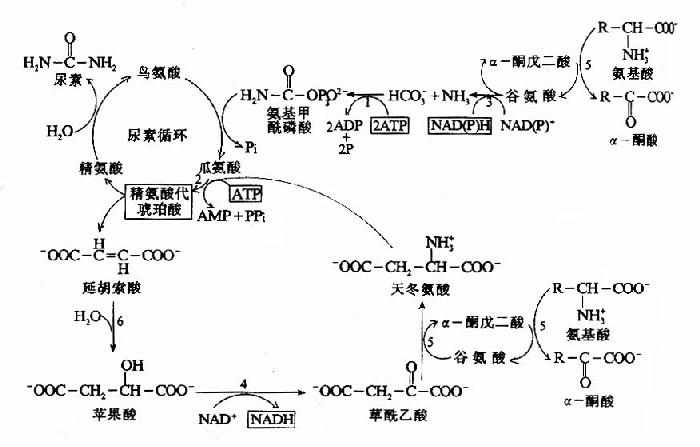
圖7-8 尿素循環的能量代謝
6.尿素循環的調節
CPS-I是粒線體內變構酶,其變構激活劑AGA由N乙醯谷氨酸合成酶催化生成,並由特異水解酶水解。肝臟生成尿素的速度與AGA濃度相關。當胺基酸分解旺盛時,由轉氨作用引起谷氨酸濃度升高,增加AGA的合成,從而激活CPS-I,加速氨基甲醯磷酸合成,推動尿素循環。精氨酸是AGA合成酶的激活劑,因此,臨床利用精氨酸治療高氨血症。
(五)高氨血症和氨中毒
正常生理情況下,血氨處於較低水平。尿素循環是維持血氨低濃度的關鍵。當肝功能嚴重損傷時,尿素循環發生障礙,血氨濃度升高,稱為高氨血症。氨中毒機制尚不清楚。一般認為,氨進入腦組織,可與α酮戊二酸結合成谷氨酸,谷氨酸又與氨進一步結合生成谷氨醯胺,從而使α酮戊二酸和谷氨酸減少,導致三羧酸循環減弱,從而使腦組織中ATP生成減少。谷氨酸本身為神經遞質,且是另一種神經遞質γ-氨基丁酸(γ-aminobutyrate,GABA)的前體,其減少亦會影響大腦的正常生理功能,嚴重時可出現昏迷。
| 關於「生物化學與分子生物學/氨的代謝」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |