希羅達
| A+醫學百科 >> 希羅達 |
希羅達是胃腸道腫瘤患者的新希望,用於聯合化療治療晚期或轉移性結直腸癌、晚期或轉移性胃癌
。
希羅達也適用於紫杉醇和化療方案治療無效的晚期原發性或轉移性乳腺癌的進一步治療。
目錄 |
分類及成分
【分類】:乙類
【治療分類】:化學治療
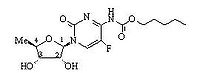
【 化學名稱】:5』-脫氧-5-氟-N-[(戊氧基)羰基]-胞(嘧啶核)苷
【 化學結構式】:
【分子 式】:C15H22FN3O6
【分子 量】:359.35
【性狀】: 0.15g:雙凸、長方形、淺桃色包衣片,除去包衣後顯白色。一面有XELODA字樣,另一面有
150字樣;0.5g:雙凸、長方形、桃色包衣片,除去包衣後顯白色。一面有XELODA字樣,另一面有500字樣。
適 應 證
結腸癌輔助化療:卡培他濱適用於Dukes』 C期、原發腫瘤根治術後、適於接受氟嘧啶類藥物單獨治療的結腸癌患者的單藥輔助治療。其治療的無病生存期(DFS)不亞於5-氟尿嘧啶和甲醯四氫葉酸聯合方案(5-FU/LV) 。卡培他濱單藥或與其他藥物聯合化療均不能延長總生存期(OS),但已有試驗數據表明在聯合化療方案中卡培他濱可較5-FU/LV改善無病生存期。醫師在開具處方使用卡培他濱單藥對Dukes』 C期結腸癌進行輔助治療時,可參考以上研究結果。用於支持該適應症的數據來自國外臨床研究(見[臨床試驗]部分內容)。
結直腸癌:當轉移性結直腸癌患者首選單用氟嘧啶類藥物治療時,卡培他濱可用作一線化療。卡培他濱與其他藥物聯合化療時,生存期優於5-FU/LV單藥化療。目前尚無證據證實卡培他濱單藥化療的生存期優勢。有關卡培他濱在聯合化療中取代5-FU/LV的安全性以及生存期優勢還需進一步研究。
乳腺癌聯合化療:卡培他濱可與多西紫杉醇聯合用於治療含蒽環類藥物方案化療失敗的轉移性乳腺癌。
乳腺癌單藥化療:卡培他濱亦可單獨用於治療對紫杉醇及含蒽環類藥物化療方案均耐藥或對紫杉醇耐藥和不能再使用蒽環類藥物治療(例如已經接受了累積劑量400 mg/m阿黴素或阿黴素同類物)的轉移性乳腺癌患者。耐藥的定義為治療期間疾病繼續進展(有或無初始緩解),或完成含有蒽環類藥物的輔助化療後6個月內複發。
胃癌:卡培他濱適用於不能手術的晚期或者轉移性胃癌的一線治療。
規格
(1) 0.15g; (2)0.5g
劑量與用法
推薦劑量
每日,500mg/m2,連用兩周,休息一周。每日總劑量分早晚兩次於飯後半小時用水吞服。如病情繼續惡化或產生不能耐受的毒性時應停止治療。
治療中劑量調整
參考地址http://192.168.1.110/xld/index.html
希羅達所引起的毒性有時需要做對症處理或對劑量進行調整(停藥或減量)。一旦減量,以後不能再增加劑量。以下是對毒性進行劑量調整時的推薦劑量(根據加拿大國家癌症研究所制定的常見毒性標準)。
1級。
2級。
第一次出現:停止治療,直到恢復至0-1級水平時,按維持劑量的100%進行下一療程治療。
第二次出現:停止治療,直到恢復至0-1級水平時,按維持劑量的75%進行下一療程治療。
第三次出現:停止治療,直到恢復至0-1級水平時,按維持劑量的50%進行下一療程治療。
第四次出現:永久停止治療。
3級:
第一次出現:停止治療,直到恢復至0-1級水平時,按維持劑量的75%進行下一療程治療。
第二次出現:停止治療,直到恢復至0-1級水平時,按維持劑量的50%進行下一療程治療。
第三次出現:永久停止治療。
4級:
永久停止治療。
如停藥後需繼續治療,則應考慮到病人的最大益處,且在毒性症状恢復至0-1級水平時以推薦劑量的50%進行使用。
特殊人群的劑量調整
肝功能不全:對肝轉移引起的輕度至中度肝功能不全的病人所進行的希羅達藥代動力學研究表明,無需對這類病人做劑量調整。
腎功能不全:尚未對腎功能不全者(指血清肌酐)進行希羅達藥代動力學研究。
兒童:尚未在兒童中進行希羅達的療效與安全性研究。 老年人:無須作劑量調整。但在老年人(65歲以上)比年輕人更易對卡培他濱產生毒性,故應對其進行密切監測。
禁忌症
有希羅達嚴重副反應或對氟脲嘧啶(卡培他濱的代謝產物)有過敏史者禁用。
預防措施
需限制劑量的毒性包括:腹瀉、腹痛、噁心、胃炎及手足症候群。近半數接受希羅達治療者會誘發腹瀉,對發生脫水的嚴重腹瀉者應嚴密監測並給予補液治療。每日腹瀉4-6次或者夜間腹瀉者為2級腹瀉,每日腹瀉7-9次或大便失禁和吸收障礙者為3級腹瀉,每日腹瀉10次以上或有肉眼血便和需靜脈補液者為4級腹瀉。如發生2、3或4級腹瀉,則應停用希羅達,直到腹瀉停止或腹瀉次數減少到1級時再恢復使用。3級或4級腹瀉後再使用希羅達應減少用量。幾乎近一半使用希羅達的病人發生手足症候群,但多為1-2級,3級症候群者不多見。多數副反應可以消失,儘管需要暫時停止用藥或減少用量,但無須長期停止治療。
妊娠及哺乳婦女
尚未在妊娠婦女中進行希羅達臨床研究,但必須要考慮到如果在這類病人中使用希羅達,可能會引起胎兒損傷。動物實驗表明卡培他濱能導致胎兒死亡或畸形。這些發現預示卡培他濱衍生物也具有這種作用,因此不能在妊娠婦女中使用希羅達。如在妊娠期間使用希羅達,或在使用希羅達期間發生妊娠時,必須考慮到該藥對胎兒損傷或致畸的潛在危險性。生育期婦女使用希羅達時必須採取避孕措施。
儘管尚不知希羅達是否能分泌於奶液中,但由於許多藥物能在奶液中分泌而有對哺乳的嬰兒造成嚴重副反應的潛在危險性,因此建議使用希羅達的婦女停止授乳。
副反應
希羅達的副反應較少,以下情況可能與之有關:
消化系統:希羅達最常見的副反應為可逆性胃腸道反應,如腹瀉、噁心、嘔吐、腹痛、胃炎等。
嚴重的(3-4級)副反應相對少見。
皮膚:在幾乎一半使用希羅達的病人中發生手足症候群:表現為麻木、感覺遲鈍、感覺異常、麻刺感、無痛感或疼痛感,皮膚腫脹或紅斑,脫屑、水泡或嚴重的疼痛。皮炎和脫髮較常見,但嚴重者很少見。
一般不良反應:常有疲乏但嚴重者極少見。其他常見的副反應為粘膜炎、發熱、虛弱、嗜睡等,但均不嚴重。
神經系統:頭痛、感覺異常、味覺障礙、眩暈、失眠等較常見,但嚴重者少見。
心血管系統:下肢水腫較輕且不常見。尚未見其他心血管系統副作用。
血液系統:中性粒細胞減少且少見也不嚴重,貧血極少見也不嚴重。
其他:厭食及脫水常見,但重者極少見。
相互作用
聯合用藥:希羅達與大量藥物合用,如抗組胺藥,NSAIDs,嗎啡,撲熱息痛,阿斯匹林,止吐藥,H2受體拮抗劑等,未見具有臨床意義的副作用。
蛋白結合:卡培他濱與血清蛋白結合率較低(64%)通過置換與能蛋白緊密結合的藥物發生相互作用的可能性尚無法預測。
與細胞色素P450酶間的相互作用:在體外實驗中,未發現卡培他濱對人類肝微粒體P450酶產生影響。
藥理毒理
藥理作用
正常細胞和腫瘤細胞都能將5-FU代謝為5-氟-2-脫氧尿苷酸單磷酸(FdUMP)和5-氟尿苷三磷酸(FUTP)。這些代謝產物通過二種不同機制引起細胞損傷。首先,FdUMP及葉酸協同因子N5,10-亞甲基四氫葉酸與胸苷酸合成酶(TS)結合形成共價結合的三重複合物。這種結合抑制2』- 脫氧尿[嘧啶核]苷酸形成胸核苷酸。胸核苷酸是胸腺嘧啶核苷三磷酸必需的前體,而後者是DNA合成所必需的,因此該化合物的不足能抑制細胞分裂。其次,在RNA合成過程中核轉錄酶可能會在尿苷三磷酸(UTP)的部位錯誤地編入FUTP。這種代謝錯誤將會干擾RNA的加工處理和蛋白質的合成。
毒理研究
目前尚無足夠多的研究評價卡培他濱的致癌性。卡培他濱在體外不引起細菌(Ames試驗)或哺乳動物細胞(中國倉鼠V79/HPRT基因突變分析)突變。卡培他濱在體外對人外周血淋巴細胞有致斷裂作用,而在小鼠骨髓活體內(微核試驗)卻無致斷裂作用。氟尿嘧啶引起細菌和酵母的突變,還在小鼠體內的微核試驗中引起染色體異常。
在小鼠的生育能力和總繁殖表現的研究中,口服卡培他濱760mg/kg/天擾亂了發情期並導致生育能力下降。在妊娠小鼠中,此劑量下無胚胎存活。發情期的擾亂是可逆的。該劑量在這個試驗中引起了雄性的退化改變,包括精母細胞和精子細胞數目的減少。單獨的藥代動力學研究顯示,對應於小鼠該5』-DFUR AUC值的劑量大約是患者每日建議劑量的0.7倍。
藥物過量
希羅達的臨床試驗中,未發現由於藥物過量而引起的副反應。但動物實驗(對猴類以25,679mg/m2/天的積極治療)以及對人以最大耐受劑量(3,514mg/m2/天)治療中,藥物過量的表現為噁心、嘔吐、腹瀉、胃腸激惹、腸胃出血和骨髓抑制等。處理方法應包括使用利尿劑脫水治療,必要時透析治療。
保存方式
藥品應置於攝氏 15 ~ 25 度乾燥處所;如發生變質或過期,不可再食用。
包裝
鋁塑包裝
0.15g:30片/盒,60片/盒
0.5g:12片/盒,60片/盒
有效期
24個月。
執行標準
YBH08582008
批准文號
0.15g:國藥准字H20073023
0.5g:國藥准字H20073024
生產廠家
| 關於「希羅達」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |