鹽類
| A+醫學百科 >> 鹽類 |
 本文介紹的是一類化合物。
本文介紹的是一類化合物。
- 關於食物調味料,詳見「食鹽」。
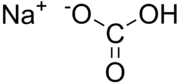
鹽(英文:Salt)在化學中,是指一類金屬離子或銨根離子(NH4+)與酸根離子或非金屬離子結合的化合物,如硫酸鈣,氯化銅,醋酸鈉,一般來說鹽是複分解反應的生成物,如硫酸與氫氧化鈉生成硫酸鈉和水,也有其他的反應可生成鹽,例如置換反應。
鹽分為單鹽和合鹽,單鹽分為正鹽、酸式鹽、鹼式鹽,合鹽分為復鹽和錯鹽。其中酸式鹽除含有金屬離子與酸根離子外還含有氫離子,鹼式鹽除含有金屬離子與酸根離子外還含有氫氧根離子,復鹽溶於水時,可生成與原鹽相同離子的合鹽;錯鹽溶於水時,可生成與原鹽不相同的複雜離子的合鹽-絡合物。
通常在標準狀況下,不可溶的鹽會是固態,但也有例外,例如熔鹽及離子液體。可溶鹽的溶液及熔鹽有導電性,因此可作為電解質。包括細胞的細胞質、血液、尿液及礦泉水中都含有許多不同的鹽類。
強鹼弱酸鹽是強鹼和弱酸反應的鹽,溶於水顯鹼性,如碳酸鈉。而強酸弱鹼鹽是強酸和弱鹼反應的鹽,溶於水顯酸性,如氯化鐵。
目錄 |
鹽的分類
單鹽
- 正鹽:
正鹽是一鹽類的一種,既不含能電離的氫離子,又不含氫氧根離子。 正鹽是酸和鹼完全中和的產物[1],但正鹽的水溶液不一定顯中性,如Na2CO3(碳酸鈉)溶液顯鹼性,(NH4)2SO4(硫酸銨)溶液顯酸性。酸跟鹼完全中和生成的鹽中,不會有酸中的氫離子,也不會有鹼中的氫氧根離子,只有金屬陽離子和酸根離子,這樣的鹽為正鹽。生成正鹽的反應。
- 酸式鹽:
酸式鹽是鹽類的一種,由陽離子和多元酸的不完全電離酸根陰離子組成。由於陰離子中含有在水中可電離的氫原子,因此被稱作「酸式」鹽[1]。但實際上,只有強酸(如硫酸)及少部分中強酸(如磷酸)的酸式鹽呈酸性,大多數弱酸的酸式鹽都因陰離子的水解而顯鹼性。
要注意的是,酸式鹽在以離子晶體形式存在時,陰離子並不電離出氫離子,氫離子是酸式酸根離子的一部分。在熔融狀態下,酸根離子也不電離。
- 鹼式鹽:
鹼式鹽是鹽類的一種,除了含有金屬離子和酸根離子外,還含有氫氧根或氧離子的鹽類;也可認為是鹼的氫氧根沒有被酸完全中和所得的產物。 含羥基的鹼式鹽又稱為羥基鹽,可視為金屬離子、氫氧根及陰離子合成的鹽類,如鹼式碳酸銅(Cu2(OH)2CO3)、鹼式氯化鎂(Mg(OH)Cl)等為羥基鹽。
含氧基的鹼式鹽稱為氧化鹽,可視為金屬離子、氧離子(O2-)及陰離子合成的鹽類。如鹼式碳酸鉍(Bi2O2(CO3))即為氧化鹽。
合鹽
- 復鹽:
復鹽是指含有兩種或以上的同種晶型的簡單鹽類[1],屬於化合物,溶於水會離解出所有的離子。復鹽通常可由混合這兩種鹽飽和溶液並結晶而製得。在自然界中廣泛存在,如明礬就是天然而有廣泛應用的復鹽。
屬性
顏色
鹽的顏色可以是純潔透明的(如氯化鈉)、不透明的或者是帶有金屬光澤的(如黃鐵礦)。大多數情況下鹽表面的透明或不透明只和構成該鹽的單晶體有關。當光線照射到鹽上時,就會被晶界(晶體之間的邊界)反射回來,大的晶體就會呈現出透明狀,多晶體聚集在一起則會看起來更像白色粉末一樣。
鹽有許多顏色,例如:
大部分礦物質、無機色素以及很多人工合成的有機染料都是鹽,有一些鹽能夠呈現出其它顏色是過渡元素的d軌道存在未成對電子導致的。
味道
不同的鹽可以激發不同的味覺,例如鹹味(氯化鈉)、甜味(乙酸鉛[2],若食用會導致鉛中毒)、酸味(酒石酸氫鉀)、苦味(硫酸鎂)或鮮味(谷氨酸鈉)[3]。
氣味
強酸或強鹼鹽(強鹽)是不可揮發的,且沒有氣味。而弱酸或弱鹼鹽(弱鹽)則會根據共軛酸鹼對而產生不同的氣味(例如醋酸鹽則會有醋酸的味道,氰化氫則會有苦杏仁味等),此外弱酸或弱鹼鹽還會揮發和分解,並且由於水解反應和弱鹽合成的反應是可逆反應,因此當有水分存在時會加速弱鹽的分解。
溶解度
許多離子化合物都可以溶解在水或是類似的溶劑中,化合物的溶解度和組成的陰離子和陽離子以及溶劑都有關,因此有一特定的關係。陽離子當中,所有鈉離子、鉀離子及銨離子的鹽均可溶於水;而陰離子中,硝酸鹽離子及碳酸氫鹽離子的鹽類可在水中溶解。除了硫酸鋇、硫酸鈣及硫酸鉛外,大部份的硫酸鹽離子的鹽類也都可以溶於水。不過若離子之間的鍵結很強,產生高度穩定的固體,在水中也就不易溶解,例如大部份的碳酸鹽就不溶於水,例如碳酸鉛及碳酸鋇等。
系統命名法
一般而言,無氧酸鹽的名字是非金屬元素名稱在前,金屬元素名稱在後,兩者名字之間添加「化」,稱為「某化某」。如果是含氧酸鹽,則鹽的名稱為酸的名稱後面之間添加元素名稱,稱為「某酸某」。如果某種金屬元素有多個化合價,那麼低化合價形成的鹽的名稱是在金屬元素名稱前添加「亞」,例如銅元素的氯化物中,如果銅的化合價為+2價,那麼形成的鹽CuCl2稱為「氯化銅」,如果化合價為+1價,形成的鹽CuCl稱為「氯化亞銅」。
含有相同陽離子或陰離子的一類鹽一般都會統稱為「某鹽」,例如「鈉鹽」、「硫酸鹽」等。
常見的形成鹽類的陽離子包括:
常見的形成鹽類的陰離子包括:
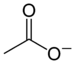
- 乙酸根CH3COO−(乙酸)
- 碳酸根CO32−(碳酸)
- 氯離子Cl−(鹽酸)
- 氰化物C≡N−(氰化氫)
- 硝酸根NO3−(硝酸)
- 亞硝酸根NO2−(亞硝酸)
- 磷酸根PO43−(磷酸)
- 硫酸根SO42−(硫酸)
有機離子的鹽類
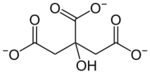
一般鹽類會歸類為無機化合物,但也有一些有機化合物的鹽類,例如有機酸的鹽類就是有機化合物。其中較重要的是羧酸鹽,例如乙酸根CH3COO−和鈉離子Na+會形成乙酸鈉,和銅離子Na+會形成乙酸銅。乙酸只有一個COOH基,只帶-1價,檸檬酸有三個COOH基,帶-3價,形成的鹽類有檸檬酸鈉和檸檬酸鈣根,乙酸鹽和檸檬酸鹽的陰離子和陽離子都以離子鍵鍵結,不像一般有機化合物以間用共價鍵鍵結,因此稱為鹽類。
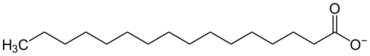
這些鹽類中較常用的是羧酸鹽,其中也包括脂肪酸鹽。像肥皂就是由許多不同分子量脂肪酸鈉及脂肪酸鉀的混合物。這類長鏈脂肪酸的鹽類就沒有晶體的結構。
類似硫酸根SO42−的磺酸根R-O-SO3−也是有機酸根的一種,磺酸鹽是洗髮精及沐浴乳中常見的表面活性劑。醇類的酸性很弱,一般不會稱為酸,不過其羥基氫被金屬取代後會形成醇鹽。醇鹽在水中會水解,產生對應的醇類,以下是醇鹽和金屬鹼酐水解反應的比較。
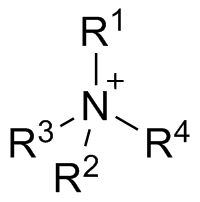
也有些有機的陽離子會形成鹽類,例如類似銨根離子(NH4+)的季銨陽離子,季銨陽離子是由一個氮原子和四個烷基(R-)組成,帶一個正電荷。例如溴化十六烷基三甲銨中,十六烷基三甲銨離子是陽離子,和陰離子溴離子形成鹽類。實用的季銨鹽類也有類似的結構,季銨陽離子中只有一個長鏈的烷基,當溶於水中,陽離子有表面活性劑的作用。這類物質在生物體新陳代謝中有重要的作用,例如維生素B中的膽鹼就是季銨鹽類。
在氨分子(NH3)中加入一個氫離子(H+)就變成銨離子(NH4+),同樣的在有機胺中加入一個氫離子就變成陽離子。例如一級胺(R-NH2H,R為烷基)加入一個氫離子就變成陽離子(R-NH3+)這類的化合物比原來的化合物極性要強,因此在水中的溶解度比原來的化合物要高。例如一些含氮的藥物會和鹽酸反應來產生鹽酸胺類化合物,人體對於這類化合物的吸收度比原來的含氮藥物要好。也有些藥物是和溴化氫或氟化氫反應成類似的藥物。
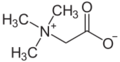
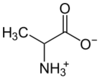
內鹽也稱為兩性離子,是一種特殊的化合物,化合物中同時有帶正電及帶負電的原子,但是帶正電和負電的原子不同(在一些定義中限定是未具有相鄰正負電荷的化合物)[4],像許多胺基酸都屬於內鹽。若胺基酸中包含羧基(-COO−)和一個胺基(-NH3+),就是內鹽,會在不同的反應中呈酸性或是鹼性。不過內鹽和一般電解質不同,溶於水中只有微弱的導電性(兩性物質)。
有機陰離子和陽離子的例子
| 有機化合物的陰離子 | ||
| 分類 | 舉例 | 結構 |
|---|---|---|
| 羧酸根 | 乙酸根 | |
| 棕櫚酸根 | ||
| 檸檬酸 | ||
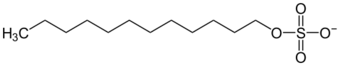
| 有機硫化物 | 十二烷基硫酸根 | |
| 乙醇鹽 | ||
| 有機化合物的陽離子 | ||
| 分類 | 舉例 | 結構 |
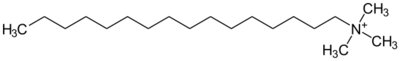
| 季銨陽離子 | 溴化十六烷基三甲銨 | |
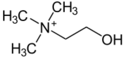
| 膽鹼 | ||
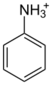
| 胺類 | 苯胺鹽類 | |
| 有機化合物的內鹽 | ||
| 分類 | 舉例 | 結構 |
| Betaine | 甜菜鹼 | |
| 胺基酸 | 丙胺酸 | |
製備
鹽可以通過化學反應而製備,包括有:
- 鹽基與酸,例如NH3 + HCl → NH4Cl
- 金屬與酸,例如Mg + H2SO4 → MgSO4 + H2
- 金屬與非金屬,例如Ca + Cl2 → CaCl2
- 鹼與酸性氧化物,例如2 NaOH + Cl2O → 2 NaClO + H2O
- 酸與鹼性氧化物,例如2 HNO3 + Na2O → 2 NaNO3 + H2O
- 鹽也可以由不同的鹽溶液混合,其中的離子發生重組,形成溶解度較低的鹽(另見:溶解平衡),例如Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)
鹽的性質
在化學上,鹽是由陽離子(正電荷離子)與陰離子(負電荷離子)所組成之中性(不帶電荷)離子化合物。
- 鹼(可溶)+鹽(可溶)→新鹼+新鹽
- 2NaOH+CuSO4→Cu(OH)2↓+Na2SO4
- 和鹽發生反應。複分解反應。
- 鹽(可溶)+鹽(可溶)→兩種新鹽
- CuSO4+BaCl2→BaSO4↓+CuCl2
- 和某些金屬反應。置換反應
- 鹽+金屬(某些)→新金屬+新鹽 反應中的金屬一定要比鹽中的金屬活潑才可以把它給置換出來。請看金屬活動性。
- Zn+CuSO4→ZnSO4+Cu
參見
參考資料
- ↑ 1.0 1.1 1.2 魏明通. 普通化學. 五南圖書出版股份有限公司. 2006: pp. 24–. ISBN 978-957-11-4349-1.
- ↑ Nicholas Wade. 地球身世之謎. 知書房出版集團. 2004: pp. p.159. ISBN 9578320477.
- ↑ Y. Kawamura and M.R. Kare. 鮮味,基本味道. New York,NJ: Marcel Dekker. 1987.
- ↑ 國際純粹與應用化學聯合會."zwitterionic compounds/zwitterions".化學術語總目錄 在線版本.
參考來源
| 關於「鹽類」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |