原子
| A+醫學百科 >> 原子 |
| 原子 | ||||||||
|---|---|---|---|---|---|---|---|---|
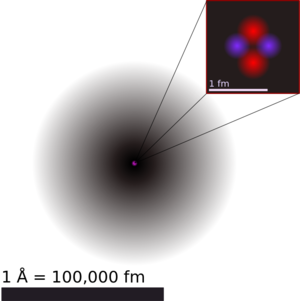
| 氦原子結構示意圖。圖中灰階顯示對應電子雲於1s原子軌域之機率密度函數的積分強度。而原子核僅為示意,質子以粉紅色、中子以紫色表示。事實上,原子核(與其中之核子的波函數)也是球型對稱的。(對於更複雜的原子核則非如此) | ||||||||
| 分類 | ||||||||
|
||||||||
| 性質 | ||||||||
|
原子是一種元素能保持其化學性質的最小單位。一個正原子包含有一個緻密的原子核及若干圍繞在原子核周圍帶負電的電子。而負原子的原子核帶負電,周圍的負電子帶正電。正原子的原子核由帶正電的質子和電中性的中子組成。負原子原子核中的反質子帶負電,從而使負原子的原子核帶負電。當質子數與電子數相同時,這個原子就是電中性的;否則,就是帶有正電荷或者負電荷的離子。根據質子和中子數量的不同,原子的類型也不同:質子數決定了該原子屬於哪一種元素,而中子數則確定了該原子是此元素的哪一個同位素。
原子的英文名(Atom)是從希臘語ἄτομος(atomos,「不可切分的」)轉化而來。很早以前,希臘和印度的哲學家就提出了原子的不可切分的概念。17和18世紀時,化學家發現了物理學的根據:對於某些物質,不能通過化學手段將其繼續的分解。19世紀晚期和20世紀早期,物理學家發現了亞原子粒子以及原子的內部結構,由此證明原子並不是不能進一步切分。量子力學原理能夠為原子提供很好的模型。[2][3]
與日常體驗相比,原子是一個極小的物體,其質量也很微小,以至於只能通過一些特殊的儀器才能觀測到單個的原子,例如掃描隧道顯微鏡。原子的99.9%的重量集中在原子核,[4]其中的質子和中子有著相近的質量。每一種元素至少有一種不穩定的同位素,可以進行放射性衰變。這直接導致核轉化,即原子核中的中子數或質子數發生變化。[5]電子佔據一組穩定的能級,或者稱為軌道。當它們吸收和放出光子的時候,電子也可以在不同能級之間跳躍,此時吸收或放出光子的能量與能級之間的能量差相等。電子決定了一個元素的化學屬性,並且對原子的磁性有著很大的影響。
目錄 |
歷史
大約在兩千五百年前,希臘哲學家對物質的組成問題爭論不休。原子派認為物質在被無數次地分割之後,最終會小到無法分割。原子(atom)一詞源自希臘語,意思是『不可分割』。在1803年到1807年之間,英國化學家道耳頓發展了這些觀點並將它用在它的原子學說中。他相信原子既不能被創造也不能被消滅。任何一個元素里所含的原子都是一樣的。
關於物質是由離散單元組成且能夠被任意的分割的概念流傳了幾千年,但這些想法只是基於抽象的、哲學的推理,而非實驗和實證觀察。隨著時間的推移以及文化及學派的轉變,哲學上原子的性質也有著很大的改變而這種改變往往還帶有一些精神因素。儘管如此,對於原子的基本概念在數千年後仍然被化學家們採用,因為它能夠很簡潔地闡述一些化學界的新發現。[6]
原子論
原子論(英語:Atomism,來自古希臘語atomos,含義為「不可分割」)是在一些古代傳統中發展出的一種自然哲學。原子論者將自然世界理論化為由兩基本部分所構成:不可分割的原子和空無的虛空(void)。
依據亞里士多德引述,原子是不可構造的和永恆不變的,並且形狀和大小有無窮的變化。它們在空無(empty)中移動,相互碰離,有時變成與一個或多個其他原子相鉤結而形成聚簇(cluster)。不同形狀、排列和位置的聚簇引起世界上各種宏觀物質(substance)。
對原子概念的記述可以上溯到古印度和古希臘。有人將印度的耆那教的原子論認定為開創者大雄在公元前6世紀提出,並將與其同時代的彼浮陀伽旃延和順世派先驅阿夷陀翅舍欽婆羅的元素思想也稱為原子論。正理派和勝論派後來發展出了原子如何組合成更複雜物體的理論。在西方,對原子的記述出現在公元前5世紀留基伯和德謨克利特的著作中。對於印度文化影響希臘還是反之,亦或二者獨立演化是存在爭議的。
科學理論
直到化學作為一門科學開始發展的時候,對原子才有了更進一步的理解。1661年,自然哲學家羅伯特·波義耳出版了《懷疑的化學家》一書,書中他聲稱物質是由不同的「微粒」或原子自由組合構成的,而並不是由諸如氣、土、火、水等基本元素構成。[7]1789年,既是法國貴族,又是科學研究者的拉瓦錫定義了元素一詞,從此,元素就用來表示化學變化中的最小的單位。[8]
現代原子理論
道耳頓的理想沒有涉及原子內部結構。隨後,在1897年,第一個亞原子粒子--電子,被發現。1911年,英國物理學家盧瑟福發現每一個原子都含有一個比重很大並且帶正電的原子核。1932年中子又被發現。現代化學認為原子由原子核及繞核旋轉的電子構成。原子核中含有許多質子和中子。質子和中子要比電子重一千八百多倍。質子的帶電量是一個單位的正電荷,電子是一個單位的負電荷,中子不帶電。
1803年,英語教師及自然哲學家約翰·道爾頓用原子的概念解釋了為什麼不同元素總是呈整數倍反應,即倍比定律;也解釋了為什麼某些氣體比另外一些更容易溶於水。他提出每一種元素只包含唯一一種原子,而這些原子相互結合起來就形成了化合物。[9][10]
1827年,英國植物學家羅伯特·布朗在使用顯微鏡觀察水面上灰塵的時候,發現它們進行著不規則運動,進一步證明了微粒學說。後來,這一現象被稱為為布朗運動。德紹兒克思在1877年提出這種現象是由於水分子的熱運動而導致的。1905年,愛因斯坦提出了第一個數學分析的方法,證明了這個猜想。[11][12][13]
在關於陰極射線的工作中,物理學家約瑟夫·湯姆孫發現了電子以及它的亞原子特性,粉碎了一直以來認為原子不可再分的設想。[14]湯姆孫認為電子是平均的分布在整個原子上的,就如同散布在一個均勻的正電荷的海洋之中,它們的負電荷與那些正電荷相互抵消。這也叫做梅子布丁模型。
然而,在1909年,在物理學家盧瑟福的指導下,研究者們用氦離子轟擊金箔。他們意外的發現有很小一部分離子的偏轉角度遠遠大於使用湯姆孫假設所預測值。盧瑟福根據這個金箔實驗的結果提出原子中大部分質量和正電荷都集中在位於原子中心的原子核當中,電子則像行星圍繞太陽一樣圍繞著原子核。帶正電的氦離子在穿越原子核附近時,就會被大角度的反射。[15]
1913年,在進行有關對放射性衰變產物的實驗中,放射化學家弗雷德里克·索迪發現對於元素周期表中的每個位置,不僅僅只有一種原子。[16] 瑪格麗特·陶德創造了同位素一詞,來表示同一種元素中不同種類的原子。在進行關於離子氣體的研究過程中,湯姆孫發明了一種新技術,可以用來分離不同的同位素,最終導致了穩定同位素的發現。[17]
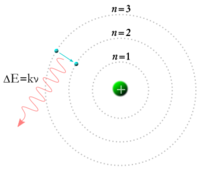
與此同時,物理學家玻爾重新審視了盧瑟福的模型,他認為電子應該位於確定的軌道之中,並且能夠在不同軌道之間跳躍,而不是像先前認為那樣可以自由的向內或向外移動。電子在這些固定軌道間跳躍時,必須吸收或者釋放特定的能量。[18]當熱源產生的一束光穿過稜鏡時,能夠產生一個多彩的光譜。應用軌道躍遷的理論就能夠很好的解釋光譜中存在的位置不變的線條。[19]
1916年,路易士發現化學鍵的本質就是兩個原子間電子的相互作用。[20]眾所周之,元素的化學性質按照周期律反覆的循環。[21]1919年,美國化學家歐文·朗繆爾提出原子中的電子以某種性質相互連接或者說相互聚集。一組電子佔有一個特定的電子層。[22]
1926年,薛丁格使用路易·德布羅意於1924年提出的波粒二象性的假說,建立了一個原子的數學模型,用來將電子描述為一個三維波形。使用波形來描述電子的一個直接後果就是在數學上不能夠同時得到位置和動量的精確值,1926年,海森堡建立了相關的方程,這也就是後來著名的不確定性原理。這個概念描述的是,對於測量的某個位置,只能得到一個不確定的動量範圍,反之亦然。儘管這個模型很難想像,但它能夠解釋一些以前觀測到卻不能解釋的原子的性質,例如比氫更大的原子的譜線。因此,人們不再使用原子的行星模型,而更傾向於將原子軌道視為電子存在機率的區域。[23][24]
質譜的發明使得科學家可以直接測量原子的準確質量。該設備通過使用一個磁體來彎曲一束離子,而偏轉量取決於原子的質荷比。弗朗西斯·阿斯頓使用質譜證實了同位素有著不同的質量,並且同位素間的質量差都為一個整數,這被稱為整數規則。[25]1932年,詹姆斯·查德威克發現了中子,解釋了這一個問題。中子是一種中性的粒子,質量與質子相仿。同位素則被重新定義為有著相同質子數與不同中子數的元素。[26]
1950年代,隨著粒子加速器及粒子探測器的發展,科學家們可以研究高能粒子間的碰撞。[27]他們發現中子和質子是強子的一種,由更小的夸克微粒構成。核物理的標準模型也隨之發展,能夠成功的在亞原子水平解釋整個原子核以及亞原子粒子之間的相互作用。[28]
1985年左右,朱棣文及其同事在貝爾實驗室開發了一種新技術,能夠使用雷射來冷卻原子。威廉·丹尼爾·菲利普斯團隊設法將鈉原子置於一個磁阱中。這兩個技術加上由克洛德·科昂-唐努德日團隊基於都卜勒效應開發的一種方法,可以將少量的原子冷卻至微開爾文的溫度範圍,這樣就可以對原子進行很高精度的研究,這也直接導致了玻色-愛因斯坦凝聚的發現。[29]
歷史上,因為單個原子過於微小,被認為不能夠進行科學研究。最近,科學家已經成功使用一單個金屬原子與一個有機配體連接形成一個單電子電晶體。[30]在一些實驗中,通過雷射冷卻的方法將原子減速並捕獲,這些實驗能夠帶來對於物質更好的理解。[31]
原子的組成
亞原子粒子
儘管原子的英文名稱(atom)本意是不能被進一步分割的最小粒子,但是在現代科學領域,原子實際上包含了很多不同的亞原子粒子。它們分別是電子,質子和中子。氫原子和帶一個正電荷的氫離子例外,前者沒有中子,後者只有一個質子。
質子帶有一個正電荷,質量是電子質量的1836倍,為1.6726×10−27kg,然而部分質量可以轉化為原子結合能。中子不帶電荷,自由中子的質量是電子質量的1839倍,為1.6929×10−27kg。[32]中子和質子的尺寸相仿,均在2.5×10−15m這一數量級,但它們的表面並沒能精確定義。[33]
在物理學標準模型理論中,質子和中子都由名叫夸克的基本粒子構成。夸克是費米子的一種,也是構成物質的兩個基本組分之一。另外一個基本組份被稱作是輕子,電子就是輕子的一種。夸克共有六種,每一種都帶有分數的電荷,不是+2/3就是-1/3。質子就是由兩個上夸克和一個下夸克組成,而中子則是由一個上夸克和兩個下夸克組成。這個區別就解釋了為什麼中子和質子電荷和質量均有差別。夸克由強相互作用結合在一起的,由膠子作為中介。膠子是規範玻色子的一員,是一種用來傳遞力的基本粒子。[34][35]
原子核
原子中所有的質子和中子結合起來就形成了一個很小的原子核,它們一起也可以被稱為核子。原子核的半徑約等於![\begin{smallmatrix}1.07 \cdot \sqrt[3]{A}\end{smallmatrix}](/images/math/4/8/f/48f98c98c376d8dadf6893065ae83c45.png) fm其中A是核子的總數。[36]原子半徑的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。核子被能在短距離上起作用的殘留強力束縛在一起。當距離小於2.5fm的時候,強力遠遠大於靜電力,因此它能夠克服帶正電的質子間的相互排斥。[37]
fm其中A是核子的總數。[36]原子半徑的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。核子被能在短距離上起作用的殘留強力束縛在一起。當距離小於2.5fm的時候,強力遠遠大於靜電力,因此它能夠克服帶正電的質子間的相互排斥。[37]
同種元素的原子帶有相同數量的質子,這個數也被稱作原子序數。而對於某種特定的元素,中子數是可以變化的,這也就決定了該原子是這種元素的哪一種同位素。質子數量和中子數量決定了該原子是這種元素的哪一種核素。中子數決定了該原子的穩定程度,一些同位素能夠自發進行放射性衰變。[38]
中子和質子都是費米子的一種,根據量子力學中的泡利不相容原理,不可能有完全相同的兩個費米子同時擁有一樣量子物理態。因此,原子核中的每一個質子都佔用不同的能級,中子的情況也與此相同。不過泡利不相容原理並沒有禁止一個質子和一個中子擁有相同的量子態。[39]
如果一個原子核的質子數和中子數不相同,那麼該原子核很容易發生放射性衰變到一個更低的能級,並且使得質子數和中子數更加相近。因此,質子數和中子數相同或很相近的原子更加不容易衰變。然而,當原子序數逐漸增加時,因為質子之間的排斥力增強,需要更多的中子來使整個原子核變的穩定,所以對上述趨勢有所影響。因此,當原子序數大於20時,就不能找到一個質子數與中子數相等而又穩定的原子核了。隨著Z的增加,中子和質子的比例逐漸趨於1.5。[39]
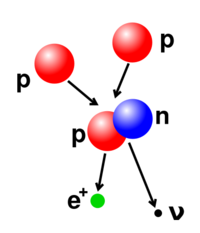
原子核中的質子數和中子數也是可以變化的,不過因為它們之間的力很強,所以需要很高的能量,當多個粒子聚集形成更重的原子核時,就會發生核聚變,例如兩個核之間的高能碰撞。在太陽的核心,質子需要3-10KeV的能量才能夠克服它們之間的相互排斥,也就是庫侖障壁,進而融合起來形成一個新的核。[40]與此相反的過程是核裂變,在核裂變中,一個核通常是經過放射性衰變,分裂成為兩個更小的核。使用高能的亞原子粒子或光子轟擊也能夠改變原子核。如果在一個過程中,原子核中質子數發生了變化,則此原子就變成了另外一種元素的原子了。[41][42]
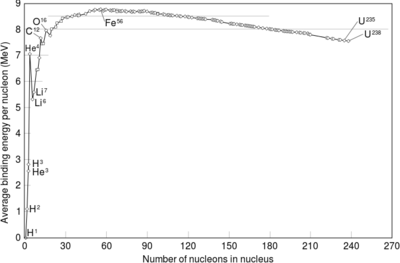
如果核聚變後產生的原子核質量小於聚變前原子質量的總和,那麼根據愛因斯坦的質能方程,這一些質量的差就作為能量被釋放了。這個差別實際是原子核之間的結合能。[43]
對於兩個原子序數在鐵或鎳之前的原子核來說,它們之間的核聚變是一個放熱過程,也就是說過程釋放的能量大於將它們連在一起的能量。[44]正是因為如此,才確保了恆星中的核聚變能夠自我維持。對於更重一些的原子來說,結合能開始減少,也就是說它們的核聚變會是一個吸熱過程。因此,這些更重的原子不能夠進行產能的核聚變,也就不能夠維持恆星的流體靜力平衡。[39]
電子云
在一個原子中,電子和質子因為電磁力而相互吸引,也正是這個力將電子束縛在一個環繞著原子核的靜電位勢阱中,要從這個勢阱中逃逸則需要外部的能量。電子離原子核越近,吸引力則越大。因此,與外層電子相比,離核近的電子需要更多能量才能夠逃逸。
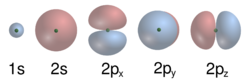
原子軌道則是一個描述了電子在核內的機率分布的數學方程。在實際中,只有一組離散的(或量子化的)軌道存在,其他可能的形式會很快的坍塌成一個更穩定的形式。[45]這些軌道可以有一個或多個的環或節點,並且它們的大小,形狀和空間方向都有不同。[46]
每一個原子軌道都對應一個電子的能級。電子可以通過吸收一個帶有足夠能量的光子而躍遷到一個更高的能級。同樣的,通過自發輻射,在高能級態的電子也可以躍遷回一個低能級態,釋放出光子。這些典型的能量,也就是不同量子態之間的能量差,可以用來解釋原子譜線。[45]
在原子核中除去或增加一個電子所需要的能量遠遠小於核子的結合能,這些能量被稱為電子結合能。例如:奪去氫原子中基態電子只需要13.6eV。[47]當電子數與質子數相等時,原子是電中性的。如果電子數大於或小於質子數時,該原子就會被稱為離子。原子最外層電子可以移動至相鄰的原子,也可以由兩個原子所共有。正是由於有了這種機理,原子才能夠鍵合形成分子或其他種類的化合物,例如離子或共價的網狀晶體。[48]
性質
核性質
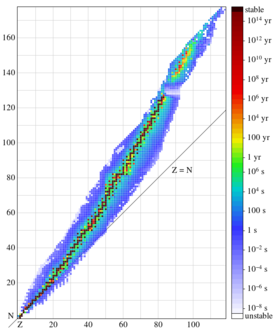
根據定義,任意兩個有著相同質子數的原子屬於同一種元素,而有著相同質子數和不同中子數的則是同一種元素中不同的同位素。例如,所有的氫原子都只有一個質子,但氫原子的同位素有幾種,分別含有零個中子(氫-1,目前最常見的類型,有時也被稱為氕),一個中子(氘),兩個中子(氚)以及更多的中子。[49]原子序數從1(氫)到118(Uuo)均為已知元素。[50]對於所有原子序數大於82的同位素都有放射性。[51][52]
地球上自然存在約339種核素,其中255種是穩定的,約佔總數79%。[53]80種元素含有一個或一個以上的穩定同位素。第43號元素、第61號元素及所有原子序數大於等於83的元素沒有穩定的同位素。有十六種元素只含有一個穩定的同位素,而擁有同位素最多的元素,錫,則有十個同位素。[54]
同位素的穩定性不只受到質子數與中子數之比的影響,也受到所謂幻數的影響,實際上幻數就代表了全滿的量子層。這些量子層對應於原子核層模型中一組能級。在已知的269種穩定核素中,只有四個核素同時有著奇數個質子和奇數個中子。它們分別是:2H, 6Li, 10B和14N;對於放射性核素來說,也只有四種奇-奇核素的半衰期超過了一億年:40K, 50V, 138La和180mTa。這是因為對於大多數奇-奇核素來說,很容易會發生β衰變,產生的更穩定的偶-偶核素。[54]
質量
因為原子質量的絕大部分是質子和中子的質量,所以質子和中子數量的總和叫做質量數。原子的靜止質量通常用統一原子質量單位(u)來表示,也被稱作道爾頓(Da)。這個單位被定義為電中性的碳12質量的十二分之一,約為1.6605565x10^-27千克。[55]氫最輕的一個同位素氕是最輕的原子,重量約為1.007825u。[56]一個原子的質量約是質量數與原子質量單位的乘積。[57]最重的穩定原子是鉛-208,[51]質量為207.9766521u。[58] 就算是最重的原子,化學家也很難直接對其進行操作,所以它們通常使用另外一個單位,摩爾。摩爾的定義是對於任意一種元素,一摩爾總是含有同樣數量的原子,約為6.022×1023。因此,如果一個元素的原子質量為1u,一摩爾該原子的質量就為0.001kg,也就是1克。例如,碳的原子質量是12u,一摩爾碳的質量則是0.012kg。[55]
大小
原子並沒有一個精確定義的最外層,只有當兩個原子形成化學鍵後,通過測量兩個原子核間的距離,才能夠得到原子半徑的一個近似值。影響原子半徑的因素很多,包括在元素周期表上的位置,化學鍵的類型,周圍的原子數(配位數)以及自旋。[59]在元素周期表中,原子的半徑變化的大體趨勢是自上而下增加,而從左至右減少。[60]因此,最小的原子是氦,半徑為32pm;最大的原子是銫,半徑為225pm。[61]因為這樣的尺寸遠遠小於可見光的波長(約400-700nm),所以不能夠通過光學顯微鏡來觀測它們。然而,使用掃描隧道顯微鏡我們能夠觀察到單個原子。
這裡可以用一些實例來演示原子究竟有多小。一根人的頭髮的寬度大約是一百萬個原子。[62]一滴水則大約有二十米(2×1021)個氧原子以及兩倍的氫原子。[63]一克拉鑽石重量為2×10-4kg,含有約100垓個碳原子。[64]如果蘋果被放大到地球的大小,那麼蘋果中的原子大約就有原來蘋果那麼大了。[65]
放射性
每一種元素都有一個或多個同位素擁有不穩定的原子核,從而能發生放射性衰變,在這個過程中,原子核可以釋放出粒子或電磁輻射。當原子核的半徑大於強力的作用半徑時,放射性衰變就可能發生,而強力的作用半徑僅為幾飛米。[66]
- α衰變:原子核釋放一個α粒子,即含有兩個質子和兩個中子的氦原子核。衰變的結果是產生一個原子序數低一些的新元素。
- β衰變:弱相互作用的現象,過程中一個中子轉變成一個質子或者一個質子轉變成一個中子。前者伴隨著一個電子和一個反中微子的釋放,後者則釋放一個正電子和一個中微子。所釋放的電子或正電子被叫做β粒子。因此,β衰變能夠使得該原子的原子序數增加或減少一。
- γ衰變:原子核的能級降低,釋放出電磁波輻射,通常在釋放了α粒子或β粒子後發生。
其它比較罕見的放射性衰變還包括:釋放中子或質子,釋放核子團或電子團,通過內轉換產生高速的電子而非β射線以及高能的光子而非伽馬射線。
每一個放射性同位素都有一個特徵衰變期間,即半衰期。半衰期就是一半樣品發生衰變所需要的時間。這是一種指數衰變,即樣品在每一個半衰期內恆定的衰變50%,換句話說,當兩次半衰期之後,就只剩下25%的起始同位素了。[66]
磁矩
基本微粒都有一個固有性質,就像在宏觀物理中圍繞質心旋轉的物體都有角動量一樣,在量子力學中被叫做自旋。但是嚴格來說,這些微粒僅僅是一些點,不能夠旋轉。自旋的單位是約化普朗克常數(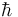 ),電子、質子和中子的自旋都是½
),電子、質子和中子的自旋都是½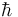 。在原子里,電子圍繞原子核運動,所以除了自旋,它們還有軌道角動量。而對於原子核來說,軌道角動量是起源於自身的自旋。[69]
。在原子里,電子圍繞原子核運動,所以除了自旋,它們還有軌道角動量。而對於原子核來說,軌道角動量是起源於自身的自旋。[69]
正如一個旋轉的帶電物體能夠產生磁場一樣,一個原子所產生的磁場,即它的磁矩,就是由這些不同的角動量決定的。然後,自旋對它的影響應該是最大的。因為電子的一個性質就是要符合泡利不相容原理,即不能有兩個位於同樣量子態的電子,所以當電子成對時,總是一個自旋朝上而另外一個自旋朝下。這樣,它們產生的磁場相互抵消。對於某些帶有偶數個電子的原子,總的磁偶極矩會被減少至零。[70]
對於鐵磁性的元素,例如鐵,因為電子總數為奇數,所以會產生一個淨磁矩。同時,因為相鄰原子軌道重疊等原因,當未成對電子都朝向同一個方向時,體系的總能量最低,這個過程被稱為交換相互作用。當這些鐵磁性元素的磁動量都統一朝向後,整個材料就會擁有一個宏觀可以測量的磁場。順磁性材料中,在沒有外部磁場的情況下,原子磁矩都是隨機分布的;施加了外部磁場以後,所有原子都會統一朝向,產生磁場。[71][70]
原子核也可以存在淨自旋。由於熱平衡,通常這些原子核都是隨機朝向的。但對於一些特定元素,例如氙-129,一部分核自旋也是可能被極化的,這個狀態被叫做超極化,在核磁共振成像中有很重要的應用。[72][73]
能級
原子中,電子的勢能與它離原子核的距離成反比。測量電子的勢能,通常的測量將讓該電子脫離原子所需要的能量,單位是電子伏特(eV)。在量子力學模型中,電子只能佔據一組以原子核為中心的狀態,每一個狀態就對應於一個能級。最低的能級就被叫做基態,而更高的能級就被叫做激發態。[74]
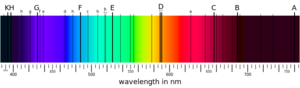
電子要在兩個能級之間躍遷的前提是它要吸收或者釋放能量,該能量還必須要和這兩個能級之間的能量差一致。因為釋放的光子能量只與光子的頻率有關,並且能級是不連續的,所以在電磁波譜中就會出現一些不連續的帶。[75]每一個元素都有一個特徵波譜,特徵波譜取決於核電荷的多少,電子的填充情況,電子間的電磁相互作用以及一些其他的因素。[76]
當一束全譜的光經過一團氣體或者一團電漿體後,一些光子會被原子吸收,使得這些原子內的電子躍遷。而在激發態的電子則會自發的返回低能態,能量差作為光子被釋放至一個隨機的方向。前者就使那些原子有了類似於濾鏡的功能,觀測者在最後接收到的光譜中會發現一些黑色的吸收能帶。而後者能夠使那些與光線不在同一條直線上的觀察者觀察到一些不連續的譜線,實際就是那些原子的發射譜線。對這些譜線進行光譜學測量就能夠知道該物質的組成以及物理性質。[77]
在對譜線進行了細緻的分析後,科學家發現一些譜線有著精細結構的裂分。這是因為自旋與最外層電子運動間的相互作用,也被稱作自旋-軌道耦合。[78]當原子位於外部磁場中時,譜線能夠裂分成三個或多個部分,這個現象被叫做塞曼效應,其原因是原子的磁矩及其電子與外部磁場的相互作用。一些原子擁有許多相同能級電子排布,因而只產生一條譜線。當這些原子被安置在外部磁場中時,這幾種電子排布的能級就有了一些細小的區別,這樣就出現了裂分。[79]外部電場的存在也能導致類似的現象發生,被成為斯塔克效應。[80]
如果一個電子在激發態,一個有著恰當能量的光子能夠使得該電子受激輻射,釋放出一個擁有相同能量的光子,其前提就是電子返回低能級所釋放出來的能量必須要與與之作用的光子的能量一致。此時,受激釋放的光子與原光子向同一個方向運動,也就是說這兩個光子的波是同步的。利用這個原理,人們設計出了雷射,用來產生一束擁有很窄頻率相干光源。[81]
化合價
單個原子的電子層最外層一般被稱為價層,其中的電子被稱為價電子。價電子的個數決定了這個原子與其他原子成鍵的性質。原子能發生化學反應的一個統一的趨勢是使得其價層全滿或者全空。[82]
化學元素通常被寫在一個化學周期表中,用來表明它們有周期重複的一些化學性質。通常,擁有相同數量價電子的元素形成一組,在元素周期表中占相同的一列。而元素周期表中的橫排則與量子層的電子填充情況相對應。周期表最右邊的元素價層都是全滿的,因此它們在化學反應中表現出一定的惰性,被成為惰性氣體。[83][84]
態
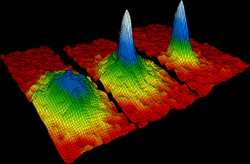
物質很多不同的相態之中都存在原子,這些相態都由一定的物理條件所決定,例如溫度與壓強。通過改變這些條件,物質可以在固體、液體、氣體與電漿體之間轉換。[85]在同一種相態中,物質也可以有不同的形態,例如固態的碳就有石墨和金剛石兩種形態。[86]
當溫度很靠近絕對零度時,原子可以形成玻色-愛因斯坦凝聚態。[87][88]這些超冷的原子可以被視為一個超原子,使得科學家可以研究量子力學的一些基本原理。[89]
鑒定

掃描隧道顯微鏡是用來在原子水平觀測物體表面的一種儀器。它利用了量子穿隧效應,使得電子能夠穿越一些平時不能夠克服的障礙。在操作中,電子能夠隧穿介於兩個平面金屬電極之間的真空。每一個電極表面吸附有一個原子,使得穿隧電流密度大到可以測量。保持電流恆定,隨著掃描的進行,可以得到一個探針末端的上下位移與橫向位移之間的關係圖。計算證明掃描隧道顯微鏡所得到的顯微圖像能夠分辨出單個原子。在低偏差的情況下,顯微圖像顯示的是對相近能級的電子軌道的一種空間平均後的尺寸,這些相近的能級也就是費米能中的局部態密度。[90][91]
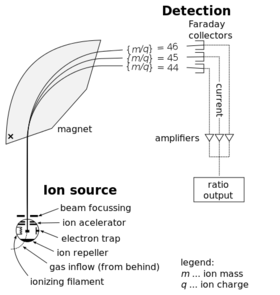
當原子失去一個電子時,該原子就被電離了。這一個多餘的電荷就使其在磁場中運行的軌跡發生偏折。這個偏轉角度是由原子的質量所決定的。質譜儀就利用了這個原理來測定離子的質荷比。如果一個樣品裡面有多種同位素,質譜可以通過測量不同離子束的強度來推導每一種同位素的比例。使原子氣化的技術包括電感耦合電漿體發射光譜以及電感耦合電漿體質譜。這兩種技術都使用了氣態或電漿態的樣品。[92]
另外一個有局限性的方法是電子能量損失譜,它是通過測量透射電子顯微鏡中電子束穿越一個樣品後所損失的能量。原子探針顯像具有三維亞奈米級的解析度,也可以通過飛行時間質譜儀來鑒定單個的原子。[93]
激發態光譜可以用來研究遠距離恆星的元素組成。通過觀測到的來自恆星的光譜中一些特殊的波長,可以得到氣體狀態下原子的量子轉變。使用同種元素的氣體放電燈,可以得到相同的顏色。[94]氦元素就是通過這種手段在太陽的光譜中被發現的,比在地球上發現早了23年。[95]
起源和現狀
核合成
穩定的質子和電子在大爆炸後的一秒鐘內出現。在接下來的三分鐘之內,太初核合成產生了宇宙中大部分的氦、鋰和氘,有可能也產生了一些鈹和硼。[96][97][98]在理論上,最初的原子(有束縛的電子)是在大爆炸後大約380,000 年產生的,這個時代稱為重新結合,在這時宇宙已經冷卻到足以使電子與原子核結合了。[99]自從那時候開始,原子核就開始在恆星中通過核聚變的過程結合,產生直到鐵的元素。[100]
像鋰-6那樣的同位素是在太空中通過宇宙射線散裂產生的。[101]這種現象在高能量的質子撞擊原子核時會發生,造成大量核子被射出。比鐵重的元素在超新星中通過r-過程產生,或在AGB星中通過s-過程產生,兩種過程中都有中子被原子核捕獲。[102]像鉛那樣的元素,大都是從更重的元素通過核衰變產生的。[103]
地球
大部分組成地球及其居民的原子,都是在太陽系剛形成的時候就已經存在了。還有一部分的原子是核衰變的結果,它們的相對比例可以用來通過放射性定年法決定地球的年齡。[104][105]大部分地殼中的氦都是α衰變的產物。[106]
地球上有很少的原子既不是在一開始就存在的,也不是放射性衰變的結果。碳-14是大氣中的宇宙射線所產生的。[107]有些地球上的原子是核反應爐或核爆炸的產物,要麼是特意製造的,要麼是副產物。[108][109]在所有超鈾元素──原子序數大於92的元素中,只有鈽和錼在地球中自然出現。[110][111]超鈾元素的壽命比地球現在的年齡短[112],因此許多這類的元素都早已衰變了,只有微量的鈽-244例外[104]。鈽和錼的自然礦藏是在鈾礦中通過中子俘獲產生的。[113]
地球含有大約1.33x1050個原子。[114]在地球的大氣層中,含有少量的惰性氣體原子,例如氬和氖。大氣層剩下的99%的部分,是以分子的形式束縛的,包括二氧化碳、雙原子的氧氣和氮氣。在地球的表面上,原子結合併形成了各種各樣的化合物,包括水、鹽、矽酸鹽和氧化物。原子也可以結合起來組成不含獨立分子的物質,包括晶體和液態或固態金屬。[115][116]
罕見和理論形式
雖然原子序數大於82(鉛)的元素已經知道是放射性的,但是對於原子序數大於103的元素,提出了「穩定島」的概念。在這些超重元素中,可能有一個原子核相對來說比其它原子核穩定。[117]最有可能的穩定超重元素是Ubh,它有126 個質子和184 個中子。[118]
每一個粒子都有一個對應的反物質體子,電荷相反。因此,正電子就是帶有正電荷的反電子,反質子就是與質子對等,但帶有負電荷的粒子。不知道什麼原因,在宇宙中反物質是非常稀少的,因此在自然界中沒有發現任何反原子。[119][120]然而,1996年,在日內瓦的歐洲核子研究中心,首次合成了反氫──氫的反物質。[121][122]
把原子中的質子、中子或電子用相等電荷的其它粒子代替,可以形成奇異原子。例如,可以把電子用質量更大的緲子代替,形成緲子原子。這些類型的原子可以用來測試物理學的基本預言。[123][124][125]
參閱
參考文獻
引用
- ↑ Matthew Champion, "Re: How many atoms make up the universe?", 1998
- ↑ Haubold, Hans; Mathai, A. M.. Microcosmos: From Leucippus to Yukawa. Structure of the Universe. Common Sense Science [2008-01-17].
- ↑ Harrison (2003:123–139).
- ↑ 大部分同位素中核子比電子多。以氫-1為例,只有一個電子和核子,則質子重量是總質量的
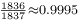 或99.95%
或99.95% - ↑ Staff. Radioactive Decays. Stanford Linear Accelerator Center, Stanford University. 8月1日2007年 [2007-01-02].
- ↑ Ponomarev (1993:14–15).
- ↑ Siegfried (2002:42–55).
- ↑ Lavoisier's Elements of Chemistry. Elements and Atoms. Le Moyne College, Department of Chemistry [2007-12-18].
- ↑ Wurtz (1881:1–2).
- ↑ Dalton (1808).
- ↑ Einstein, Albert. Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen (PDF). Annalen der Physik. May 1905, 322 (8): 549–560 [2007-02-04]. doi:10.1002/andp.19053220806 (German).
- ↑ Mazo (2002:1–7).
- ↑ Lee, Y. K.; Hoon, Kelvin. Brownian Motion. Imperial College, London [2007-12-18].
- ↑ The Nobel Foundation. J.J. Thomson. Nobelprize.org [2007-12-20].
- ↑ Rutherford, E.. The Scattering of α and β Particles by Matter and the Structure of the Atom. Philosophical Magazine. 1911, 21: 669–88 [2008-01-18].
- ↑ Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation [2008-01-18].
- ↑ Thomson, Joseph John. Rays of positive electricity. Proceedings of the Royal Society. 1913, A 89: 1–20 [2007-01-18].
- ↑ Stern, David P.. The Atomic Nucleus and Bohr's Early Model of the Atom. NASA Goddard Space Flight Center. May 16, 2005 [2007-12-20].
- ↑ Bohr, Niels. Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture. The Nobel Foundation. December 11, 1922 [2008-02-16].
- ↑ Lewis, Gilbert N.. The Atom and the Molecule. Journal of the American Chemical Society. April 1916, 38 (4): 762-786. doi:10.1021/ja02261a002.
- ↑ Scerri, Eric R.. The Periodic Table. Oxford University Press US. 2007: pp. 205–226. ISBN 0195305736.
- ↑ Langmuir, Irving. The Arrangement of Electrons in Atoms and Molecules. Journal of the American Chemical Society. 1919, 41 (6): 868–934 [2008-09-01].
- ↑ Brown, Kevin. The Hydrogen Atom. MathPages [2007-12-21].
- ↑ Harrison, David M.. The Development of Quantum Mechanics. University of Toronto [2007-12-21].
- ↑ Aston, Francis W.. The constitution of atmospheric neon. Philosophical Magazine. 1920, 39 (6): 449–55.
- ↑ Chadwick, James. Nobel Lecture: The Neutron and Its Properties. Nobel Foundation. December 12, 1935 [2007-12-21].
- ↑ Kullander, Sven. Accelerators and Nobel Laureates. The Nobel Foundation. August 28, 2001 [2008-01-31].
- ↑ Staff. The Nobel Prize in Physics 1990. The Nobel Foundation. October 17, 1990 [2008-01-31].
- ↑ Staff. The Nobel Prize in Physics 1997. Nobel Foundation. October 15, 1997 [2008-02-10].
- ↑ Park, Jiwoong et al. Coulomb blockade and the Kondo effect in single-atom transistors. Nature. 2002, 417 (6890): 722–25 [2008-01-03]. doi:10.1038/nature00791.
- ↑ Domokos, P.; Janszky, J.; Adam, P.. Single-atom interference method for generating Fock states. Physical Review a. 1994, 50: 3340–44 [2008-01-03]. doi:10.1103/PhysRevA.50.3340.
- ↑ Woan (2000:8).
- ↑ MacGregor (1992:33–37).
- ↑ Particle Data Group. The Particle Adventure. Lawrence Berkeley Laboratory [2007-01-03].
- ↑ Schombert, James. Elementary Particles. University of Oregon. April 18, 2006 [2007-01-03].
- ↑ Jevremovic (2005:63).
- ↑ Pfeffer (2000:330–336).
- ↑ Wenner, Jennifer M.. How Does Radioactive Decay Work?. Carleton College. October 10, 2007 [2008-01-09].
- ↑ 39.0 39.1 39.2 Raymond, David. Nuclear Binding Energies. New Mexico Tech. April 7, 2006 [2007-01-03].
- ↑ Mihos, Chris. Overcoming the Coulomb Barrier. Case Western Reserve University. July 23, 2002 [2008-02-13].
- ↑ Staff. ABC's of Nuclear Science. Lawrence Berkeley National Laboratory. March 30, 2007 [2007-01-03].
- ↑ Makhijani, Arjun; Saleska, Scott. Basics of Nuclear Physics and Fission. Institute for Energy and Environmental Research. March 2, 2001 [2007-01-03].
- ↑ Shultis et al (2002:72–6).
- ↑ Fewell, M. P.. The atomic nuclide with the highest mean binding energy. American Journal of Physics. 1995, 63 (7): 653–58 [2007-02-01]. doi:10.1119/1.17828.
- ↑ 45.0 45.1 Brucat, Philip J.. The Quantum Atom. University of Florida [2007-01-04].
- ↑ Manthey, David. Atomic Orbitals. Orbital Central [2008-01-21].
- ↑ Herter, Terry. Lecture 8: The Hydrogen Atom. Cornell University [2008-02-14].
- ↑ Smirnov (2003:249–72).
- ↑ Matis, Howard S.. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. August 9, 2000 [2007-12-21].
- ↑ Weiss, Rick. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post. October 17, 2006 [2007-12-21].
- ↑ 51.0 51.1 Sills (2003:131–134).
- ↑ Dumé, Belle. Bismuth breaks half-life record for alpha decay. Physics World. April 23, 2003 [2007-12-21].
- ↑ Lindsay, Don. Radioactives Missing From The Earth. Don Lindsay Archive. July 30, 2000 [2007-05-23].
- ↑ 54.0 54.1 CRC Handbook (2002).
- ↑ 55.0 55.1 Mills et al (1993).
- ↑ Chieh, Chung. Nuclide Stability. University of Waterloo. January 22, 2001 [2007-01-04].
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology [2007-01-04].
- ↑ Audi, G.; Wapstra, A. H.; Thibault C.. The Ame2003 atomic mass evaluation(II). Nuclear Physics. 2003, A729: 337–676 [2008-02-07].
- ↑ Shannon, R. D.. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides. Acta Crystallographica, Section a. 1976, 32: 751 [2007-01-03]. doi:10.1107/S0567739476001551.
- ↑ Dong, Judy. Diameter of an Atom. The Physics Factbook [2007-11-19].
- ↑ Zumdahl (2002).
- ↑ Staff. Small Miracles: Harnessing nanotechnology. Oregon State University [2007-01-07]. —describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ↑ Padilla et al(2002:32)—"There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ↑ A carat is 200 milligrams. By definition, Carbon-12 has 0.012 kg per mole. The Avogadro constant defines 6 × 1023 atoms per mole.
- ↑ Feynman (1995).
- ↑ 66.0 66.1 Radioactivity. Splung.com [2007-12-19].
- ↑ L'Annunziata (2003:3–56).
- ↑ Firestone, Richard B.. Radioactive Decay Modes. Berkeley Laboratory. May 22, 2000 [2007-01-07].
- ↑ Hornak, J. P.. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology [2007-01-07].
- ↑ 70.0 70.1 Schroeder, Paul A.. Magnetic Properties. University of Georgia. February 25, 2000 [2007-01-07].
- ↑ Goebel, Greg. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website. September 1, 2007 [2007-01-07].
- ↑ Yarris, Lynn. Talking Pictures. Berkeley Lab Research Review. Spring 1997 [2008-01-09].
- ↑ Liang and Haacke (1999:412–26).
- ↑ Zeghbroeck, Bart J. Van. Energy levels. Shippensburg University [2007-12-23].
- ↑ Fowles (1989:227–233).
- ↑ Martin, W. C.; Wiese, W. L.. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology [2007-01-08].
- ↑ Atomic Emission Spectra-Origin of Spectral Lines. Avogadro Web Site [2006-08-10].
- ↑ Fitzpatrick, Richard. Fine structure. University of Texas at Austin. February 16, 2007 [2008-02-14].
- ↑ Weiss, Michael. The Zeeman Effect. University of California-Riverside [2008-02-06].
- ↑ Beyer (2003:232–236).
- ↑ Watkins, Thayer. Coherence in Stimulated Emission. San José State University [2007-12-23].
- ↑ Reusch, William. Virtual Textbook of Organic Chemistry. Michigan State University. July 16, 2007 [2008-01-11].
- ↑ Husted, Robert et al. Periodic Table of the Elements. Los Alamos National Laboratory. December 11, 2003 [2008-01-11].
- ↑ Baum, Rudy. It's Elemental: The Periodic Table. Chemical & Engineering News [2008-01-11].
- ↑ Goodstein (2002:436–438).
- ↑ Brazhkin, Vadim V.. Metastable phases, phase transformations, and phase diagrams in physics and chemistry. Physics-Uspekhi. 2006, 49: 719–24. doi:10.1070/PU2006v049n07ABEH006013.
- ↑ Myers (2003:85).
- ↑ Staff. Bose-Einstein Condensate: A New Form of Matter. National Institute of Standards and Technology. October 9, 2001 [2008-01-16].
- ↑ Colton, Imogen; Fyffe, Jeanette. Super Atoms from Bose-Einstein Condensation. The University of Melbourne. February 3, 1999 [2008-02-06].
- ↑ Jacox, Marilyn; Gadzuk, J. William. Scanning Tunneling Microscope. National Institute of Standards and Technology [2008-01-11].
- ↑ The Nobel Prize in Physics 1986. The Nobel Foundation [2008-01-11]. —in particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ↑ Jakubowski, N.; Moens, L.; Vanhaecke, F. Sector field mass spectrometers in ICP-MS. Spectrochimica Acta Part B: Atomic Spectroscopy. 1998, 53 (13): 1739–63. doi:10.1016/S0584-8547(98)00222-5.
- ↑ Müller, Erwin W.; Panitz, John A., McLane, S. Brooks. The Atom-Probe Field Ion Microscope. Review of Scientific Instruments. 1968, 39 (1): 83–86. doi:10.1063/1.1683116. ISSN 0034-6748.
- ↑ Lochner, Jim; Gibb, Meredith; Newman, Phil. What Do Spectra Tell Us?. NASA/Goddard Space Flight Center. April 30, 2007 [2008-01-03].
- ↑ Winter, Mark. Helium. WebElements [2008-01-03].
- ↑ Croswell, Ken. Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium. New Scientist. 1991 (1794): 42 [2008-01-14].
- ↑ Copi, Craig J.; Schramm, David N.; Turner, Michael S. Big-Bang Nucleosynthesis and the Baryon Density of the Universe (PDF). Science. 1995, 267: 192–99 [2008-01-13]. doi:10.1126/science.7809624. PMID 7809624.
- ↑ Hinshaw, Gary. Tests of the Big Bang: The Light Elements. NASA/WMAP. December 15, 2005 [2008-01-13].
- ↑ Abbott, Brian. Microwave (WMAP) All-Sky Survey. Hayden Planetarium. May 30, 2007 [2008-01-13].
- ↑ F. Hoyle. The synthesis of the elements from hydrogen. Monthly Notices of the Royal Astronomical Society. 1946, 106: 343–83 [2008-01-13].
- ↑ Knauth, D. C.; Federman, S. R.; Lambert, David L.; Crane, P.. Newly synthesized lithium in the interstellar medium. Nature. 2000, 405: 656–58. doi:10.1038/35015028.
- ↑ Mashnik, Stepan G.. On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes. Cornell University [2008-01-14].
- ↑ Kansas Geological Survey. Age of the Earth. University of Kansas. May 4, 2005 [2008-01-14].
- ↑ 104.0 104.1 Manuel (2001:407–430,511–519).
- ↑ Dalrymple, G. Brent. The age of the Earth in the twentieth century: a problem (mostly) solved. Geological Society, London, Special Publications. 2001, 190: 205–21 [2008-01-14]. doi:10.1144/GSL.SP.2001.190.01.14.
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders. Helium: Fundamental models. MantlePlumes.org. September 2, 2006 [2007-01-14].
- ↑ Pennicott, Katie. Carbon clock could show the wrong time. PhysicsWeb. May 10, 2001 [2008-01-14].
- ↑ Yarris, Lynn. New Superheavy Elements 118 and 116 Discovered at Berkeley Lab. Berkeley Lab. July 27, 2001 [2008-01-14].
- ↑ Diamond, H. et al. Heavy Isotope Abundances in Mike Thermonuclear Device (subscription required). Physical Review. 1960, 119: 2000–04 [2008-01-14]. doi:10.1103/PhysRev.119.2000.
- ↑ Poston Sr., John W.. Do transuranic elements such as plutonium ever occur naturally?. Scientific American. March 23, 1998 [2008-01-15].
- ↑ Keller, C.. Natural occurrence of lanthanides, actinides, and superheavy elements. Chemiker Zeitung. 1973, 97 (10): 522–30 [2008-01-15].
- ↑ Marco (2001:17).
- ↑ Oklo Fossil Reactors. Curtin University of Technology [2008-01-15].
- ↑ Weisenberger, Drew. How many atoms are there in the world?. Jefferson Lab [2008-01-16].
- ↑ Pidwirny, Michael. Fundamentals of Physical Geography. University of British Columbia Okanagan [2008-01-16].
- ↑ Anderson, Don L.. The inner inner core of Earth. Proceedings of the National Academy of Sciences. 2002, 99 (22): 13966–68 [2008-01-16]. doi:10.1073/pnas.232565899. PMID 12391308.
- ↑ Anonymous. Second postcard from the island of stability. CERN Courier. October 2, 2001 [2008-01-14].
- ↑ Jacoby, Mitch. As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine. Chemical & Engineering News. 2006, 84 (10): 19 [2008-01-14].
- ↑ Koppes, Steve. Fermilab Physicists Find New Matter-Antimatter Asymmetry. University of Chicago. March 1, 1999 [2008-01-14].
- ↑ Cromie, William J.. A lifetime of trillionths of a second: Scientists explore antimatter. Harvard University Gazette. August 16, 2001 [2008-01-14].
- ↑ Hijmans, Tom W.. Particle physics: Cold antihydrogen. Nature. 2002, 419: 439–40. doi:10.1038/419439a.
- ↑ Staff. Researchers 'look inside' antimatter. BBC News. October 30, 2002 [2008-01-14].
- ↑ Barrett, Roger; Jackson, Daphne; Mweene, Habatwa. The Strange World of the Exotic Atom. New Scientist. 1990 (1728): 77–115 [2008-01-04].
- ↑ Indelicato, Paul. Exotic Atoms. Physica Scripta. 2004, T112: 20–26. doi:10.1238/Physica.Topical.112a00020.
- ↑ Ripin, Barrett H.. Recent Experiments on Exotic Atoms. American Physical Society [2008-02-15].
書籍
- L'Annunziata, Michael F.. Handbook of Radioactivity Analysis. Academic Press. 2003. ISBN 0-12-436603-1.
- Beyer, H. F.; Shevelko, V. P.. Introduction to the Physics of Highly Charged Ions. CRC Press. 2003. ISBN 0-7503-0481-2.
- Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan. Radiochemistry and Nuclear Chemistry. Elsevier. 2001. ISBN 0-7506-7463-6.
- Dalton, J.. A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell. 1808.
- Demtröder, Wolfgang. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. 1st Edition. Springer. 2002. ISBN 3-540-20631-0.
- Feynman, Richard. Six Easy Pieces. The Penguin Group. 1995. ISBN 978-0-14-027666-4.
- Fowles, Grant R.. Introduction to Modern Optics. Courier Dover Publications. 1989. ISBN 0-486-65957-7.
- Gangopadhyaya, Mrinalkanti. Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. 1981. ISBN 0-391-02177-X.
- Goodstein, David L.. States of Matter. Courier Dover Publications. 2002. ISBN 0-486-49506-X.
- Harrison, Edward Robert. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. 2003. ISBN 0-521-77351-2.
- Jevremovic, Tatjana. Nuclear Principles in Engineering. Springer. 2005. ISBN 0-387-23284-2.
- Lequeux, James. The Interstellar Medium. Springer. 2005. ISBN 3-540-21326-0.
- Liang, Z.-P.; Haacke, E. M.Webster, J. G.. . Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF), vol. 2. John Wiley & Sons. 1999: pp. pp. 412–26 [2008-01-09]. ISBN 0-471-13946-7.
- MacGregor, Malcolm H.. The Enigmatic Electron. Oxford University Press. 1992. ISBN 0-19-521833-7.
- Manuel, Oliver. Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. 2001. ISBN 0-306-46562-0.
- Mazo, Robert M.. Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. 2002. ISBN 0-19-851567-7.
- Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo. Quantities, Units and Symbols in Physical Chemistry. 2nd edition. Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. 1993. ISBN 0-632-03583-8.
- Myers, Richard. The Basics of Chemistry. Greenwood Press. 2003. ISBN 0-313-31664-3.
- Padilla, Michael J.; Miaoulis, Ioannis; Cyr, Martha. Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc.. 2002. ISBN 0-13-054091-9.
- Pauling, Linus. The Nature of the Chemical Bond. Cornell University Press. 1960. ISBN 0-8014-0333-2.
- Pfeffer, Jeremy I.; Nir, Shlomo. Modern Physics: An Introductory Text. Imperial College Press. 2000. ISBN 1-86094-250-4.
- Ponomarev, Leonid Ivanovich. The Quantum Dice. CRC Press. 1993. ISBN 0-7503-0251-8.
- Shultis, J. Kenneth; Faw, Richard E.. Fundamentals of Nuclear Science and Engineering. CRC Press. 2002. ISBN 0-8247-0834-2.
- Siegfried, Robert. From Elements to Atoms: A History of Chemical Composition. DIANE. 2002. ISBN 0-87169-924-9.
- Sills, Alan D.. Earth Science the Easy Way. Barron's Educational Series. 2003. ISBN 0-7641-2146-4.
- Smirnov, Boris M.. Physics of Atoms and Ions. Springer. 2003. ISBN 0-387-95550-X.
- Teresi, Dick. Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. 2003: pp. 213–214. ISBN 074324379X.
- VariousLide, David R.. . Handbook of Chemistry & Physics. 88th edition. CRC. 2002 [2008-05-23]. ISBN 0849304865.
- Woan, Graham. The Cambridge Handbook of Physics. Cambridge University Press. 2000. ISBN 0-521-57507-9.
- Wurtz, Charles Adolphe. The Atomic Theory. New York: D. Appleton and company. 1881.
- Zaider, Marco; Rossi, Harald H.. Radiation Science for Physicians and Public Health Workers. Springer. 2001. ISBN 0-306-46403-9.
- Zumdahl, Steven S.. Introductory Chemistry: A Foundation. 5th edition. Houghton Mifflin. 2002 [2008-02-05]. ISBN 0-618-34342-3.
外部連結
- ()中國科普博覽──核能博物館,中國科學院主編。
- Francis, Eden. Atomic Size. Clackamas Community College.
- Freudenrich, Craig C. How Atoms Work. How Stuff Works.
- Anonymous. The atom. Science aid+.
- Anonymous. Atoms and Atomic Structure. BBC. 2006年1月3日.
- Various. Physics 2000, Table of Contents. University of Colorado. 2006年1月3日.
- Various. What does an atom look like?. University of Karlsruhe. 2006年2月3日.
- YAN Kun. Equation of average binding energy per nucleon. DOI:10.3969/j.issn.1004-2903.2011.01.018
|
|
|||||
參考來源
| 關於「原子」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |