配位數
| A+醫學百科 >> 配位數 |
配位數(coordination number)是中心離子的重要特徵。直接同中心離子(或原子)配位的原子數目叫中心離子(或原子)的配位數。
目錄 |
簡介
配位化學中,配位數指化合物中中心原子周圍的配位原子個數,此概念首先由阿爾弗雷德.維爾納在1893年提出。 配位數通常為2-8,也有高達10以上的,如鈾和釷的雙齒簇狀硝酸根離子U(NO3)6、Th(NO3)6,及最近研究的PbHe15離子,該離子中鉛的配位
數至少為15。
此概念也可延伸至任何化合物,也就是配位數等同於共價鍵鍵連數,例如,可以說甲烷中碳的配位數為4。這種說法通常不計π鍵。
晶體學中,配位數是晶格中與某一原子相距最近的原子個數。配位數與晶體結構或晶胞類型有關,且決定原子堆積的緊密程度,體心立方晶系中原子配位數為8。最高的配位數(面心立方)為12,存在於六方緊密堆積和立方緊密堆積結構中。
正文
在配位化合物(簡稱配合物)中直接與中心原子連接的配體的
原子數目。通常,配位數可以從2到9。如在配合物【Nb(H2O)9】3+和【ReH9】2-中配位數為9;在【Mo(CN)8】4-和【TaF8】3-中為8;在【ZrF7】3-和【NbF7】2-中為7;在【Ti(H2O)6】3+、【Co(NH3)6】3+中為6;在【CdCl5】3-和Fe(CO)5中為 5;在【BeCl4】2-、【Zn(CN)4】2- 和Ni(CO)4中為4;在【HgI3】-中為3;在【Ag(NH3)2】+和【Au(CN)2】- 中為2。配位數為10或更高(11或12)的只在鑭系和錒系配合物中偶爾發現,是極少見的。
影響配位數的因素
影響配位數的因素如下:
中心原子的大小
中心原子的最高配位數決定於它在周期表中的周次。在周期表內,第1周期元素的最高配位數為2,第2周期元素的最高配位數為4,第3周期為6,以下為8、10。最高配位數是指在配合物中,中心原子周圍的最高配位原子數,實際上一般可低於最高數(表1)。由表可見,在實際中第1周期元素原子的配位數為2,第2周期不超過4。除個別例外,第3、4周期不超過6,第5、6周期為8。最常見的配位數為4和6,其次為2、5、8。配位數為奇數的通常不如偶數的普遍。
中心原子的電荷
中心原子的電荷高,配位數就大。例如,等電子系列的中心原子Ag+、Cd2+和In3+與Cl-分別生成配位數為2、4和6的【AgCl2】-、【CdCl4】2-和【InCl6】3-配離子。同一元素不同氧化態的離子常具有不同的配位數,例如,二價鉑離子Pt2+的配位數為4,而4價鉑離子
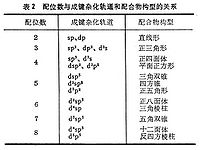
Pt4+為6。這是因為中心離子的電荷愈高,就需要愈多的配體負電荷來中和。 中心原子的成鍵軌道性質和電子構型 從價鍵理論的觀點來說,中心原子成鍵軌道的性質決定配位數,而中心原子的電子構型對參與成鍵的雜化軌道的形成很重要,例如,Zn2+和Cu+離子的5個d軌道是全滿的,適合成鍵的是一個4s和3個p軌道,經sp3雜化形成4個成鍵軌道,指向正四面體的四個角。
因此,Zn2+和Cu+與CN-生成配位數為4的配離子【Zn(CN)4】2-和【Cu(CN)4】3-,並且是正四面體構型(表2)。
配體的性質
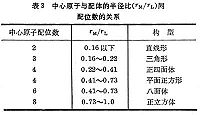
同一氧化態的金屬離子的配位數不是固定不變的,還取決於配體的性質。例如,Fe3+與Cl-生成配位數為 4的【FeCl4】-,而與F-則生成配位數為 6的【FeF6】3-。這是因為 Fe3+從每個體積較大而較易極化的Cl-接受的電荷要大於體積較小而較難極化的F-。配合物的中心原子與配體間鍵合的性質,對決定配位數也很重要。在含F-的配合物中,中心原子與電負性很高的F-間的鍵合主要是離子鍵。如在B3+、Fe3+和Zr4+與F-的配合物中,隨著中心原子半徑的增加,配位數分別為4、6和7,主要受中心原子與配體的半徑比的限制(表3)。很多配合物的中心原子與配體(例如CN-、NO娛、SCN-、Br-、I-、NH3和CO等)間主要形成共價鍵,它們的配位數決定於中心原子成鍵軌道的性質。
配位場理論認為中心原子的內層軌道受周圍配體的影響,也即關係到配位數。例如,Ni2+離子與H2O和NH3等具有小的相互排斥力的弱場配體,生成配位數為 6的【Ni(H2O)6】2+和【Ni(NH3)6】2+等八面體配離子;與Br-和I-等具有大的相互排斥力的弱場配體則趨向於生成配位數為4的【NiBr4】2-和【NiI4】2-等正四面體配離子;與CN-等強場配體則生成配位數為4的【Ni(CN)4】2-平面正方形配離子。
參考書目 戴安邦主編:《配位化學》(無機化學叢書),科學出版社,北京,1987。
舉例介紹
中心離子(或原子)同單基配體結合的數目就是該中心離子(或原子)的配位數。例如[Cu(NH)]SO中Cu離子的配位數為4,[Co(NH)HO]Cl中Co離子的配位數為6。中心離子(或原子)同多基配體配合時,配位數等同於配位原子數目,例如[Cu(en)]中的乙二胺(en)是雙基配體,因此Cu離子的配位數為4。
中心離子的配位數一般是2、4、6,最常見的是4和6,配位數的多少取決於中心離子和配體的性質──電荷、體積、電子層結構以及配合物形成時的條件,特別是濃度和溫度。一般來講,中心離子的電荷越高越有利於形成配位數較高的配合物。如Ag,其特徵配位數為2,如[Ag(NH)];Cu,其特徵配位數為4,例[Cu(NH)];Co,其特徵配位數為6,例[Co(NH)HO]。但配體電荷的增加對形成高配位數是不利的,因為它增加了配體之間的斥力,使配位數減少。如[Co(HO)]同[CoCl]相比,前者的配體是中性分子,後者是帶負電荷的Cl離子,使Co的配位數由6降為4。因此,從電荷這一因素考慮,中心離子電荷的增高以及配位體電荷的減少有利於配位數的增加。
中心離子的半徑越大,在引力允許的條件下,其周圍可容納的配體越多,配位數也就越大。例如Al與F可形成[AlF]配離子,體積較小的B(Ⅲ)原子就只能生成[BF]配離子。但應指出中心離子半徑的增大固然有利於形成高配位數的配合物,但若過大又會減弱它同配體的結合,有時反而降低了配位數。如Cd可形成[CdCl]配離子,比Cd大的Hg,卻只能形成[HgCl]配離子。顯然配位體的半徑較大,在中心離子周圍容納不下過多的配體,配位數就減少。如F可與Al形成[AlF]配離子,但半徑比F大的Cl、Br、I與Al只能形成[Al
X]配離子(X代表Cl、Br、I離子)。
溫度升高,常使配位數減小。這是因為熱振動加劇時,中心離子與配體間的配位鍵減弱的緣故。
而配位體濃度增大有利於形成高配位數的配合物。
綜上所述,影響配位數的因素是複雜的,是由多方面因素決定的,但對於某一中心離子在與不同的配體結合時,常具有一定的特徵配位數。現將某些常見金屬離子的特徵配位數列於表7-2中。
| 關於「配位數」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |