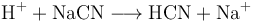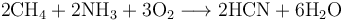氰化氫
| A+醫學百科 >> 氰化氫 |
| 氰化氫 | |
|---|---|
 |
|
| IUPAC名 Hydrogen cyanide |
|
| 別名 | 氫氰酸 |
| 識別 | |
| CAS號 | 74-90-8 |
| RTECS | MW6825000 |
| 性質 | |
| 化學式 | HCN |
| 摩爾質量 | 27.03 g·mol⁻¹ |
| 外觀 | 無色氣體或淡藍色易揮發液體 |
| 密度 | (液) 0.687 |
| 熔點 | -13.4°C (259.75 K, 7.88°F) |
| 沸點 | 26°C (299.15 K, 78.8°F) |
| 溶解性(水) | 易溶 |
| pKa | 9.2 - 9.3 |
| 結構 | |
| 分子構型 | 直線形 |
| 偶極矩 | 2.98 D |
| 危險性 | |
| 警示術語 | R:R12-R26-R27-R28-R32 |
| 安全術語 | S:S1/2-S7-S9-S13-S16-S28-S29-S45 |
| 主要危害 | 劇毒及易燃 |
| NFPA 704 | |
| 閃點 | −17.78 °C |
| 相關物質 | |
| 相關化學品 | 氰、氯化氰、磷雜乙炔 三甲基氰矽烷 |
| 若非註明,所有數據均出自一般條件(25 ℃,100 kPa)下。 | |
氰化氫,又稱氫氰酸,化學式HCN。標準狀態下為氣體,劇毒且致命,無色而苦,並有杏仁氣味,能否嗅出視乎個人基因[來源請求]。氰化氫是一種無色,有毒液體, 它是一種弱酸,沸點26℃(79°F)。氰化氫是一個線性分子,碳和氮之間具有三鍵。
目錄 |
製取
氰化氫的實驗室製法是通過氰化物與酸反應製備,如:
最重要的工業製取氰化氫的方法要數Andrussow氧化反應,它是通過甲烷、氨氣以及氧氣在約1200°C經由鉑催化得到氰化氫:
- 其中反應所需能量由甲烷和氨氣的部分氧化提供。
或者由石墨與氨氣加強熱生成氣體,冷凝後得液體氰化氫。
化學性質
分子可溶於水中形成氫氰酸。可與鹵代烴進行親核取代反應(SN),及與羰基化合物進行親核加成反應生成α-羥基腈。由於可以使化合物增加一個碳原子,故是重要的有機合成試劑和化工步驟,實際上常用CN−作親核試劑。
危害
健康危害:抑制細胞色素氧化酶,造成細胞內窒息。可致眼、皮膚灼傷,吸收引起中毒。
急性中毒:
- 短時間內吸入高濃度氰化氫氣體,可立即呼吸停止而死亡。
- 非驟死者臨床分為4期:
- 前驅期有粘膜刺激、呼吸加快加深、乏力、頭痛;口服有舌尖、口腔發麻等。
- 呼吸困難期有呼吸困難、血壓升高、皮膚粘膜呈鮮紅色等。
- 驚厥期出現抽搐、昏迷、呼吸衰竭。
- 麻痹期全身肌肉鬆弛,呼吸心跳停止而死亡。
參閱
參考資料
- ↑ Andrussow, L.. The catalytic oxydation of ammonia-methane-mixtures to hydrogen cyanide. Angewandte Chemie. 1935, 48 (37): 593–595. doi:10.1002/ange.19350483702.
外部連結
|
|||||||||||||||||||||||||||||||||||||||||||||||
參考來源
出自A+醫學百科 「氰化氫」條目 http://cht.a-hospital.com/w/%E6%B0%B0%E5%8C%96%E6%B0%A2 轉載請保留此連結
| 關於「氰化氫」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |