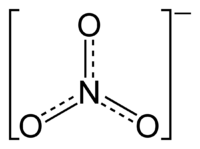
硝酸鹽
| A+醫學百科 >> 硝酸鹽 |
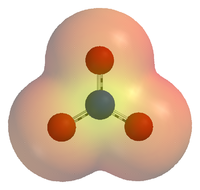
硝酸根離子的靜電勢能圖,可以看出氧原子聚集了大部分的負電荷。
硝酸鹽是硝酸根離子NO3−形成的鹽。許多金屬都能形成硝酸鹽,包括無水鹽或水合物。
目錄 |
結構
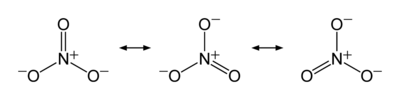
與碳酸根離子類似,硝酸根離子的分子構型是平面三角形,並且具有以下共振式:
合成
硝酸與金屬、金屬氧化物或碳酸鹽反應是最簡單的製備硝酸鹽的方法。某些含水的硝酸鹽如Be(NO3)2,Mg(NO3)2和Cu(NO3)2加熱後會分解 ,因此得不到相應的無水硝酸鹽。無水硝酸鹽可通過下列途徑製得:[1]
- 在液態N2O4中反應:
-
- Ni(CO)4 + N2O4 → Ni(NO3)2 + 2NO + 4CO
- 在純HNO3-N2O5或液態N2O5中反應:
-
- TiCl4 + 4N2O5 → Ti(NO3)4 + 2N2O4 + 2Cl2
-
- TiCl4 + 4ClNO3 −(-80℃)→ Ti(NO3)4 + 2Cl2
某些金屬還可形成通式為MOx(NO3)y的鹼式硝酸鹽,如BiO(NO3)2。
分解
硝酸鹽分解的產物可以是:
括號中的信息按金屬活動性順序表排序
檢驗
硝酸根離子可在酸性介質中,通過和鐵(II)反應產生棕色環加以定性檢出。參見棕色環實驗。
總反應為:
-
- 3Fe2+ + NO3− + 4H+ → 3Fe3+ + NO + 2H2O
雖然該反應已有很久的歷史,但其機理卻是不久前經分光光度法及電位滴定法的系統研究後才弄清楚的:[2]
-
- Fe2+ + NO3− + 2H+ → Fe3+ + NO2 + H2O
- Fe2+ + NO2 + H+ → Fe3+ + HNO2
- Fe2+ + HNO2 + H+ → Fe3+ + NO + H2O
- Fe2+ + NO → FeNO2+
- 2NO2 + H2O → HNO2 + NO3− + H+
- 2HNO2 → NO + NO2 + H2O
- NO + NO3− + H+ → NO2 + HNO2
其中棕色環是由FeNO2+(第四步)引起的,速控步則是最後一步。
配位化合物
硝酸根和金屬離子可以按多種方式配位,包括單齒、雙齒、叄齒或端梢、橋式等。
參見
參考資料
- ↑ 張青蓮等。《無機化學叢書》第四卷 氮磷砷分族。北京:科學出版社。
- ↑ I. R. Epstein, K. Kustin and L. J. Warshaw, J. Am. Chem. Soc. 102:3751 (1980).
參考來源
出自A+醫學百科 「硝酸鹽」條目 http://cht.a-hospital.com/w/%E7%A1%9D%E9%85%B8%E7%9B%90 轉載請保留此連結
| 關於「硝酸鹽」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |