鈉
| A+醫學百科 >> 鈉 |
鈉(sodium),一種金屬元素,質地軟,能使水分解釋放出氫。在地殼中鈉1的含量為2.83%,居第六位,主要以鈉鹽的形式存在,如食鹽(氯化鈉)、智利硝石(硝酸鈉)、純鹼(碳酸鈉)等。鈉也是人體肌肉和神經組織中的主要成分之一。在古漢語中,「鈉」字的意思是鍛鐵。
目錄 |
元素相關參數
周期表第三周期中ⅡA族有銀白色金屬光澤的固體,二號鹼金屬,鹼金屬中最常見的。
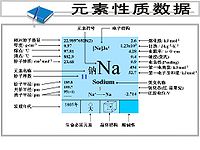
原子序數:11
原子量:2989768
相對原子質量:22.99
原子體積(立方厘米/摩爾):23.7
元素在太陽中的含量:(ppm) 40
地殼中含量:(ppm)23000
元素在海水中的含量:(ppm)10500
晶胞參數:
a = 429.06 pm
b = 429.06 pm
c = 429.06 pm
α = 90°
β = 90°
γ = 90°
氧化態:
Main Na+1
Other Na-1 (in liquid NH3)
莫氏硬度:0.5
聲音在其中的傳播速率:(m/S)3200
電離能 (kJ/ mol)
M - M+ 495.8
M+ - M2+ 4562.4
M2+ - M3+ 6912
M3+ - M4+ 9543
M4+ - M5+ 13353
M5+ - M6+ 16610
M6+ - M7+ 20114
M7+ - M8+ 25490
M8+ - M9+ 28933
M9+ - M10+ 141360
熱導率: W/(m.K)142
電導率:20-200
(25C_+1C)uS/cm
鈉的發現
自然界的元素有兩種存在形式:一種是以單質的形態存在,叫做元素的游離態;一種是以化合物的形態存在,叫做元素的化合態。鈉的化學性質很活潑,所以它在自然界里不能以游離態存在,只能以化合態存在。
在19世紀初,伏特(Volta A.G.,1745—1827,義大利科學家)發明了電池後,各國化學家紛紛利用電池分解水成功。英國化學家戴維(Davy H.,1778—1829,英國化學家)堅持不懈地從事於利用電池分解各種物質的實驗研究。他希望利用電池將苛性鉀分解為氧氣和一種未知的「基」,因為當時化學家們認為苛性鹼也是氧化物。它先用苛性鉀的飽和溶液實驗,所得的結果卻和電解水一樣,只得到氫氣和氧氣。後來他改變實驗方法,電解熔融的苛性鉀,在陰極上出現了具有金屬光澤的、類似水銀的小珠,一些小珠立即燃燒並發生爆炸,形成光亮的火焰,另一些小珠不燃燒
,只是表面變暗,覆蓋著一層白膜。他把這種小小的金屬顆粒投入水中,即起火焰,在水面急速奔躍,發出刺刺的聲音。就這樣,戴維在1807年發現了金屬鉀,幾天之後,他又從電解苛性鈉中獲得了金屬鈉。
戴維將鉀和鈉分別命名為Potassium和Sodium,因為鉀是從草木灰(Potash),鈉是從天然鹼─蘇打(Soda)中得到的,它們至今保留在英文中。鉀和鈉的化學符號K,Na分別來自它們的拉丁文名稱Kalium和Natrium。
鈉單質的性質
物理性質
鈉單質很軟,可以用小刀切割。切開外皮後,可以看到鈉具有銀白色的金屬光澤,很快就會被氧化失去光澤。鈉是熱和電的良導體,鉀鈉合金(液態)是原子堆導熱劑。鈉的密度是0.97g/cm3,比水的密度小,比煤油密度大,鈉的熔點是97.81℃,沸點是882.9℃。鈉單質還具有良好的延展性。
化學性質
鈉原子的最外層只有1個電子,很容易失去。因此,鈉的化學性質非常活潑,在與其他物質發生氧化還原反應時,作還原劑,都是由0價升為+1價。金屬性強。其離子氧化性弱。
1.鈉跟氧氣的反應
在常溫時:4Na+O2=2Na2O (白色粉末)
在點燃時:2Na+O2=Na2O2 (淡黃色粉末)
★鈉在空氣中點燃時,迅速熔化為一個閃亮的小球,發出黃色火焰,生成過氧化鈉(Na2O2)。過氧化鈉比氧化鈉穩定,氧化鈉可以和氧氣化合成為過氧化鈉,化學方程式為:2Na2O+O2=2Na2O2
2.鈉能跟鹵素、硫、磷、氫等非金屬直接發生反應,生成相應的化合物(已下反應常溫下均反應),如
2Na+Cl2=2NaCl (放出大量熱,生成大量白煙)
2Na+S=Na2S(硫化鈉)(鈉與硫化合時研磨會發生爆炸)
2Na+Br2=2NaBr(溴化鈉)(溴化鈉可以用作鎮靜劑)
3.鈉跟水的反應
在燒杯中加一些水,滴入幾滴酚酞溶液,然後把一小塊鈉放入水中。為了安全應在燒杯上加蓋玻璃片。
觀察到的現象及由現象得出的結論有:
1、鈉浮在水面上(鈉的密度比水小)
2、鈉熔成一個閃亮的小球(鈉與水反應放出熱量,鈉的熔點低)
3、鈉在水面上四處遊動(有氣體生成)
4、發出嘶嘶的響聲(生成了氣體,反應劇烈)
5、事先滴有酚酞試液的水變紅(有碱生成)
反應方程式
2Na+2H2O=2NaOH+H2↑
★鈉由於此反應劇烈,能引起氫氣燃燒,所以鈉失火不能用水撲救,必須用乾燥沙土來滅火。鈉具有很強的還原性,可以從一些熔融的金屬鹵化物中把金屬置換出來。由於鈉極易與水反應,所以不能用鈉把居於金屬活動性順序鈉之後的金屬從其鹽溶液中置換出來。
4、鈉與酸溶液反應
鈉與酸溶液的反應涉及到鈉的量,如果鈉少量,只能與酸反應,如鈉與鹽酸的反應:
2Na+2HCl=2NaCl+H2↑
如果鈉過量,則優先與酸反應,然後再與酸溶液中的水反應,方程式見3
5、鈉與鹽反應
(1)與鹽溶液反應
將鈉投入鹽溶液中,鈉先會和溶液中的水反應,生成的氫氧化鈉如果能與鹽反應則繼續反應。
如將鈉投入硫酸銅溶液中:
2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
(2)與熔融鹽反應
這類反應多數為置換反應,常見於金屬冶煉工業中,如
4Na+TiCl4(熔融)=4NaCl+Ti(條件為高溫)
Na+KCl=K+NaCl(條件為高溫)
★鈉與熔融鹽反應不能證明金屬活動性的強弱
6、鈉與有機物反應
鈉還能與某些有機物反應,如鈉與乙醇反應:
2Na+2C2H5OH→2CH3CH2ONa+H2↑(生成物為氫氣和乙醇鈉)
7、鈉的有關化學方程式
⑴與非金屬單質: 2Na+H2=高溫=2NaH
4Na+O2=2Na2O (白色固體)
2Na+O2=點燃=Na2O2 (淡黃色粉末)
⑵與金屬單質; 不反應
⑶與水: 2Na+2H2O=2NaOH+H2↑
⑷與酸: 2Na+2HCl=2NaCl+H2↑
⑸與碱; 不反應(與碱溶液反應)
⑹與鹽; ①4Na+TiCl4=高溫=4NaCl+Ti
6Na+2NaNo2=高溫=N2↑+4Na2O
Na+KCl=高溫=K↑+NaCl
②2Na+2H2O=2NaOH+H2↑
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
或2Na+2H2O=2NaOH+H2↑
NH4Cl+NaOH=NaCl+NH3↑+H2O
⑺與氧化物: 4Na+Co2=點燃=2Na2O+C↓
鈉的製取與保存
製取
通過電解熔融的氯化鈉(食鹽),硼砂或冰晶石獲得。
保存
鈉的化學性質很活潑,所以它在自然界里不能以游離態存在,因此,在實驗室中通常將鈉保存在煤油或石蠟油里。
(原因:ρ Na>ρ煤油且Na與煤油不發生化學反應)
鈉的用途
工業用途
純凈的金屬鈉在工業上並沒有多大用處,然而鈉的化合物可以應用在醫藥、農業和攝影器材中。氯化鈉就是餐桌上的食鹽。液態的鈉有時用於冷卻核反應堆{鈉鉀合金在室溫下呈液態,是核反應堆的導熱劑,起把反應堆產生的熱量傳導給蒸氣輪機的作用。熔融的金屬鈉在增值反應堆中可做熱交換劑。 ) 以往金屬鈉主要用於製造車用汽油的抗暴劑,但由於會污染環境,已經日趨減少。金屬鈉還用來製取鈦,及生產氫氧化鈉、氨基鈉、氰化鈉等。
實驗用途
在初中教學中,常將金屬鈉與水的反應用作演示實驗向學生展示鹼金屬的活潑性;在高中化學實驗中會讓學生自己動手操作,並且增多了鈉與乙醇的反應,用以比較水與乙醇的酸性或極性。在科研實驗中,金屬鈉可用來對有機試劑進行深度除水,例如GPC(凝膠液相色譜)對流動液的除水要求特別高,用作流動液或溶劑的四氫呋喃須經過初步除水(用沸石分子篩或無水硫酸鎂等乾燥劑過夜乾燥)、深度除水及蒸餾才能使用。深度除水就可以用金屬鈉與四氫呋喃在70度左右進行迴流,加入少量二苯甲酮作為指示劑,當液體變為深紫色時,水就已經除乾淨,直接將迴流冷凝管改為直形冷凝管,把溫度稍微再提高,就可以蒸出已經深度除水的四氫呋喃。
生理作用
鈉是人體中一種重要無機元素,一般情況下,成人體內鈉含量大約為3200(女)-4170(男)mmol,約佔體重的0.15%,體內鈉主要在細胞外液,佔總體鈉的44%-50%,骨骼中含量也高達40%-47%,細胞內液含量較低,僅9%-10%。
主要生理作用
1、鈉是細胞外液中帶正電的主要離子,參於水的代謝,保證體內水的平衡,調節體內水分與滲透壓。
2、維持體內酸和碱的平衡。
3、是胰汁、膽汁、汗和淚水的組成成分。
4、鈉對ATP的生產和利用、肌肉運動、心血管功能、能量代謝都有關係,此外,糖代謝、氧的利用也需有鈉的參與。
5、維持血壓正常。
需要人群
高溫、重體力勞動、經常出汗的人需要注意補充鈉。
來源
鈉普遍存在於各種食物中,一般動物性食物高於植物性食物,但人體鈉來源主要為食鹽、以及加工、製備食物過程中加入的鈉或含鈉的複合物(如谷氨酸、小蘇打等),以及醬油、鹽漬或腌制肉或煙熏食品、醬鹹菜類、發酵豆製品、鹹味休閑食品等。
缺乏
人體內鈉在一般情況下不易缺乏、但在某些情況下,如禁食、少食,膳食鈉限制過嚴而攝入非常低時,或在高溫、重體力勞動、過量出汗、腸胃疾病、反覆嘔吐、腹瀉使鈉過量排出而丟失時,或某些疾病,如艾迪生病引起腎不能有效保留鈉時,胃腸外營養缺鈉或低鈉時,利尿劑的使用而抑制腎小管重吸收鈉時均可引起鈉缺乏。鈉的缺乏在早期癥狀不明顯,倦怠、淡漠、無神、甚至起立時昏倒。失鈉達0.5g/kg體重以上時,可出現噁心、嘔吐、血壓下降、痛性吉爾痙攣,尿中無氯化物檢出。
過量
正常情況下,鈉攝入過多並不蓄積,但某些情況下,如誤將食鹽當食糖加入嬰兒奶粉中餵養,則可引起中毒甚至死亡。急性中毒,可出現水腫、血壓上升、血漿膽固醇升高、脂肪清楚率降低、胃黏膜上皮細胞受損等。鈉的適宜攝入量(AI)成人為2200mg/d。
代謝吸收
人體鈉的主要來源為食物。鈉在小腸上部吸收,吸收率極高,幾乎可全部被吸收,故糞便中含鈉量很少。鈉在空腸的吸收大多是被動性的,在迴腸則大部分是主動的吸收。鈉與鈣在腎小管內的重吸收過程發生競爭,故鈉攝入量高時,會相應減少鈣的重吸收,而增加尿鈣排泄。因尿鈣丟失約為鈣瀦留的50%,故高鈉膳食對骨丟失有很大影響。
鈉的重要化合物
1、過氧化鈉
化學式Na2O2,淡黃色粉末,密度2.805g/cm3。它具有強氧化性,在熔融狀態時遇到棉花、炭粉、鋁粉等還原性物質會發生爆炸。因此存放時應注意安全,不能與易燃物接觸。它易吸潮,遇水或CO2時會發生反應,生成氧氣。它不溶於乙醇,可與空氣中的二氧化碳作用而放出氧氣,常用在缺乏空氣的場合,如礦井、坑道、潛水、宇宙飛船等方面,可將人們呼出的二氧化碳再轉變為氧氣,以供人們呼吸之用。過氧化鈉在工業上常用做漂白劑、殺菌劑、消毒劑、去臭劑、氧化劑等。通常可通過在不含二氧化碳的乾燥空氣流中把金屬鈉加熱到300℃來製取過氧化鈉。由於它易潮解,易和二氧化碳反應,必須保存在密封的器皿中。
2、氯化鈉
俗稱食鹽,是無色立方結晶或白色結晶。密度2.165g/cm3。熔點801℃。沸點1413℃。溶於水、甘油,微溶於乙醇、液氨。不溶於鹽酸。在空氣中微有潮解性。由海水(平均含2.4%氯化鈉)引入鹽田,經日晒乾燥,濃縮結晶,製得粗品。亦可將海水,經蒸汽加溫,砂濾器過濾,用離子交換膜電滲析法進行濃縮,得到鹽水(含氯化鈉160~180g/L)經蒸發析出鹽鹵石膏,離心分離,製得的氯化鈉95%以上(水分2%)再經乾燥可製得食鹽(table salt)。還可用岩鹽、鹽湖鹽水為原料,經日晒乾燥,製得原鹽。用地下鹽水和井鹽為原料時,通過三效或四效蒸發濃縮,析出結晶,離心分離製得。用於製造純鹼和燒鹼及其他化工產品,礦石冶煉。食品工業和漁業用於鹽腌,還可用作調味料的原料和精製食鹽。
3、氫氧化鈉
俗稱火碱、燒鹼、片碱、苛性鈉。純的無水氫氧化鈉為白色半透明,結晶狀固體。氫氧化鈉極易溶於水,溶解度隨溫度的升高而增大,溶解時能放出大量的熱,288K時其飽和溶液濃度可達26.4mol/L(1:1)。它的水溶液有澀味和滑膩感,溶液呈強鹼性,具備碱的一切通性。市售燒鹼有固態和液態兩種:純固體燒鹼呈白色,有塊狀、片狀、棒狀、粒狀,質脆;純液體燒鹼為無色透明液體。氫氧化鈉還易溶於乙醇、甘油;但不溶於乙醚、丙酮、液氨。對纖維、皮膚、玻璃、陶瓷等有腐蝕作用,溶解或濃溶液稀釋時會放出熱量;與無機酸發生中和反應也能產生大量熱,生成相應的鹽類;與金屬鋁和鋅、非金屬硼和硅等反應放出氫;與氯、溴、碘等鹵素髮生歧化反應。能從水溶液中沉澱金屬離子成為氫氧化物;能使油脂發生皂化反應,生成相應的有機酸的鈉鹽和醇,這是去除織物上的油污的原理。
4、碳酸鈉
俗稱純鹼、蘇打。溶於無水乙醇,不溶於丙醇。穩定性較強,但高溫下也可分解,生成氧化鈉和二氧化碳。長期暴露在空氣中能吸收空氣中的水分及二氧化碳,生成碳酸氫鈉,並結成硬塊。吸濕性很強 ,很容易結成硬塊,在高溫下也不分解。含有結晶水的碳酸鈉有3種:Na2CO3.H2O、Na2CO3.7H2O 和 Na2CO3.10H2O。
5、碳酸氫鈉
俗稱小蘇打。為晶體,或不透明單斜晶系細微結晶。比重2.159。無臭、味咸,可溶於水,微溶於乙醇。其水溶液因水解而呈微鹼性,受熱易分解,在65℃以上迅速分解,在270℃時完全失去二氧化碳,在乾燥空氣中無變化,在潮濕空氣中緩慢分解。用作食品工作的發酵劑、汽水和冷飲中二氧化碳的發生劑、黃油的保存劑。可直接作為製藥工業的原料,用於治療胃酸過多。還可用於電影製片、鞣革、選礦、冶煉、金屬熱處理,以及用於纖維、橡膠工業等。同時用作羊毛的洗滌劑、泡沫滅火劑,以及用於農業浸種等。 食品工業中一種應用最廣泛的疏鬆劑,用於生產餅乾、糕點、饅頭、麵包等,是汽水飲料中二氧化碳的發生劑;可與明礬複合為鹼性發酵粉,也可與純鹼複合為民用石鹼;還可用作黃油保存劑。消防器材中用於生產酸鹼滅火機和泡沫滅火機。橡膠工業利用其與明礬、H發孔劑配合起均勻發孔的作用用於橡膠、海棉生產。冶金工業用作澆鑄鋼錠的助熔劑。機械工業用作鑄鋼(翻砂)砂型的成型助劑。印染工業用作染色印花的固色劑,酸鹼緩衝劑,織物染整的後處理劑。醫藥工業用作制酸劑的原料。
參看
|
|||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
| 關於「鈉」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |