硫酸
| A+醫學百科 >> 硫酸 |
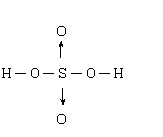
硫酸,分子式為H2SO4。是一種無色無味油狀液體,是一種高沸點難揮發的強酸,易溶於水,能以任意比與水混溶。硫酸是基本化學工業中重要產品之一。它不僅作為許多化工產品的原料,而且還廣泛地應用於其他的國民經濟部門。
目錄 |
化學品簡介
硫酸是化學六大無機強酸(硫酸、硝酸、鹽酸、氫溴酸、氫碘酸、高氯酸)之一。
中文名稱:硫酸
英文名稱:sulfuric acid
法文名稱:Sulfate
化學式:H2SO4
CAS登錄號:7664-93-9
EINECS 登錄號231-639-5
分子相對質量: 98.08
成分/組成信息:硫酸 98.0%(濃)<70% (稀)
密度:98%的濃硫酸 1.84g/mL
中心原子雜化方式:sp3
pKa1: -3.00pka2:1.99
結構
化學品性質
濃硫酸
物理性質
濃硫酸溶解時放出大量的熱,因此濃硫酸稀釋時應該「酸入水,沿器壁,慢慢倒,不斷攪。」 若將濃硫酸中繼續通入三氧化硫,則會產生"發煙"現象,這樣含有SO3的硫酸稱為"發煙硫酸"。
100%的硫酸熔沸點:
熔點10℃
沸點290℃
但是100%的硫酸並不是最穩定的,沸騰時會分解一部分,變為98.3%的濃硫酸,成為338℃(硫酸水溶液的) 恆沸物。加熱濃縮硫酸也只能最高達到98.3%的濃度。
98.3%硫酸的熔沸點:
熔點:10℃;
沸點:338℃
化學性質
◆濃硫酸
1.脫水性
⑴就硫酸而言,脫水性是濃硫酸的性質,而非稀硫酸的性質,即濃硫酸有脫水性且脫水性很強。
⑵脫水性是濃硫酸的化學特性,物質被濃硫酸脫水的過程是化學變化的過程,反應時,濃硫酸按水分
子中氫氧原子數的比(2∶1)奪取被脫水物中的氫原子和氧原子。
⑶可被濃硫酸脫水的物質一般為含氫、氧元素的有機物,其中蔗糖、木屑、紙屑和棉花等物質中的有機物,被脫水後生成

了黑色的炭(炭化)。
濃硫酸 如C12H22O11===12C + 11H2O
(4)黑麵包反映
在200mL燒杯中放入20g蔗糖,加入幾滴水,攪拌均勻。然後再加入15mL質量分數為98%的濃硫酸,迅速攪拌。觀察實驗現象。
可以看到蔗糖逐漸變黑,體積膨脹,形成疏鬆多孔的海綿狀的炭。
2.強氧化性
⑴跟金屬反應
①常溫下,濃硫酸能使鐵、鋁等金屬鈍化。
②加熱時,濃硫酸可以與除金、鉑之外的所有金屬反應,生成高價金屬硫酸鹽,本身一般被還原成SO2
Cu + 2H2SO4(濃) ==(加熱)== CuSO4 + SO2↑+ 2H2O
2Fe + 6H2SO4(濃) ==== Fe2(SO4)3 + 3SO2↑ + 6H2O
在上述反應中,硫酸表現出了強氧化性和酸性。
⑵跟非金屬反應
熱的濃硫酸可將碳、硫、磷等非金屬單質氧化到其高價態的氧化物或含氧酸,本身被還原為SO2。在這
類反應中,濃硫酸只表現出氧化性。
C + 2H2SO4(濃) ==(加熱)== CO2↑ + 2SO2↑ + 2H2O
S + 2H2SO4(濃) ==== 3SO2↑ + 2H2O
2P + 5H2SO4(濃) ==== 2H3PO4 + 5SO2↑ + 2H2O
⑶跟其他還原性物質反應
濃硫酸具有強氧化性,實驗室製取H2S、HBr、HI等還原性氣體不能選用濃硫酸。
H2S + H2SO4(濃) ==== S↓ + SO2↑ + 2H2O
2HBr + H2SO4(濃) ==== Br2↑ + SO2↑ + 2H2O
2HI + H2SO4(濃) ==== I2↑ + SO2↑ + 2H2O
3.吸水性
就硫酸而言,吸水性有很多用處,比如很多的氣體都可以用濃硫酸來乾燥。它是良好的乾燥劑。
這個與脫水性有很大的不同:脫水性一般反應前沒有水,而是H、O元素以個數比2:1的形式形成水,從有機物中出來。
而吸水性則是反應前就有水,只是在此過程中硫酸做了一個乾燥劑的作用。如:
CuSO4.5H2O→(H2SO4)→CuSO4+5H2O,這個反應,就是體現硫酸的吸水性,而不是脫水性,因為反應前有水。
還有在實驗室製取乙烯的過程中,體現濃硫酸的吸水性,促使反應向正反應方向進行。在一些硫酸作催化劑的反應中,尤其是是濃硫酸,一般都體現硫酸的吸水性。
將一瓶濃硫酸敞口放置在空氣中,其質量將增加,密度將減小,濃度降低,體積變大,這是因為濃硫酸 具有吸水性。
⑴就硫酸而言,吸水性是濃硫酸的性質,而不是稀硫酸的性質。
⑵濃硫酸的吸水作用,指的是濃硫酸分子跟水分子強烈結合,生成一系列穩定的水合物,並放出大量 的熱:H2SO4 + nH2O == H2SO4.nH2O,故濃硫酸吸水的過程是物理變化的過程,吸水性是濃硫酸的物理性質。
⑶濃硫酸不僅能吸收一般的游離態水(如空氣中的水),而且還能吸收某些結晶水合物(如CuSO4. 5H2O、Na2CO3.10H2O)中的水。
4.難揮發性(高沸點)
制氯化氫、硝酸等(原理:利用難揮發性酸制易揮發性酸) 如,用固體氯化鈉與濃硫酸反應製取氯化氫氣體
NaCl(固)+H2SO4(濃)====NaHSO4+HCl↑ (常溫)
2NaCl(固)+H2SO4(濃)====Na2SO4+2HCl↑ (加熱)
Na2SO3+H2SO4====Na2SO4+H2O+SO2↑
再如,利用濃鹽酸與濃硫酸可以制氯化氫氣體。
◎5酸性:制化肥,如氮肥、磷肥等
2NH3+H2SO4====(NH4)2SO4
Ca3(PO3)2+2H2SO4====2CaSO4+Ca(H2PO4)2
◎6.穩定性:濃硫酸與亞硫酸鹽反應
Na2SO3+H2SO4====Na2SO4+H2O+SO2↑
◆稀硫酸
化學性質
◎可與多數金屬(比銅活潑)氧化物反應,生成相應的硫酸鹽和水;
◎可與所含酸根離子對應酸酸性比硫酸根離子弱的鹽反應,生成相應的硫酸鹽和弱酸;
◎可與碱反應生成相應的硫酸鹽和水;
◎可與氫前金屬在一定條件下反應,生成相應的硫酸鹽和氫氣;
◎強電解質,在水中發生電離H2SO4=2H+ + SO4 2-
常見誤區
稀硫酸在中學階段,一般當成H2SO4=2H+ + SO4 2-,兩次完全電離,其實不是。
根據硫酸酸度係數
pKa1: -3.00
pka2:1.99
其二級電離不夠充分pka2:1.99,在稀硫酸中HSO4- 〓〓可逆〓〓H+ +SO4 2-
並未完全電離,1Mol/L的硫酸一級電離完全,二級電離大概電離10%左右,也就是溶液中仍存在大量的HSO4- 。而即使是NaHSO4溶液O.1Mol/L時,硫酸氫根也只電離了30%左右。
一般製法
■實驗室硫酸製法
可以用FeSO4.7H2O加強熱,用冰水混合物+U型管冷凝即可,用NaOH吸收SO2,理論可得29.5%的H2SO4
關鍵在於尾氣吸收。
■其他硫酸製備工藝
1、氨酸法增濃低濃度二氧化硫氣體生產硫酸方法
2、採用就地再生的硫酸作為催化劑的一體化工藝
3、草酸生產中含硫酸廢液的回收利用
5、從氧化鈦生產過程中排出的廢硫酸溶液的再生方法
7、從製備2-羥基-4-甲硫基丁酸(MHA)工藝的含硫副產物中回收硫酸的方法
8、催化氧化回收含有機物廢硫酸的方法
9、電瓶用硫酸生產裝置
10、二氧化硫源向硫酸的液相轉化方法
11、沸騰爐焙燒硫磺製備硫酸的方法
12、沸騰爐摻燒硫磺生產裝置中稀酸的回收利用
13、高濃二氧化硫氣三轉三吸硫酸生產方法
14、高溫濃硫酸液下泵耐磨軸套
15、高效陽極保護管殼式濃硫酸冷卻器
16、節能精鍊硫酸爐裝置
17、精苯再生酸焚燒製取硫酸的方法
18、利用廢硫酸再生液的方法和裝置
19、利用含硫化氫的酸性氣體與硫磺聯合製取高濃度硫酸
20、利用含硫化氫的酸性氣體製取高濃度硫酸
工業製法
生產硫酸的原料有硫黃、硫鐵礦、有色金屬冶煉煙氣、石膏、硫化氫、二氧化硫和廢硫酸等。硫黃、硫鐵礦和冶煉煙氣是三種主要原料。
1.燃燒硫或高溫處理黃鐵礦,製取二氧化硫
S+O2=(點燃)SO2
4FeS2+11O2=(高溫)8SO2+2Fe2O3
2.接觸氧化為三氧化硫
2SO2+O2=(△,V2O5)2SO3(該反應為可逆反應)
3.用98.3%硫酸吸收
SO3+H2SO4=H2S2O7(焦硫酸)
4.加水
H2S2O7+H2O=2H2SO4
■提純工藝
可將工業濃硫酸進行蒸餾,便可得到濃度95%-98%的商品硫酸.
其他方法
磷酸反應後,利用磷石膏,工業循環利用,使用二水法制硫酸。
硫酸新成員
固體硫酸 :是粉末製劑的固體酸類,可以替代硫酸的常規酸洗工藝,主要用於清除各種鋼鐵、不鏽鋼、銅、鋁等金屬零件及其設備表面的銹、氧化皮、水垢、灰垢等污物,特別是鋼鐵熱扎、冷扎過程中生成的高溫難清除氧化皮,清洗效果可以跟硫酸酸洗相媲美,最終使產品表面清潔乾淨;清洗過程中沒有煙霧產生,大大改善生產環境;對金屬的幾乎沒有腐蝕,對操作人員、設備、環境沒有任何危害。
發煙硫酸:H2SO4.XSO3即硫酸的三氧化硫溶液
無色至淺棕色粘稠發煙液體,其密度、熔點、沸點因SO3含量不同而異。
當它暴露於空氣中時,揮發出來的SO3和空氣中的水蒸汽形成硫酸的細小露滴而冒煙,所以稱之為發煙硫酸。
一般含SO3的質量分數有20%、40%、60%、66%等。若摺合成硫酸的質量分數則發煙硫酸中H2SO4可超過100%。有人認為發煙硫酸中主要含焦硫酸(H2S2O7)。具強氧化性和吸水性,脫水性及腐蝕性。用於合成染料、藥物。常用做磺化劑和吸水及脫水劑。
發煙硫酸中的物質成分複雜,除了硫酸和三氧化硫外,還有焦硫酸(H2S2O7)、二聚硫酸(H4S2O8)三聚硫酸(H6S3O12)及H4S3O15、H2S3O10、(H2SO4)20等各種各樣的硫酸聚合物。
20%發煙硫酸可在接觸法的硫酸廠中生產,就是在98.3%硫酸吸收塔前設置發煙硫酸吸收塔,以20%發煙硫酸吸收轉化後含三氧化硫7%~10%的氣體,同時向循環酸中補加98.3%硫酸,使其濃度保持不變。65%發煙硫酸可由20%發煙 硫酸和液體三氧化硫混合而得,或仿照20%發煙硫酸的製造方法,建立以65%發煙硫酸循環噴淋的吸收塔,吸收100%三氧化硫氣體,並補加20%發煙硫酸,以調節循環酸濃度。
緩慢加入純鹼-消石灰溶液中,並不斷攪拌,反應停止後,用大量水沖入廢水系統。
註:這是工業俗稱,準確的化學語言應該是揮發出霧。應該叫發霧硫酸。
化學品的檢驗
■所需藥品
經過鹽酸酸化的氯化鋇溶液
■檢驗方法
使用經過鹽酸(HCl)酸化的的氯化鋇(BaCl2)。向待測物溶液滴入幾滴經過鹽酸酸化的氯化鋇溶液,震蕩,如果產生白色沉澱,則證明它是硫酸。
■注意:
先滴加鹽酸,清除溶液中的銀離子,否則會干擾檢驗,也不可以用硝酸鋇檢驗,硝酸根離子在酸性條件下可以將亞硫酸根離子氧化為硫酸根離子,干擾檢驗。
■反應原理
◆硫酸根離子跟鋇離子能生成不溶於硝酸(或鹽酸)的白色硫酸鋇沉澱。例如:
H2SO4+BaCl2====BaSO4↓+2HCl
Na2SO4+BaCl2====BaSO4↓+2NaCl
Ba2+ +SO42-====BaSO4↓(離子方程式)
◆其他陰離子也有跟鋇離子生成白色沉澱的。例如:
Na2CO3+BaCl2====BaCO3↓+2NaCl
BaCO3外觀為白色沉澱與BaSO4不易區分,但它能跟鹽酸(HCl)反應而溶解。
BaCO3+2HNO3====Ba(NO3)2+CO2↑+H2O
BaCO3+2HCl====BaCl2+CO2↑+H2O
工業用硫酸的分類
目前工業用的硫酸一般可分為工業級,化學純CP,分析純AR,MOS級等級別
由於硫酸能與水以任意比例互溶,所以每個廠家所涉及的硫酸含量都有所不同,一般工業上用的工業級硫酸含量在10%,30%,50%,98%;CP級與AR級的硫酸含量一般為98%。
化學品的應用 ■為農業生產服務
◆用於肥料的生產硫酸銨(俗稱硫銨或肥田粉)和過磷酸鈣(俗稱過磷酸石灰或普鈣)這兩種化肥的生產都要消耗大量的硫酸。
2NH3+H2SO4====(NH4)2SO4
每生產一噸硫酸銨,就要消耗硫酸(摺合成100%計算)760kg,每生產一噸過磷酸鈣,就要消耗硫酸360kg。
◆用於農葯的生產許多農藥都要以硫酸為原料如硫酸銅、硫酸鋅可作植物的殺菌劑,硫酸鉈可作殺鼠劑,硫酸亞鐵、硫酸銅可作除莠劑。最普通的殺蟲劑,如1059乳劑(45%)和1605乳劑(45%)的生產都需用硫酸。前者每生產1t,需消耗20%發煙硫酸1.4t後者每生產1t,需消耗硫酸36kg。為大家所熟悉的滴滴涕,每生產1t需要20%發煙硫酸1.2t。
■為工業生產服務
◆用於冶金工業和金屬加工在冶金工業部門,特別是有色金屬的生產過程需要使用硫酸。例如用電解法精鍊銅、鋅、鎘、鎳時,電解液就需要使用硫酸,某些貴金屬的精鍊,也需要硫酸來溶解去夾雜的其他金屬。在鋼鐵工業中進行冷軋、冷拔及衝壓加工之前,都必須用硫酸清除鋼鐵表面的氧化鐵。在軋制薄板、冷拔無縫鋼管和其他質量要求較高的鋼材,都必須每軋一次用硫酸洗滌一次。另外,有縫鋼管、薄鐵皮、鐵絲等在進行鍍鋅之前,都要經過用硫酸進行酸洗手續。在某些金屬機械加工過程中,例如鍍鎳、鍍鉻等金屬製件,也需用硫酸來洗凈表面的銹。在黑色冶金企業部門裡,需要酸洗的鋼材一般約佔鋼總產量的5%~6%,而每噸鋼材的酸洗,約消費98%的硫酸30kg~50kg。
◆用於石油工業汽油、潤滑油等石油產品的生產過程中,都需要濃硫酸精鍊,以除去其中的含硫化合物和不飽和碳氫化合物。每噸原油精鍊需要硫酸約24kg,每噸柴油精鍊需要硫酸約31kg。石油工業所使用的活性白土的製備,也消耗不少硫酸。
◆在濃縮硝酸中,以濃硫酸為脫水劑;氯碱工業中,以濃硫酸來乾燥氯氣、氯化氫氣等;無機鹽工業中,如冰晶石(Na3AlF6)、硼砂(Na2B4O7.10H2O)、磷酸三鈉(Na3PO4)、磷酸氫二鈉(Na2HPO4)、硫酸鉛(PbSO4)、硫酸鋅、硫酸銅、硫酸亞鐵以及其他硫酸鹽的製備都要用硫酸。許多無機酸如磷酸、硼酸、鉻酸(H2CrO4,有時也指CrO3)、氫氟酸、氯磺酸(ClSO3H);有機酸如草酸[(COOH)2]、醋酸(CH3COOH)等的製備,也常需要硫酸作原料。此外煉焦化學工業(用硫酸來同焦爐氣中的氨起作用副產硫酸銨)、電鍍業、製革業、顏料工業、橡膠工業、造紙工業、油漆工業(有機溶劑的製備)、工業炸藥和鉛蓄電池製造業等等,都消耗相當數量的硫酸。
■對解決人民「穿」與「用」等問題所起的作用
◆用於化學纖維的生產為人民所熟悉的粘膠絲,它需要使用硫酸、硫酸鋅、硫酸鈉的混合液作為粘膠抽絲的凝固浴。每生產1t粘膠纖維,需要消耗硫酸1.2t~1.5t,每生產1t維尼龍短纖維,就要消耗98%硫酸230kg,每生產1t卡普綸單體,需要用1.6t20%發煙硫酸。此外,在尼龍、醋酸纖維、聚丙烯腈纖維等化學纖維生產中,也使用相當數量的硫酸。
◆用於化學纖維以外的高分子化合物生產塑料等高分子化合物,在國民經濟中越來越佔有重要的地位。每生產1t環氧樹脂,需用硫酸2.68t,號稱「塑料王」的聚四氟乙烯,每生產1t,需用硫酸1.32t;有機硅樹膠、硅油、丁苯橡膠及丁腈橡膠等的生產,也都要使用硫酸。
◆用於染料工業幾乎沒有一種染料(或其中間體)的製備不需使用硫酸。偶氮染料中間體的製備需要進行磺化反應,苯胺染料中間體的製備需要進行硝化反應,兩者都需使用大量濃硫酸或發煙硫酸。所以有些染料廠就設有硫酸車間,以配合需要。
◆用於日用品的生產生產合成洗滌劑需要用發煙硫酸和濃硫酸。塑料的增塑劑(如苯二甲酸酐和苯二甲酸酯)、賽璐珞製品所需的原料硝化棉,都需要硫酸來製備。玻璃紙、羊皮紙的製造,也需要使用硫酸。此外,紡織印染工業、搪瓷工業、小五金工業、肥皂工業、人造香料工業等生產部門,也都需要使用硫酸。
◆用於製藥工業磺胺葯物的製備過程中的磺化反應,強力殺菌劑呋喃西林的製備過程中的硝化反應,都需用硫酸。此外,許多抗生素的製備,常用藥物如阿斯匹林、咖啡因、維生素b2、b12及維生素c、某些激素、異煙肼、紅汞、糖精等的製備,無不需用硫酸。
■對鞏固國防方面所起的作用
某些國家硫酸工業的發展,曾經是和軍用炸藥的生產緊密連結在一起的。無論軍用炸藥(發射葯、爆炸藥)或工業炸藥,大都是以硝基化物或硝酸酯為其主要成分。主要的有硝化棉、三硝基甲苯(tnt)、硝化甘油、苦味酸等。雖然這些化合物的製備是依靠硝酸,但同時必須使用濃硫酸或發煙硫酸。
■與原子能工業及火箭技術的關係
原子反應堆用的核燃料的生產,反應堆用的鈦、鋁等合金材料的製備,以及用於製造火箭、超聲速噴氣飛機和人造衛星的材料的鈦合金,都和硫酸有直接或間接的關係。從硼砂製備硼烷的過程需要多量硫酸。硼烷的衍生物是最重要的一種高能燃料。硼烷又用做製備硼氫化鈾用來分離鈾235的一種原料。 由此可見,硫酸與國防工業和尖端科學技術都有著密切的關係。
■農業土質方面
在農業生產中,越來越多地採用硫酸改良高pH值的石灰質土壤。過去20年來,尿素-硫酸肥料的產量大幅度提高並在美國西部諸州的土壤中廣泛施用。將硫酸注入牛奶場湖泊,改變湖水pH值,可解決圈養牲畜過程產生的若干空氣和水質問題,將硫酸施入農用土壤和水中,其主要作用是溶解鈣、鎂的碳酸鹽和碳酸氫鹽。這些鈣、鎂鹽然後取代可交換的鈉鹽,鈉鹽隨後用水浸洗除去。當碳酸鹽和碳酸氫鹽被分解後,硫酸與更惰性的物質反應,釋放出磷、鐵等植物養分。簡單地降低土壤的pH值可引起許多元素溶解度的變化,提高它們對植物的效力。在高pH值的石灰質土壤上施用硫酸,可使植物更加健壯,收成增加。
相關應急措施
■急救措施
◆皮膚接觸:先用干布拭去,然後用大量水沖洗,最後用3%-5%NaHCO3溶液沖洗,嚴重時應立即送醫院。
◆眼睛接觸: 立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
◆吸入: 迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
◆食入: 用水漱口,給飲牛奶或蛋清。就醫。
◆注意:若皮膚直接接觸.用棉布先吸去皮膚上的硫酸,再用大量流動清水沖洗,最後用0.01%的蘇打水(或稀氨水)浸泡.切勿直接沖洗!
■消防措施
◆危險特性: 遇水大量放熱, 可發生沸濺。與易燃物(如苯)和可燃物(如糖、纖維素等)接觸會發生劇烈反應,甚至引起燃燒。遇電石、高氯酸鹽、雷酸鹽、硝酸鹽、苦味酸鹽、金屬粉末等猛烈反應,發生爆炸或燃燒。有強烈的腐蝕性和吸水性。
◆有害燃燒產物:二氧化硫。
◆滅火方法: 消防人員必須穿全身耐酸鹼消防服。
◆滅火劑:乾粉、二氧化碳、砂土。避免水流衝擊物品,以免遇水會放出大量熱量發生噴濺而灼傷皮膚。
■泄漏應急處理
應急處理: 迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防酸鹼工作服。不要直接接觸泄漏物。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。小量泄漏:用砂土、乾燥石灰或蘇打灰混合。也可以用大量水沖洗,洗水稀釋後放入廢水系統。大量泄漏:構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
注意事項
■危險性概述
◆健康危害: 對皮膚、粘膜等組織有強烈的刺激和腐蝕作用。蒸氣或霧可引起結膜炎、結膜水腫、角膜混濁,以致失明;引起呼吸道刺激,重者發生呼吸困難和肺水腫;高濃度引起喉痙攣或聲門水腫而窒息死亡。口服後引起消化道燒傷以致潰瘍形成;嚴重者可能有胃穿孔、腹膜炎、腎損害、休克等。皮膚灼傷輕者出現紅斑、重者形成潰瘍,愈後癍痕收縮影響功能。濺入眼內可造成灼傷,甚至角膜穿孔、全眼炎以至失明。慢性影響:牙齒酸蝕症、慢性支氣管炎、肺氣腫和肺硬化。
環境危害: 對環境有危害,對水體和土壤可造成污染。
◆燃爆危險: 本品助燃,具強腐蝕性、強刺激性,可致人體灼傷。
■操作處置
密閉操作,注意通風。操作儘可能機械化、自動化。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿橡膠耐酸鹼服,戴橡膠耐酸鹼手套。遠離火種、熱源,工作場所嚴禁吸煙。遠離易燃、可燃物。防止蒸氣泄漏到工作場所空氣中。避免與還原劑、鹼類、鹼金屬接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。稀釋或製備溶液時,應把酸加入水中,避免沸騰和飛濺。
■儲存
儲存於陰涼、通風的庫房。庫溫不超過35℃,相對濕度不超過85%。保持容器密封。應與易(可)燃物、還原劑、鹼類、鹼金屬、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
■廢棄處置
廢棄處置方法: 緩慢加入鹼液-石灰水中,並不斷攪拌,反應停止後,用大量水沖入廢水系統。
廢棄注意事項:
■運輸注意相關
◆危險貨物編號: 81007
◆UN編號: 1830
◆包裝類別: O51
◆包裝方法: 耐酸壇或陶瓷瓶外普通木箱或半花格木箱;磨砂口玻璃瓶或螺紋口玻璃瓶外普通木箱。
◆運輸注意事項: 本品鐵路運輸時限使用鋼製企業自備罐車裝運,裝運前需報有關部門批准。鐵路非罐裝運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與易燃物或可燃物、還原劑、鹼類、鹼金屬、食用化學品等混裝混運。運輸時運輸車輛應配備泄漏應急處理設備。運輸途中應防曝晒、雨淋,防高溫。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。
法律法規相關
化學危險物品安全管理條例 (1987年2月17日國務院發布),化學危險物品安全管理條例實施細則 (化勞發[1992] 677號),工作場所安全使用化學品規定 ([1996]勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌 (GB 13690-92)將該物質劃為第8.1 類酸性腐蝕品。
硫酸的發現
據我國科學家考證,在公元650~683年(唐高宗時),煉丹家孤剛子在其所著《黃帝九鼎神丹經訣》卷九中就記載著「煉石膽取精華法」,即乾餾石膽(膽礬)而獲得硫酸。若用化學方程式表示則為:
CuSO4.5H2O====CuSO4+5H2O
CuSO4====CuO+SO3↑
SO3+H2O====H2SO4
這一發現比西方早五六百年。
孤剛子不僅用這種硫酸分解過金礦,而且還發現了硫酸參與的許多驚奇的變化,如他知道稀硫酸對銅不能腐蝕的性質。
8世紀阿拉伯煉金家賈比爾發現,將硝石和綠礬一起蒸餾,所得氣體溶於水得硫酸。後來人們還發現某些礦泉中有濃厚的硫磺味道,可治療皮膚病,這是因為河水長期接觸硫鐵礦(FeS2)等,被緩慢氧化成微量H2SO4,使河水味道發酸。這個變化可表示為:
2FeS2+7O2+2H2O ====2H2SO4+2FeSO4
至於用硫磺燃燒(通過鉛室法)制硫酸,則是17世紀以後的事,而用接觸法制硫酸則更是19世紀以後才出現的。
硫酸純品為透明、無色、無嗅的油狀液體,有雜質顏色變深,甚至發黑。分子式H2SO4。分子量:98.08。其相對密度及凝固點也隨其含量變化而不同。相對密度1.841(96~98%)。凝固點10.35℃(100%)、3℃(98%)、-32℃(93%)、-38℃(78%)、-44℃(74%)、-64℃(65%)。沸點290℃。蒸氣壓0.13kPa(145.8℃)。對水有很大親和力。從空氣和有機物中吸收水分。與水、醇混合產生大量熱,體積縮小。用水稀釋時因把酸加到稀釋水中,以免酸沸濺。加熱到340℃分解成三氧化硫和水。
標準
車間空氣衛生標準: 中國MAC硫酸及三氧化硫 2mg/m^3; 美國ACGIH硫酸TLVTWA1mg/m^3,STEL 3mg/m^3
危規:硫酸GB8.1 類81007。原鐵規:一級無機酸性腐蝕物品。UN NO.1830。IMDG CODE 8220頁,8類。
發煙硫酸:GB8.1 類81006。原鐵規:一級無機酸性腐蝕物品,91006。UN NO.1831。IMDG CODE 8221頁,8類。
廢硫酸:GB8.1 類81009。UN NO.1832。IMDG CODE 8222頁,8類。
淤渣硫酸:GB8.1 類81009。UN NO.1906。IMDG CODE 8210頁,8類。
包裝標誌:腐蝕品。包裝方法:(II)類。玻璃瓶外木箱,酸壇外木格箱或鐵罐車運輸。儲運條件:硫酸應單獨儲存於通風、陰涼和乾燥的地方,並有耐酸地坪。避免日光直射。遠離火源。儲槽應有足夠的通氣孔,四周有「堤壩」圍住,以防儲罐泄漏。嚴禁與鉻酸鹽、氯酸鹽、電石、氟化物、高氯酸鹽、雷酸鹽、硝酸鹽、苦味酸鹽、金屬粉末、可燃物共儲混運。工作人員須穿戴耐酸工作服、橡皮圍裙、長統靴、手套及防護眼鏡和口罩。倉庫附近應裝有消防龍頭及水管。裝運時勿把水直接倒入硫酸,以防酸液爆炸性反應。
硫酸是重要的基礎化工原料之一,是化學工業中最重要的產品,主要用於製造無機化學肥料,其次作為基礎化工原料用於有色金屬的冶煉、石油精煉和石油化工、紡織印染、無機鹽工業、某些無機酸和有機酸、橡膠工業、油漆工業以及國防軍工、農藥醫藥、製革、煉焦等工業部門,此外還用於鋼鐵酸洗。
硫酸的特性及安全使用
(一)理化性狀和用途
無色油狀腐蝕性液體,有強烈的吸濕性。密度:1.8,熔點10.4℃,沸點: 280℃。用於製造硫酸銨、磷酸、硫酸鋁合成藥物、合成染料、合成洗滌劑合金屬酸洗劑。
(二)毒性
屬中等毒類。對皮膚粘膜具有很強的腐蝕性。
最高容許濃度:2 mg/m3
(三)短期過量暴露的影響
吸入:吸入高濃度的硫酸酸霧能上呼吸道刺激癥狀,嚴重者發生喉頭水腫、支氣管炎甚至肺水腫。
皮膚接觸:局部刺痛,皮膚由潮紅轉為暗褐色。
口服:誤服硫酸後,口腔、咽部、胸部和腹部立即有劇烈的灼熱痛,唇、口腔、咽部均見灼傷以致形成潰瘍,嘔吐物及腹瀉物呈黑色血性,胃腸道穿孔。口服濃硫酸致死量約為5毫升。
(四)長期暴露的影響
長期接觸硫酸霧者,可有鼻粘膜萎縮伴有嗅覺減退或消失、慢性支氣管炎和牙齒酸蝕等癥狀。
(五)火災和爆炸
本品雖不燃,但很多反應卻會起火或爆炸,如與金屬會產生可燃性氣體,與水混合會大量放熱。著火時立刻用乾粉、泡沫滅火等方法。
(六)化學反應性
本品為強氧化劑,與可燃性、還原性物質激烈反應。
(七)人身防護
吸入:硫酸霧濃度超過暴露限值,應佩戴防酸型防毒口罩。
眼睛:帶化學防濺眼鏡。
皮膚:戴橡膠手套,穿防酸工作服和膠鞋。工作場所應設安全淋浴和眼睛沖洗器具。
(八)急救
吸入: 將患者移離現場至空氣新鮮處,有呼吸道刺激癥狀者應吸氧。
眼睛:張開眼瞼用大量清水或2%碳酸氫鈉溶液徹底沖洗。
皮膚:用大量清水沖洗20分鐘以上。
註:所有患者應請醫生或及時送醫療機構治療。
(九)儲藏和運輸
與可燃性和還原性及強鹼物質分開。
包裝號為5(甲)、8(甲)(十)。
(十)安全和處理
注意對硫酸霧的控制,加強通風排氣。車間內要有方便的沖洗器具。
註:在稀釋酸時決不可將水注入酸中,只能將酸注入水中。
【對環境的影響】
一、健康危害
侵入途徑:吸入、食入。
健康危害:對皮膚、粘膜等組織有強烈的刺激和腐蝕作用。對眼睛可引起結膜炎、水腫、角膜混濁,以致失明;引起呼吸道刺激癥狀,重者發生呼吸困難和肺水腫;高濃度引起喉痙攣或聲門水腫而死亡。口服後引起消化道的燒傷以至潰瘍形成。嚴重者可能有胃穿孔、腹膜炎、喉痙攣和聲門水腫、腎損害、休克等。慢性影響有牙齒酸蝕症、慢性支氣管炎、肺氣腫和肺硬化。
二、毒理學資料及環境行為
毒性:屬中等毒性。
急性毒性:LD5080mg/kg(大鼠經口);LC50510mg/m3,2小時(大鼠吸入);320mg/m3,2小時(小鼠吸入)
危險特性:與易燃物(如苯)和有機物(如糖、纖維素等)接觸會發生劇烈反應,甚至引起燃燒。能與一些活性金屬粉末發生反應,放出氫氣。遇水大量放熱,可發生沸濺。具有強腐蝕性。
燃燒(分解)產物:氧化硫。
我國煙氣脫硫技術與應用
我國煙氣脫硫控制技術的研究開發始於60年代初,對燃煤電廠、燃煤工業鍋爐和冶金廢氣開展了煙氣脫硫工藝研究、設備研製,取得實驗室小試和現場中試結果。80年代以來,開展了一系列研究、開發和產業化工作。原國家科委組織了「七五」和「八五」攻關項目,對國際上現有脫硫技術主要方法進行研究和實用性工程裝置實驗;國家自然科學基金委員會設立課題支持脫硫技術的基礎研究,取得了很多成績。目前我國自行研究開發的煙氣脫硫方法,尚處在工業化示範試驗階段。國家科技部在「九五」期間,組織「中小鍋爐實用脫硫防塵技術與裝備研究及產業化」攻關課題,其中包括針對燃煤電廠煙氣脫硫技術,採用脈衝電暈等離子體煙氣脫硫新技術研究;與此同時,引進了脫硫技術項目,進行示範規模試驗和工業化運行應用。
我國電廠煙氣脫硫技術起步於1961年,科研院所和高等院校相繼投入研究開發力旦,進行於法、濕法和半干法等等的煙氣脫硫的探索研究,國家科技部(原國家科委)「七五」 「八五」和「九五」的脫硫專項支持取得極好進展。但目前我國自行開發的煙氣脫硫工程,尚處在小試、中試階段。工業化、產業化技術不多。
| 關於「硫酸」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |