病理學/壞死
| 醫學電子書 >> 《病理學》 >> 細胞和組織的損傷 >> 損傷 >> 壞死 |
| 病理學 |
|
|
生活機體的局部組織、細胞死亡後出現的形態學改變稱為壞死(necrosis)。壞死組織、細胞的代謝停止,功能喪失,出現一系列特徵性的形態學改 變。壞死的原因多種多樣,舉凡一切損傷因子,只要其作用達到一定的強度或持續一定的時間,從而使受損組織、細胞的代謝完全停止時,即引起組織、細胞的死亡 (壞死)。在多數情況下,壞死是由組織、細胞的變性逐漸發展而來的,即漸進性壞死(necrobiosis)。在此期間,只要壞死尚未發生而病因被消除, 則組織、細胞的損傷仍可能恢復(可復期)。但一旦組織、細胞的損傷嚴重,代謝紊亂,出現一系列壞死的形態學改變時,則損傷不再能恢復(不可復期)。
在個別情況下,由於致病因子極為強烈,壞死可迅速發生,有時甚至無明顯的形態學改變。例如將生活中的組織、細胞立即投入甲醛溶液中固定時,細胞迅即死亡,但形態上則保持完好。故單純從形態上有時難以判斷細胞是否死亡。
由 於損傷因子的性質不同,引起細胞死亡的途徑也各異:X線引起DNA螺旋的斷裂,導致細胞核信息中心的損害;CCl4通過過氧化物阻斷核蛋白合成的翻譯過 程;缺血阻斷粒線體的呼吸鏈;維生素A中毒使溶酶體酶外逸。因而,根據不同的損傷類型,某種細胞器的病變乃居於主要地位。
(一)壞死的病變
細胞壞死過程中的可復性改變與不可復性改變之間並無截然的界限,只有在損傷的後期,當出現明顯的形態學改變時,才能在電子顯微鏡下判斷細胞業已死亡。而在光學顯微鏡下,通常要在細胞死亡後若干小時之後,當自溶性改變相當明顯時才能加以辨別。
1. 細胞核的改變 細胞核的改變是細胞壞死的主要形態學標誌,表現為:①核濃縮(pyknosis),即由於核脫水使染色質濃縮,染色變深,核的體積縮小;②核碎裂 (karyorrhexis),核染色質崩解為小碎片,核膜破裂,染色質碎片分散在胞漿中;③核溶解(karyolysis),在脫氧核糖核酸酶的作用 下,染色質的DNA分解,核乃失去對鹼性染料的親和力,因而染色質變淡,甚至只能見到核的輪廓。往後染色質中殘餘的蛋白質被溶蛋白酶所溶解,核便完全消失 (圖1-23)。這一狀態約經10小時才能達到正常細胞核濃縮核碎裂核溶解消失
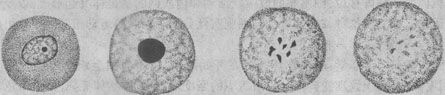
圖1-23 細胞壞死時核的變化模式圖
壞 死細胞核的上述變化過程可因損傷因子作用的強弱和發展過程的快慢而有所不同。損傷因子的作用較弱、病變經過緩慢時(如缺血栓梗死),上述核的改變可順序發 生,即先出現核濃縮,然後碎裂,最後核溶解;但如損傷因子作用強烈,經過急劇(如中毒),則往往先發生染色質邊集,繼即進入核碎裂,甚或可從正常核迅即發 生核溶解。
2.細胞漿的改變 壞死細胞的胞漿紅染(即嗜酸性),這是由於胞漿嗜鹼性物質核蛋白體減少或喪失,使胞漿與鹼性染料蘇木素的結合減少而與酸性染料伊紅的結合力增高的緣故。同 時由於胞漿結構崩解,致胞漿呈顆粒狀。有時由於實質細胞壞死後,整個細胞迅速溶解、吸收而消失(溶解性壞死)。有時單個實質細胞(如肝細胞)壞死後,胞漿 內水分逐漸喪失,核濃縮而後消失,胞體固縮,胞漿呈強酸性染色(紅染),形成所謂嗜酸性小體,稱為嗜酸性壞死或固縮壞死。
3.間質的改變實質細胞壞死後一段時間內,間質常無改變。以後在各種溶解酶的作用下,基質崩解,膠原纖維腫脹並崩解斷裂或液化。於是壞死的細胞和崩解的間質融合成一片模糊的顆粒狀、無結構的紅染物質。
上 述壞死的形態學改變通常要在組織、細胞死亡後相當時間(數小時至10小時以上)才出現。在壞死的早期階段,不僅肉眼觀難以鑒別,甚至在電子顯微鏡下也不能 確定該組織、細胞是否死亡。臨床上將這種已失去生活能力的組織稱為失活組織。這種組織已不能復活,但卻是細菌生長繁殖的良好基地。為防止感染,促進癒合, 在治療中常需將其清除。
(二)壞死的類型
形態學上可將壞死分為以下類型:
1. 局灶性胞漿壞死 並非任何致死性的細胞損傷均必然導致整個細胞的壞死。有時壞死僅局限於細胞的某一部位,稱為局灶性胞漿壞死。這種壞死區由界膜加以包裹,從而與周圍健康胞 漿相隔離。這樣,各種水解酶就可經內質網系統進入其中,將壞死結構加以溶解消化,而不致損傷細胞的其餘部分。
2.凝固性壞死 壞死組織由於失水變干、蛋白質凝固而變成灰白或黃白色比較堅實的凝固體,故稱凝固性壞死(coagulation necrosis)。特點是壞死組織的水分減少,而結構輪廓則依然較長時間地保存。
凝 固性壞死的發生機制仍不甚清楚。Weigert認為是胞漿凝固的結果,因為溶酶體酶在此不起重要作用,這是由於或則組織所含溶酶體較少,或則溶酶體酶在某 種程序上也受到了損傷的緣故。但在細胞僵死以前,在生體顯微鏡下可見到胞漿內的運動過程加強,表現為粒線體的一陣陣移位、細胞膜的波浪狀活動和內質網的偽 足樣突起形成,以及細胞核的旋轉運動。細胞的這種臨終期運動與細胞有絲分裂開始時的運動相同。因此可以說細胞的死亡與新生的過程是相似的。
凝 固性壞死的形態學:凝固性壞死灶在開始階段,由於周圍組織液的進入而明顯腫脹,透明度降低,組織紋理變模糊。爾後組織的堅度逐漸增加,狀如煮熟,呈土黃 色。這些改變最早要在細胞死亡開始後6~8小時以後才能見到。壞死灶的周圍形成一暗紅色緣(出血邊帶)與健康組織分界。鏡下,在較早期可見壞死組織的細胞 結構消失,但組織結構的輪廓依然保存。例如腎的貧血性梗死初期,雖然細胞已呈壞死改變,但腎小球、腎小管以及血管等的輪廓仍可辨認。脾的貧血性梗死也是如 此。
凝固性壞死的特殊類型:
(1)乾酪樣壞死(caseous necrosis, caseation):主要見於結核桿菌引起的壞死,如結核病灶的壞死。這時壞死組織徹底崩解,鏡下不見組織輪廓,只見一些無定形的顆粒狀物質(圖 1-24),同時由於壞死組織含有較多脂質(來自崩解的粒細胞和結核桿菌)故略帶黃色,加之脂質又阻抑了溶酶體酶的溶蛋白作用,故結果形成了狀如乾酪的物 質,因而得名。

圖1-24 乾酪性壞死(鏡下)
結核病灶中心的乾酪樣壞死,呈一片模糊細顆粒狀無結構物質
(2) 壞疽(gangrene):壞疽為組織壞死後又發生了繼發性改變的結果。當大塊組織壞死後,由於發生了不同程度的腐敗菌感染和其他因素的影響而呈現黑色、 污綠色等特殊形態改變,即成為壞疽。壞死組織經腐敗菌分散,產生硫化氫,後者與血紅蛋白中分解出來的鐵相結合,乃形成黑色的硫化鐵,使壞死組織呈黑色。壞 疽可分為此下3種類型:
1)乾性壞疽:乾性壞疽是凝固性壞死加上壞死組織的水分蒸發變乾的結果,大多見於四肢末端,例如動脈粥樣硬化、血栓 閉塞性脈管炎和凍傷等疾患時。此時動脈受阻而靜脈仍通暢,故壞死組織的水分少,再加上在空氣中蒸發,故病變部位干固皺縮,呈黑褐色,與周圍健康組織之間有 明顯的分界線(圖1-25)。同時,由於壞死組織比較乾燥,故既可防止細菌的入侵,也可阻抑壞死組織的自溶分解。因而乾性壞疽的腐敗菌感染一般較輕。
2) 濕性壞疽:濕性壞疽多發生於內臟(子宮、肺等),也可見於四肢(當其動脈閉塞而靜脈迴流又受阻,伴有淤血水腫時)。此時由於壞死組織含水分較多,適合腐敗 菌生長繁殖,故腐敗菌感染嚴重,局部明顯腫脹,呈深藍、暗綠或污黑色。腐敗菌分解蛋白質,產生吲哚(indole)、糞臭素(scatole)等,造成惡 臭。由於病變發展較快,炎症比較瀰漫,故壞死組織與健康組織的分界線不明顯。同時組織壞死腐敗所產生的毒性產物及細菌毒素被吸收後,可引起嚴重的全身中毒 症状。常見的濕性壞疽有壞疽性闌尾炎、腸壞疽、肺壞疽及產後壞疽性子宮內膜炎等。
3)氣性壞疽:為濕性壞死的一種特殊類型,主要見於嚴重的深達肌肉的開放性創傷合併產氣莢膜桿菌、惡生水腫桿菌及腐敗弧菌等厭氣菌感染時,細菌分解壞死組織時產生大量氣體,使壞死組織內含氣泡呈蜂窩狀,按之有捻發音。氣性壞疽發展迅速,毒素吸收多,後果嚴重,需緊急處理。
3. 液化性壞死 在液化性壞死(liquefaction necrosis)時,壞死組織起初腫脹,隨即發生酶性溶解,形成軟化灶。此時,壞死組織的水解佔主導地位。與凝固性壞死相反,液化性壞死主要發生在含可 凝固的蛋白質少和脂質多(如腦)或產生蛋白酶多(如胰腺)的組織。凝固性壞死的組織發生細菌感染時,則白細胞的水解酶也能引起組織溶解液化(如感染的肺梗 死)。
液化性壞死時,壞死組織分解液化而呈液化,並可形成壞死腔。
脂肪壞死:脂肪壞死為液化性壞死的一種特殊類型,主要有酶 解性脂肪壞死和外傷性脂肪壞死兩種。前者常見於急性胰腺炎時,此時胰腺組織受損,胰酶外逸並被激活,從而引起胰腺自身消化和胰周圍及腹腔器官的脂肪組織被 胰脂酶所分解,其中的脂肪酸與組織中的鈣結合形成鈣皂,表現為不透明的灰白色的斑點或斑塊。鏡下,壞死的脂肪細胞僅留下模糊混濁的輪廓。外傷性脂肪壞死則 大多見於乳房,此時由於脂肪組織受傷而致命傷脂肪細胞破裂,脂肪外逸,並常在乳房內形成腫塊,鏡下可見其中含有大量吞噬脂滴的巨噬細胞(泡沫細胞)和多核 異物巨細胞。
4.固縮壞死 固縮壞大多為細胞的生理性死亡,乃細胞衰老過程中各個細胞功能逐漸息滅的結果。這種壞死通常僅表現為單個細胞壞 死或小灶狀壞死,而從不見整個實質區細胞同時壞死,故可與樹葉的枯萎凋謝過程(apoptosis,凋落)相比擬。固縮壞死(凋落)的發生機制與上述凝固 性或液化性壞死均不同,而是由細胞的遺傳素質而決定的。根據遺傳素質,各種細胞損傷性刺激可改變遺傳信息的轉錄和(或)翻譯,形成死亡蛋白,後者能激活核 酸內切酶,引起核染色質的凝集,標誌著固縮性壞死的開始,不可復性的胞漿損害繼之發生。
固縮壞死即凋落見於許多生理和病理過程中,為各種更替性組織中細胞衰亡更新的表現,也可見於照射及應用細胞抑制劑之後和數目性萎縮時。腫瘤細胞也能自發地發生固縮壞死。
固 縮壞死的最初形態表現為染色質沿皺縮的核膜下凝聚,細胞連接松解,微絨毛及細胞突起消失;細胞表面有一些泡狀胞漿膨隆,可脫落形成凋落小體(圖 1-26),後者可見於腺腔內或被周圍健康細胞所吞噬(例如肝細胞內的Councilman小體);繼而內質網池擴大、斷裂,粒線體結構雖仍完好,但基質 呈絮狀緻密化。
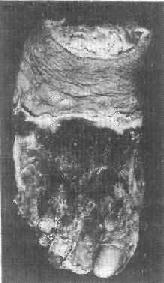
圖1-25 足乾性壞疽
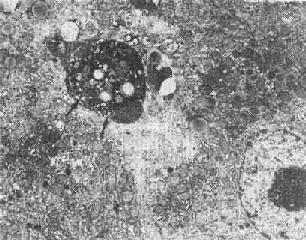
圖1-26 肝細胞凋落小體(左上)
圖中左上方電子緻密團塊(↑),其中可見脂滴及變性崩解細胞器。
其右側為一髓鞘樣結構
(三)壞死的結局
1. 溶解吸收 這是機體處理壞死組織的基本方式。來自壞死組織本身和中性粒細胞的溶蛋白酶將壞死物質進一步分解、液化,然後由淋巴管或血管加以吸收,不能吸收 的碎片則由巨噬細胞加以吞噬消化。留下的組織缺損則由細胞再生或肉芽組織形成予以修復或形成含有淡黃色液體的囊腔(如腦軟化灶)。
2.分離 排出 較大壞死灶不易完全吸收,其周圍發生炎性反應,其中的白細胞釋放溶蛋白酶,加速壞死邊緣壞死組織的溶解吸收,使壞死灶與健康組織分離。壞死灶如位於 皮膚的或粘膜,則壞死組織脫落後形成潰瘍;腎、肺等內臟器官壞死組織液化後可經相應管道(輸尿管、氣管)排出,留下空腔,稱為空洞。潰瘍和空洞以後仍可修 復。
3.機化(organization) 壞死組織如不能完全溶解吸收或分離排出,則由周圍組織新生毛細血管和纖維母細胞等組成肉芽組織,長入壞死,逐漸加以溶解、吸收和取代,最後成為瘢痕組織。這種由新生肉芽組織取代壞死組織(或其他異物如血栓等)的過程稱為機化。
4.包裹、鈣化 壞死灶如較大,或壞死物質難以溶解吸收,或不能完全機化,則常由周圍新生結締組織加以包裹(encapsulation),其中的壞死物質有時可發生鈣化(calcification),如結核病灶的乾酪樣壞死即常發生這種改變。
參考
| 關於「病理學/壞死」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |