臨床生物化學/載脂蛋白組成與結構特點及生理功用
| 醫學電子書 >> 《臨床生物化學》 >> 血漿蛋白及其代謝紊亂 >> 載脂蛋白 >> 載脂蛋白組成與結構特點及生理功用 |
| 臨床生物化學 |
|
|
|
Apo種類很多,一般分為5-7類,其胺基酸序列大多數已闡明,Apo種類的命名是按1972年Alaupovic建議的命名方法,用英文字母順序編碼,即ABC順,每一類還有亞類。
(一)載脂蛋白A族
ApoA可分為ApoAⅠ,AⅡ,AⅣ。ApoAⅠ和AⅡ大部分分布在HDL中,是HDL的主要載脂蛋白。
1.ApoAⅠApoAⅠ是ApoA族最多的一種組份,先後從人HDL中分離純化得到ApoAⅠ,並闡明了ApoAⅠ的胺基酸序列,也預測了其二級結構的要點。人成熟的ApoAⅠ由243個胺基酸殘基組成,是單一多肽鏈,分子量為28.3ku。人及大鼠、猴、兔、牛、鴨、樹鼷等動物的ApoAⅠ已分離純化。人和其他種屬的ApoAⅠ的氨基末端為Asp,羧基末端為Gln,其分子中不含半胱氨酸和異亮氨酸。經等電點聚焦電泳證實,人和動物的ApoAⅠ都是不均一的,有10種不同的亞組份,至少有6種多態性。
目前所知,ApoAⅠ的胺基酸殘基的排列有其自身的特徵:①極性胺基酸殘基含量較多,並以1,2或1,4相反離子對的形式排列,即Glu-Arg、Glu-Lys或Asp=lys、Asp-Arg。②疏水胺基酸殘基一對對地出現在1,2或1,4反離子對的附近,因此很容易形成特有的雙性螺旋二級結構。極性與非極性胺基酸殘基排列的方式是載脂蛋白的一個共性。由疏水胺基酸殘基組成螺旋的非極性面,由帶電荷親水的胺基酸殘基組成螺旋極性面,故稱為雙性螺旋。與一般蛋白質的α-螺旋不同,這種雙性螺旋既有親脂的一面又有親水的一面。ApoAⅠ富含雙性螺旋結構,對於維持其正常的生理功能是非常重要的。
ApoAⅠ主要存在於HDL中,在HDL3中ApoAⅠ占載脂蛋白的65%,在HDL2中ApoAⅠ占載脂蛋白的62%,在CM、VLDL和LDL中也有少量存在。血漿中呈現β遷移率的一種β-HDL,其內80%為ApoAⅠ。
Ⅰ的生理功能有:①組成載脂蛋白並維持其結構的穩定性與完整性。實驗表明,純化的ApoAⅠ在水溶液中可以自發地和脂類結合。用CNBr法將ApoAⅠ裂解成四個肽段,發現僅有羧基末端的肽段可自發和磷脂結合。後來進一步確認這一段是ApoAⅠ224-242段,這一段既可維持雙性螺旋的結構,又可以維持和脂質結合所具備的疏水性。②ApoAⅠ可以激活卵磷脂膽固醇醯基轉移酶(LCAT)的活性。已經證實,ApoAⅠ是通過激活LCAT,再催化膽固醇酯化。ApoAⅠ肽段Ⅲ(肽段116-151)是激活作用的中心。③ApoAⅠ可作為HDL受體的配體,含ApoAⅠ脂蛋白可以和轉鐵蛋白及銅藍蛋白形成大分子複合物以運輸鐵和銅離子。
2.ApoAⅡApoAⅡ是HDL中第二種含量多的載脂蛋白,在HDL2中占載脂蛋白的15%,在HDL3中占載脂蛋白25%,在CM中占載脂蛋白的7%-10%,VLDL中也存在少量。到1985年,ApoAⅡ蛋白質的胺基酸序列,cDNA序列及基因序列均已闡明。ApoAⅡ是由兩條多肽鏈的77個胺基酸殘基組成。ApoAⅡ在不加還原劑的SDS-PAGE中測出分子量是17ku,在人血漿中以二聚體形式存在。ApoAⅡ的單體分子量為8.7ku。ApoAⅡ蛋白的C端胺基酸殘基為谷氨酸,N端為吡咯烷酮酸,缺乏組氨酸、精氨酸及色氨酸。ApoAⅡ有多態性存在。
ApoAⅡ生理功能是:①維持HDL結構,ApoAⅡ肽段12-31和肽段50-77具有與磷脂結合的能力。經二級結構分析認為,殘基17-30和51-62形成的雙性螺旋結構是人ApoAⅡ與脂質結合的分子基礎。②激活肝脂酶,用以水解CM和VLDL中的TG和PL。還有報導,ApoAⅡ可抑制LCAT活性。
ApoAⅡ由肝和小腸合成。人血漿中的ApoAⅡ生物半壽期為4.4天。
3.ApoAⅣ最先從大鼠HDL和CM中發現載脂蛋白AⅣ,以後證實人血漿中也有ApoAⅣ存在,主要分布於密度大於1.211g/ml部分。成熟ApoAⅣ由376個胺基酸殘基組成。經SDS-PAGE確認大鼠和人ApoAⅣ分子量為44-46ku。人和大鼠胺基酸組成相似,是一種糖蛋白,含有6%的碳水化合物,其中甘露醇佔1.8%,半乳糖佔1.55%,N-乙醯葡萄糖胺佔1.55%,唾液酸佔1.1%。ApoAⅣ有多態性存在,生物半壽期為10小時。
ApoAⅣ生理功能目前尚不完全清楚,據推測ApoAⅣ在膽固醇逆向轉運過程中起著重要作用。體外的ApoAⅣ可以促進LCAT的膽固醇酯化反應,並認為是LCAT的激活劑。ApoAⅣ由肝和小腸合成,並有五種多態型。
(二)Apob族
體外實驗表明,ApoB是難溶於水的蛋白質。目前所知,ApoB族可分為兩個亞類,即ApoB48和ApoB100。ApoB主要成分是B100,其次為B48,其它形式的如ApoB75、ApoB41、ApoB36等均為ApoB100的不同降解產物。
1.ApoB100ApoB是單鏈糖蛋白,分子量為51ku,主要在肝,少數在小腸合成。ApoB100由4536個胺基酸殘基組成。包括27個(或24)胺基酸信號肽和4536個胺基酸殘基的成熟單體蛋白。1986年ApoB100的全部胺基酸殘基排列順序及結構已經闡明。當年已測出ApoB100的cDNA序列,ApoB100分子中含有25個Cys殘基。其中有11個Cys殘基集中分布在前面500胺基酸組成區域,形成鏈內二硫鍵,所以N端高度交聯成典型球形結構。Cys殘基通過硫酯鍵與軟脂酸、硬脂酸相結合,使ApoB牢固地連接著脂質成分。ApoB100中,對脂類結合十分必要的區域結構在203-2506和4002-4527胺基酸殘基之間。兩個結構區域重複出現兩性親脂α-螺旋區段;另有一種結合脂質的重要結構是含疏水和親水性胺基酸交替排列的兩性親脂β-摺疊結構。這種結構分布在整個分子序列中,但集中於四個富含脯氨酸區,這種富含脯氨酸的重複序列是ApoB所特有的,使ApoB能夠將磷脂側鏈深埋其間並使之緊密結合。由於ApoB的兩性α-螺旋和富含脯氨酸的疏水肽以及可被脂醯化的Cys殘基形成的特殊結構,在VLDL和LDL從分泌到被清除的整個過程中,使α-螺旋能夠與單層極性脂牢固地結合,從而使其不在脂蛋白分子間轉換,這是與其他載脂蛋白不同之處。
ApoB100的生理功能有:①合成裝配和分泌富含甘油三酯的VLDL;②是LDL的結構蛋白。③LDL受體的配體,並可調節LDL從血漿中的清除速率。
2.ApoB48ApoB48因分子量是ApoB100的48%而得名。存在於CM中,不與其他脂蛋白分子交換。ApoB48在小腸合成,是組裝CM所必需的載脂蛋白。小腸細胞分泌CM後進入淋巴液,並通過胸導管再進入血液循環,再分布到毛細血管的內皮細胞,主要是骨骼肌體和脂肪組織的內皮細胞,脂肪酶可水解CM中甘油三酯的80%-90%,剩下的脂蛋白顆粒則稱為CM殘粒,尓後送到肝,被肝脂酶進一步代謝,最後被能夠識別ApoE的殘粒受體攝取。該殘粒受體是LDL受體,還是與LDL受體相關的蛋白或其他蛋白質,目前尚不清楚。
人血漿中ApoB48生物半壽期僅5-10分鐘,分解速度很快,血漿中的濃度很低,約相當於ApoB100的0.1%。經SDS-PAGE電泳染色在VLDL組分中可檢出痕量的ApoB48。進食豐富的脂肪後,ApoB48/ApoB100比值明顯增加。
(三)ApoC族
ApoC是目前所知載脂蛋白中分子量最小的一類。最先從VLDL中分離出一種含有少量磷脂的低分子量載脂蛋白,並命名為載脂蛋白C。此後雙在HDL中發現有ApoC,並進一步確認ApoC有三種亞型,即ApocⅠ、Ⅱ、Ⅲ。
Apoc是由57個胺基酸殘基組成的單一多肽鏈,其序列已測出,不含半胱氨酸、組氨酸和酪氨酸。分子量為6625u。人ApoCⅠ二級結構中有55%α-螺旋結構,極易與磷脂結合,它是LCAT的激活劑。
ApoCⅡ是由79個胺基酸殘基組成單一多肽鏈,胺基酸順序已測出,分子量為9110u,有兩種多態型,pⅠ分別為4.86和4.69。不含半胱氨酸和絲氨酸,其二級結構的α-螺旋約佔23%。ApoCⅡ可激活多種來源的脂蛋白脂肪酶(LPL),其結構中第55-78位胺基酸殘基是維持其對LPL激活作用的最短的必須區域。羧基端43-50位胺基酸殘基為α-螺旋結構的脂質結合區。
ApoCⅢ由79個胺基酸殘基組成單一多肽鏈,由於第74位蘇氨酸殘基所帶唾液酸個數不同,又可分為ApoCⅢ0、CⅢ1、CⅢ2三個亞類,也是其多態性,等電點分別為5.02,4.82和4.62。ApoCⅢ胺基酸序列已測出,分子量為8764u,其二級結構在不同狀態下,α-螺旋約佔22%-54%不等。ApoCⅢ的α-螺旋結構極易與磷脂結合。
ApoC族生理功能有:①同磷脂相互作用,維持脂蛋白結構:在溶液中呈特殊的立體雙性離子,帶負電荷的酸性胺基酸與磷脂帶正電荷的基團作用,具有很強的磷脂結合活性。由於與磷脂的相互作用,使ApoC族的α-螺旋結構增加,而磷脂的單個酯醯鏈的運動則受到限制,從而影響磷脂從凝膠態到液晶態的轉變,兩者作用的結果,從而固系了脂蛋白的結構;②對酯酶有激活作用,HDL的磷脂在流動性增加時,ApoCⅠ通過HDL脂層表面後促進了LCAT的催化作用;③ApoCⅡ可以激活LPL,其激活機制可能是:LPL通常與外周循環肝素樣分子結合併附著於血管內皮上,當LPL接觸CM或VLDL時,LPL便同脂蛋白顆粒表面的磷脂發生作用,進而結合於脂蛋白顆粒上,其內的ApoCⅡ與LPL發生作用,改變LPL的空間結構,進而催化水解甘油三酯。
Apoc主要由肝合成,小腸也合成少量。
(四)ApoE
ApoE是一種富含精氨酸的鹼性蛋白,人AppE由299個胺基酸殘基組成,分子量為34.145ku,含32個Arg和12個Lys,存在於血漿CM、VLDL及其殘粒中,β-VLDL中含ApoE量高於VLDL,一部分ApoE在血液中與ApoAⅡ形成複合體。已測出ApoE的蛋白質一級結構,建立ApoE和cDNA序列,並確認ApoE有3個等位基因異構體以及基因在染色體上的定位。據推算和測定,在溶液中ApoE有62%的α-螺旋、9%的β-片層、11%的β-轉角和18%的無規則線團。ApoE分子可以被凝血酶水解為N-端和C-端兩個區域,N-端區(1-191)為22ku的可溶性球蛋白,此區域較穩定;C-端區(216-299)分子量為10ku,螺旋程度很高,不穩定,是與脂蛋白的結合區,ApoE主要由肝臟合成,近年來發現腦、腎、骨骼、腎上腺及巨噬細胞也能合成ApoE。
ApoE生理功能有:①是LDL受體的配體,也是肝細胞CM殘粒受體的配體,它與脂蛋白代謝密切相關;②ApoE具有多態性,多態性與個體血脂水平及動脈粥樣硬化發生髮展密切相關。
(五)Apo(a)
早期測定脂蛋白(a)[LP(a)]在人群分布率為30%。目前採用更靈敏的方法發現幾乎存在於所有人群中,僅是血漿深度差異很大,波動在0-1000mg/L的範圍。1987年克隆了人Apo(a)的基因序列,並推導出胺基酸序列,提示Apo(a)的分子結構與纖溶酶原極為相似。Apo(a)含有一個疏水信號序列,37個Kringle-4拷貝、1個Kringle-5及1個胰蛋白酶樣區。第36個Kringle-4含有一個額外未配對半胱氨酸,推測此處可能是Apo(a)以二硫鍵與ApoB結合的部位。經胰蛋白酶限制性水解Apo(a)發現,Apo(a)中的Krtingle-4有75%-85%的胺基酸與纖溶酶原的第391-472個氨基相同,有共同的抗原簇,兩者表現有交叉反應。纖溶酶原(PG)是一種絲氨酸蛋白酶原,含有791個氨酸殘基,結構中含有5個富含半胱氨酸的「Kringle」樣結構,即Kringle1-5,在Kringle-5的後面為一絲氨酸蛋白酶區。PG與Apo(a)結構相似,如圖4-3所示。
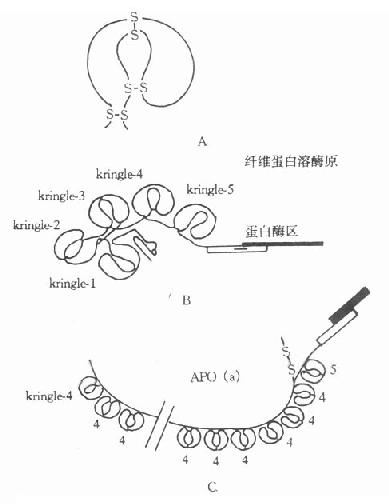
圖4-3 載脂蛋白(a)結構示意圖
Kringle結構是三對二硫鍵組成的三套環形結構,含有78-82個胺基酸殘基,因其序列的書寫形式酷似一種丹麥面糕而得名。在其第1與第6、第2與第4、第3與第5半胱氨酸上,連成三個硫鍵。這種結構也出現在前凝血酶、尿激酶、鏈激酶和纖溶酶原激活劑(t-PA)的組份中。由於Apo(a)分子中的Kringle-4數目可在15-27之間變化,從而導致Apo(a)有多種不同的異構體。
Apo(a)結構中有一蛋白酶區,推測其功能可能是一種酶。在分子中相當於PG蛋白酶的絲氨酸被精氨酸代替,可使其喪失酶的功能。由於Kringle結構與PG相似,推測Apo(a)可能結合到象PG受體或纖維蛋白那樣的大分子上,再加上LP(a)顆粒攜帶的膽固醇結合到血管損傷部位,因此它不僅促進動脈粥樣硬化形成,也阻礙血管內凝血塊的溶解。
| 關於「臨床生物化學/載脂蛋白組成與結構特點及生理功用」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |