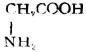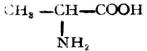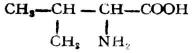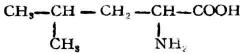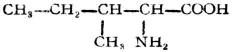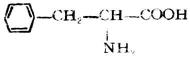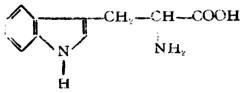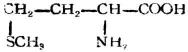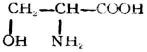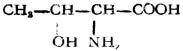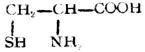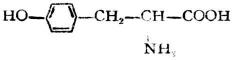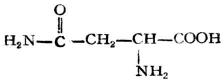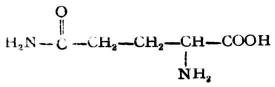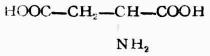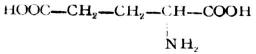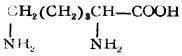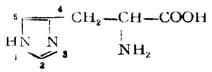醫用化學/胺基酸
| 醫學電子書 >> 《醫用化學》 >> 含氮有機化合物 >> 胺基酸 |
| 醫用化學 |
|
|
胺基酸是一類具有特殊重要意義的化合物。因為它們中許多是與生命活動密切相關的蛋白質的基本組成單位,是人體必不可少的物質,有些則直接用作藥物。
α-胺基酸是蛋白質的基本組成單位。蛋白質在酸、鹼或酶的作用下,能逐步水解成比較簡單的分子,最終產物是各種不同的α-胺基酸。水解過程可表示如下:
由蛋白質水解所得到的α-胺基酸共有20多種,各種蛋白質中所含胺基酸的種類和數量都各不相同。有些胺基酸在人體內不能合成,只能依靠食物供給,這種胺基酸叫做必需胺基酸(見表18-3,*)。
一、胺基酸的構造、構型及分類、命名
(一)胺基酸的構造和構型
分子中含有氨基和羧基的化合物,叫做胺基酸。
由蛋白質水解所得到的α-胺基酸,可用通式表示如下:
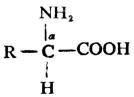
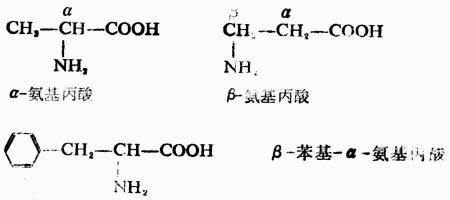
除甘氨酸(R=H)外,所有α-胺基酸中的α碳原子均是手性碳,故有D型與L型兩種構型。天然胺基酸均為L-胺基酸。
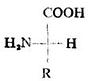
L-胺基酸
(二)α-胺基酸的分類和命名
胺基酸有脂肪族胺基酸、芳香族胺基酸和雜環胺基酸。
在α-胺基酸分子中可以含多個氨基和多個羧基,而且氨基和羧基的數目不一定相等。因此,天然存在的α-胺基酸常根據其分子中所含氨基和羧基的數目分為中性胺基酸、鹼性胺基酸和酸性胺基酸。所謂中性胺基酸是指分子中氨基和羧基的數目相等的一類胺基酸。但氨基的鹼性和羧基的酸性不是完全相當的,所以它們並不是真正中性的物質,只能說它們近乎中性。分子中氨基的數目多於羧基時呈現鹼性,稱為鹼性胺基酸;反之,氨基的數目少於羧基時呈現酸性,稱為酸性胺基酸。
胺基酸的系統命名方法與羥基酸一樣,但天然胺基酸常根據其來源或性質多用俗名。例如胱氨酸是因它最先來自尿結石;甘氨酸是由於它具有甜味而得名(見表18-3)。
表18-3 常見的α-胺基酸
| 氨 基 酸 | 構 造 式 | 代號 | 常用符號 | pI |
| 甘氨酸(α-氨基乙酸) |
|
甘 | Giy | 5.97 |
| 丙氨酸(α-氨基丙酸) |
|
丙 | Ala | 6.02 |
| 纈氨酸(β-甲基-α-氨基丁酸) |
|
纈 | Val | 5.96 |
| 亮氨酸(γ-甲基-α-氨基戊酸) |
|
亮 | Len | 5.98 |
| 異亮氨酸(β-甲基-α-氨基戊酸) |
|
異 | Lle | 6.02 |
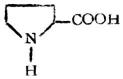
| 脯氨酸(α-羧基四氫吡咯) |
|
脯 | Pro | 6.30 |
| 苯丙氨酸(β-苯基-α-氨基丙酸) |
|
苯 | Phe | 5.48 |
| 色氨酸[α-氨基-β-(3-吲哚基)丙酸] |
|
色 | Try (Trp) | 5.89 |
| 蛋氨酸(α-氨基-γ-甲硫基丁酸) |
|
蛋 | Met | 5.74 |
| 絲氨酸(α-氨酸-β-羥基西丙酸) |
|
絲 | Ser | 5.68 |
| 蘇氨酸(α-氨基-β-羥基丁酸) |
|
蘇 | Thr | 6.18 |
| 半胱氨酸(α-氨基-β-巰基丙酸) |
|
半 | Cys | 5.07 |
| 酪氨酸[α-氨基-β-(對羥苯基)丙酸] |
|
酪 | Tyr | 5.66 |
| 天門冬醯胺(α-氨基丁醯胺酸) |
|
天醯 | Asn | 5.41 |
| 谷氨醯胺(α-氨基戊醯胺酸) |
|
谷醯 | Gln | 5.65 |
| 天門冬氨酸(α-氨基丁二酸) |
|
天 | Asp | 2.77 |
| 谷氨酸(α-氨基戊二酸) |
|
谷 | Glu | 3.22 |
| 賴氨酸(α,ε-二氨基已酸) |
|
賴 | Lys | 9.74 |
| 組氨酸[(α-氨基-β-(4-噗唑基)丙酸] |
|
組 | His | 7.59 |
| 傅氨酸(α-氨基,δ-胍基戊酸) |
|
精 | Arg | 10.76 |
二、胺基酸的性質
α-胺基酸都是無色晶體,熔點一般都較高(常在230-300℃之間),熔融時即分解放出二氧化碳。
α-胺基酸都能溶於酸性或鹼性溶液中,但難溶於乙醚等有機溶劑。在純水中各種胺基酸的溶解度差異較大,加乙醇能使許多胺基酸從水溶液中沉澱析出。
(二)化學性質
胺基酸分子內既含有氨基又含有羧基,因此它們具有氨基和羧基的典型性質。但是,由於兩種官能團在分子內的相互影響,又具有一些特殊的性質。
1.兩性
胺基酸分子中既有鹼性-NH2和酸性-COOH,與強酸或強鹼都能作用生成鹽,因此胺基酸為兩性化合物。
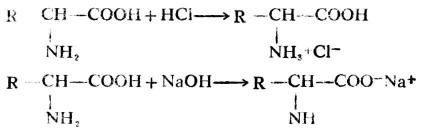
同時,在同一分子內,氨基和羧基也可作用生成鹽,這種鹽叫內鹽。
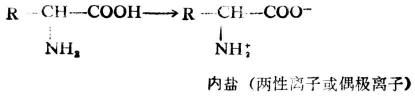
胺基酸在純水溶液及固態時都以內鹽的形式存在。在一般情況下,胺基酸中羧基的電離程度和氨基的電離程度並不相等。因此純淨胺基酸的水溶液並不一定是中性。在中性胺基酸溶液中,由於羧基的電離程度稍大於氨基的電離度,故它的水溶液的PH值一般略小於7。酸性胺基酸水溶液的PH值小於7;鹼性胺基酸水溶液的PH值則大於7。但須注意,無論是何種α-胺基酸,其水溶液中兩性離子都占絕對多數。
2.等電點
若將胺基酸的水溶液酸化,則兩性離子與H+結合而成陽離子,若加鹼於胺基酸的水溶液中,則兩性離子中氮原子上的一個氫離子與OH-結合成水,而兩性離子變成陰離子。
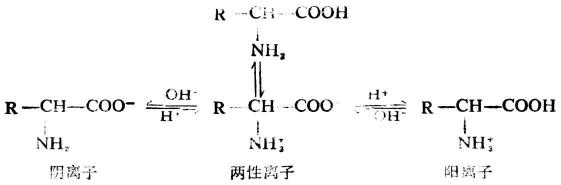
若將胺基酸水溶液的酸鹼度加以適當調節,可使羧基與氨基的電離程度相等,也就是胺基酸帶有正、負電荷數目恰好相同,此時溶液的PH值稱為該胺基酸的等電點,以PI表示。由於各種胺基酸分子中所含基團不同,所以每一個胺基酸中氨基和羧基的電離程度各異,因此不同的胺基酸等電點亦不同(表18-3)。中性胺基酸的等電點一般在5.0-6.5之間;酸性胺基酸為2.7-3.2,鹼性胺基酸為9.5-10.7。
如果在不同的PH值的胺基酸溶液中通以直流電,當PH>PI(到一定程度)時,由於胺基酸主要以陰離子存在,它們就向陽極移動;若PH<PI(到一定程度)時,因胺基酸主要以陽離子存在,則它們就向陽極移動;如果PH=PI,則不發生電泳,因為這時的胺基酸主要以兩性離子存在,其淨電荷為零,故在電場中不會向任何一極移動。所以,電泳是可以用來分離子或鑒定胺基酸、蛋白質等的混合物的一種技術,也可作為醫學診斷的手段。
3.脫水生成肽
兩分子α-胺基酸(相同或不同)可借一個分子中的羧基和另一分子中的氨基脫去一分子水,縮合成為一個簡單的肽,即二肽。
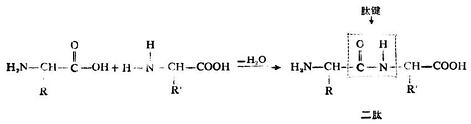
二肽分子中含有的醯胺鍵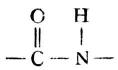
叫做肽鍵。二肽分子中的末其端
仍含有自由的氨基和羧基,因此還可以繼續與胺基酸縮合成為三肽、四肽以至多肽。
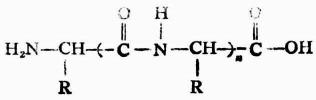
多肽
多肽類物質在天然界中存在很多,它們在生物體中起著各種不同的作用。例如,存在於大部分細胞中的谷胱甘肽(三肽),參與細胞的氧化還原過程。
4.脫羧作用
某些胺基酸在一定條件下,可脫去羧基,生成相應的胺。
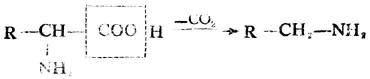
脫羧反應是人體內胺基酸代謝的形式之一,例如在腸道細菌作用下,組氨酸可脫羧生成組胺。
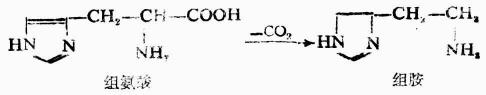
脫羧反應也可在蛋白質腐敗時發生。例如在某些細菌作用下,蛋白質中的賴氨酸可變成毒性很強的屍胺(戊二胺)。
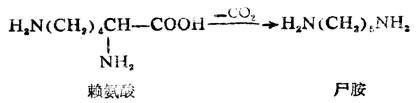
5.與亞硝酸的反應
胺基酸中的氨基具有伯胺的性質,與亞硝酸作用時生成羥基酸,同時定量的放出氮氣。
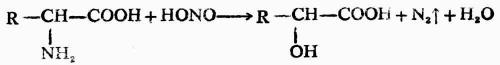
6.與茚三酮的顯色反應
α-胺基酸與茚三酮的水合物在水溶液中加熱時,生成藍紫色或紫色化合物,同時產生醛、二氧化碳和氨。這個反應非常靈敏,是鑒定胺基酸最迅速、最簡單的方法,常用於α-胺基酸的比色測定或紙層析、薄層層析時的顯色。
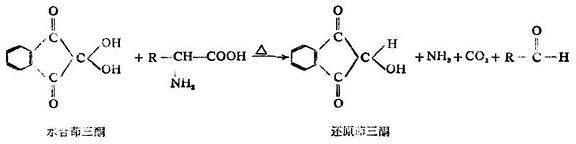
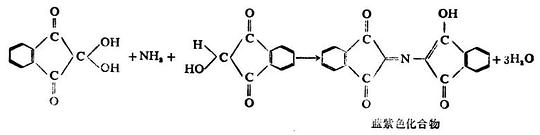
多肽和蛋白質也有此顯色反應。
參看
| 關於「醫用化學/胺基酸」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |