生物化學與分子生物學/蛋白質的理化性質
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質化學 >> 蛋白質的理化性質 |
| 生物化學與分子生物學 |
|
|
蛋白質是由胺基酸組成的大分子化合物,其理化性質一部分與胺基酸相似,如兩性電離、等電點、呈色反應、成鹽反應等,也有一部分又不同於胺基酸,如高分子量、膠體性、變性等。
目錄 |
一、蛋白質的膠體性質
蛋白質分子量頗大,介於一萬到百萬間,故其分子的大小已達到膠粒1~100nm範圍之內。球狀蛋白質的表面多親水基團,具有強烈地吸引水分子作用,使蛋白質分子表面常為多層水分子所包圍,稱水化膜,從而阻止蛋白質顆粒的相互聚集。
與低分子物質比較,蛋白質分子擴散速度慢,不易透過半透膜,粘度大,在分離提純蛋白質過程中,我們可利用蛋白質的這一性質,將混有小分子雜質的蛋白質溶液放於半透膜製成的囊內,置於流動水或適宜的緩衝液中,小分子雜質皆易從囊中透出,保留了比較純化的囊內蛋白質,這種方法稱為透析(dialysis)。
蛋白質大分子溶液在一定溶劑中超速離心時可發生沉降。沉降速度與向心加速度之比值即為蛋白質的沉降係數S。校正溶劑為水,溫度20℃時的沉降係數S20.w可按下式計算:
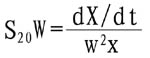
式中X為沉降界面至轉軸中心的距離,W為轉子角速度,W2X為向心加速度,dX/dt為沉降速度。單位用S,即Svedberg單位,為1×1013秒,分子愈大,沉降係數愈高,故可根據沉降係數來分離和檢定蛋白質。
二、蛋白質的兩性電離和等電點
蛋白質是由胺基酸組成的,其分子中除兩端的游離氨基和羧基外,側鏈中尚有一些解離基,如谷氨酸、天門冬氨酸殘基中的γ和β-羧基,賴氨酸殘基中的ε-氨基,精氨酸殘基的胍基和組氨酸的咪唑基。作為帶電顆粒它可以在電場中移動,移動方向取決於蛋白質分子所帶的電荷。蛋白質顆粒在溶液中所帶的電荷,既取決於其分子組成中鹼性和酸性胺基酸的含量,又受所處溶液的pH影響。當蛋白質溶液處於某一pH時,蛋白質游離成正、負離子的趨勢相等,即成為兼性離子(zwitterion,淨電荷為O),此時溶液的pH值稱為蛋白質的等電點(isoelectric point,簡寫pI)。處於等電點的蛋白質顆粒,在電場中並不移動。蛋白質溶液的pH大於等電點,該蛋白質顆粒帶負電荷,反之則帶正電荷。
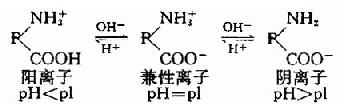
各種蛋白質分子由於所含的鹼性胺基酸和酸性胺基酸的數目不同,因而有各自的等電點。
凡鹼性胺基酸含量較多的蛋白質,等電點就偏鹼性,如組蛋白、精蛋白等。反之,凡酸性胺基酸含量較多的蛋白質,等電點就偏酸性,人體體液中許多蛋白質的等電點在pH5.0左右,所以在體液中以負離子形式存在。
三、蛋白質的變性
天然蛋白質的嚴密結構在某些物理或化學因素作用下,其特定的空間結構被破壞,從而導致理化性質改變和生物學活性的喪失,如酶失去催化活力,激素喪失活性稱之為蛋白質的變性作用(denaturation)。變性蛋白質只有空間構象的破壞,一般認為蛋白質變性本質是次級鍵,二硫鍵的破壞,並不涉及一級結構的變化。
變性蛋白質和天然蛋白質最明顯的區別是溶解度降低,同時蛋白質的粘度增加,結晶性破壞,生物學活性喪失,易被蛋白酶分解。
引起蛋白質變性的原因可分為物理和化學因素兩類。物理因素可以是加熱、加壓、脫水、攪拌、振蕩、紫外線照射、超聲波的作用等;化學因素有強酸、強鹼、尿素、重金屬鹽、十二烷基磺酸鈉(SDS)等。在臨床醫學上,變性因素常被應用於消毒及滅菌。反之,注意防止蛋白質變性就能有效地保存蛋白質製劑。
變性並非是不可逆的變化,當變性程度較輕時,如去除變性因素,有的蛋白質仍能恢復或部分恢復其原來的構象及功能,變性的可逆變化稱為復性。例如,前述的核糖核酸酶中四對二硫鍵及其氫鍵。在β巰基乙醇和8M尿素作用下,發生變性,失去生物學活性,變性後如經過透析去除尿素,β巰基乙醇,並設法使疏基氧化成二硫鍵,酶蛋白又可恢復其原來的構象,生物學活性也幾乎全部恢復,此稱變性核糖核酸酶的復性。
許多蛋白質變性時被破壞嚴重,不能恢復,稱為不可逆性變性。
四、蛋白質的沉澱
蛋白質分子凝聚從溶液中析出的現象稱為蛋白質沉澱(precipitation),變性蛋白質一般易於沉澱,但也可不變性而使蛋白質沉澱,在一定條件下,變性的蛋白質也可不發生沉澱。
蛋白質所形成的親水膠體顆粒具有兩種穩定因素,即顆粒表面的水化層和電荷。若無外加條件,不致互相凝集。然而除掉這兩個穩定因素(如調節溶液pH至等電點和加入脫水劑)蛋白質便容易凝集析出。
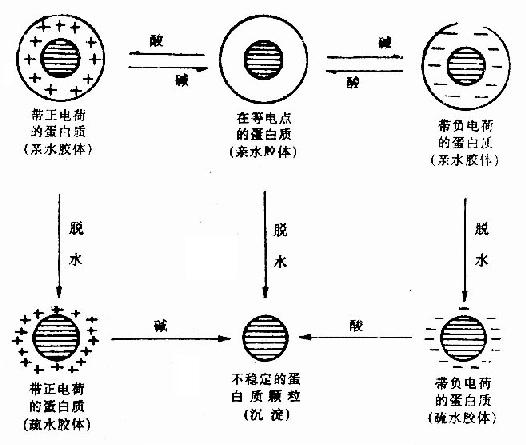
圖1-20 蛋白質膠體顆粒的沉澱
從圖1-0可以看出,如將蛋白質溶液pH調節到等電點,蛋白質分子呈等電狀態,雖然分子間同性電荷相互排斥作用消失了。但是還有水化膜起保護作用,一般不致於發生凝聚作用,如果這時再加入某種脫水劑,除去蛋白質分子的水化膜,則蛋白質分子就會互相凝聚而析出沉澱;反之,若先使蛋白質脫水,然後再調節pH到等電點,也同樣可使蛋白質沉澱析出。
引起蛋白質沉澱的主要方法有下述幾種:
(一)鹽析(Salting Out)
在蛋白質溶液中加入大量的中性鹽以破壞蛋白質的膠體穩定性而使其析出,這種方法稱為鹽析。常用的中性鹽有硫酸銨、硫酸鈉、氯化鈉等。各種蛋白質鹽析時所需的鹽濃度及pH不同,故可用於對混和蛋白質組分的分離。例如用半飽和的硫酸銨來沉澱出血清中的球蛋白,飽和硫酸銨可以使血清中的白蛋白、球蛋白都沉澱出來,鹽析沉澱的蛋白質,經透析除鹽,仍保證蛋白質的活性。調節蛋白質溶液的pH至等電點後,再用鹽析法則蛋白質沉澱的效果更好。
(二)重金屬鹽沉澱蛋白質
蛋白質可以與重金屬離子如汞、鉛、銅、銀等結合成鹽沉澱,沉澱的條件以pH稍大於等電點為宜。因為此時蛋白質分子有較多的負離子易與重金屬離子結合成鹽。重金屬沉澱的蛋白質常是變性的,但若在低溫條件下,並控制重金屬離子濃度,也可用於分離製備不變性的蛋白質。
臨床上利用蛋白質能與重金屬鹽結合的這種性質,搶救誤服重金屬鹽中毒的病人,給病人口服大量蛋白質,然後用催吐劑將結合的重金屬鹽嘔吐出來解毒。
蛋白質又可與生物鹼試劑(如苦味酸、鎢酸、鞣酸)以及某些酸(如三氯醋酸、過氯酸、硝酸)結合成不溶性的鹽沉澱,沉澱的條件應當是pH小於等電點,這樣蛋白質帶正電荷易於與酸根負離子結合成鹽。
臨床血液化學分析時常利用此原理除去血液中的蛋白質,此類沉澱反應也可用於檢驗尿中蛋白質。
(四)有機溶劑沉澱蛋白質
可與水混合的有機溶劑,如酒精、甲醇、丙酮等,對水的親和力很大,能破壞蛋白質顆粒的水化膜,在等電點時使蛋白質沉澱。在常溫下,有機溶劑沉澱蛋白質往往引起變性。例如酒精消毒滅菌就是如此,但若在低溫條件下,則變性進行較緩慢,可用於分離製備各種血漿蛋白質。
(五)加熱凝固
將接近於等電點附近的蛋白質溶液加熱,可使蛋白質發生凝固(coagulation)而沉澱。加熱首先是加熱使蛋白質變性,有規則的肽鏈結構被打開呈鬆散狀不規則的結構,分子的不對稱性增加,疏水基團暴露,進而凝聚成凝膠狀的蛋白塊。如煮熟的雞蛋,蛋黃和蛋清都凝固。
蛋白質的變性、沉澱,凝固相互之間有很密切的關係。但蛋白質變性後並不一定沉澱,變性蛋白質只在等電點附近才沉澱,沉澱的變性蛋白質也不一定凝固。例如,蛋白質被強酸、強鹼變性後由於蛋白質顆粒帶著大量電荷,故仍溶於強酸或強減之中。但若將強鹼和強酸溶液的pH調節到等電點,則變性蛋白質凝集成絮狀沉澱物,若將此絮狀物加熱,則分子間相互盤纏而變成較為堅固的凝塊。
五、蛋白質的呈色反應
(一)茚三酮反應(Ninhydrin Reaction)
α-胺基酸與水化茚三酮(苯丙環三酮戊烴)作用時,產生藍色反應,由於蛋白質是由許多α-胺基酸組成的,所以也呈此顏色反應。
(二)雙縮脲反應(Biuret Reaction)
蛋白質在鹼性溶液中與硫酸銅作用呈現紫紅色,稱雙縮脲反應。凡分子中含有兩個以上-CO-NH-鍵的化合物都呈此反應,蛋白質分子中胺基酸是以肽鍵相連,因此,所有蛋白質都能與雙縮脲試劑發生反應。
(三)米倫反應(Millon Reaction)
蛋白質溶液中加入米倫試劑(亞硝酸汞、硝酸汞及硝酸的混和液),蛋白質首先沉澱,加熱則變為紅色沉澱,此為酪氨酸的酚核所特有的反應,因此含有酪氨酸的蛋白質均呈米倫反應。
此外,蛋白質溶液還可與酚試劑、乙醛酸試劑、濃硝酸等發生顏色反應。
| 關於「生物化學與分子生物學/蛋白質的理化性質」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |