生物化學與分子生物學/蛋白質的結構與功能的關係
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質化學 >> 蛋白質的結構及其功能 >> 蛋白質的結構與功能的關係 |
| 生物化學與分子生物學 |
|
|
蛋白質一級結構是空間結構的基礎,特定的空間構象主要是由蛋白質分子中肽鏈和側鏈R基團形成的次級鍵來維持,在生物體內,蛋白質的多肽鏈一旦被合成後,即可根據一級結構的特點自然摺疊和盤曲,形成一定的空間構象。
Anfinsen以一條肽鏈的蛋白質核糖核酸酶為對象,研究二硫鍵的還原和氧化問題,發現該酶的124個胺基酸殘基構成的多肽鏈中存在四對二硫鍵,在大量β-巰基乙醇和適量尿素作用下,四對二硫鍵全部被還原為桽H,酶活力也全部喪失,但是如將尿素和β-巰基乙醇除去,並在有氧條件下使巰基緩慢氧化成二硫鍵,此時酶的活力水平可接近於天然的酶。Anfinsen在此基礎上認為蛋白質的一級結構決定了它的二級、三級結構,即由一級結構可以自動地發展到二、三級結構(圖1-10)。
一級結構相似的蛋白質,其基本構象及功能也相似,例如,不同種屬的生物體分離出來的同一功能的蛋白質,其一級結構只有極少的差別,而且在系統發生上進化位置相距愈近的差異愈小(表1-2,表1-3)。
表1-2 胰島素分子中胺基酸殘基的差異部分
| 胰島素來源 | 胺基酸殘基的差異部分 | |||
| A5 | A6 | A10 | A30 | |
| 人 | Thr | Ser | Ile | Thr |
| 豬 | Thr | Ser | Ile | Ala |
| 狗 | Thr | Ser | Ile | Ala |
| 兔 | Thr | Ser | Ile | Ser |
| 牛 | Ala | Ser | Val | Ala |
| 羊 | Ala | Gly | Val | Ala |
| 馬 | Thr | Gly | Ile | Ala |
| 抹香猄 | Thr | Ser | Ile | Ala |
| 鯉猄 | Ala | Ser | Thr | Ala |
表1-3 細胞色素C分子中胺基酸殘基的差異數目及分歧時間
| 不同種屬 | 胺基酸殘基的差異數目 | 分歧時間(百萬年) |
| 人-猴 | 1 | 50-60 |
| 人-馬 | 12 | 70-75 |
| 人-狗 | 10 | 70-75 |
| 豬-牛-羊 | 0 | |
| 馬-牛 | 3 | 60-65 |
| 哺乳類-雞 | 10-15 | 280 |
| 哺乳類-猢 | 17-21 | 400 |
| 脊椎動物-酵母 | 43-48 | 1,100 |
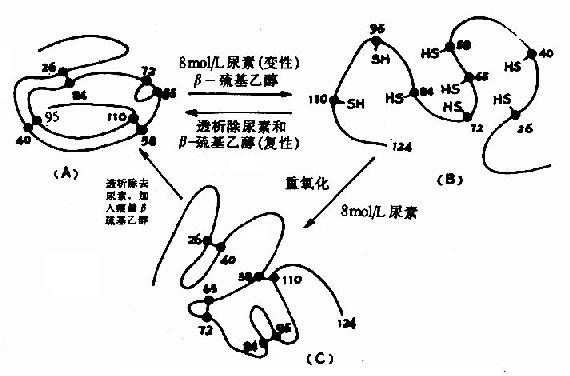
圖1-11 核糖核酸酶的變性和復性示意圖
(A)天然核糖核酸酶(B)變性失活(C)「錯亂」核糖核酸酶
促腎上腺皮質激素(ACTH)和促黑激素(MSH)均為垂體分泌的多肽激素。α-MSH和ACTh 4~10位的胺基酸結構與β-MSH的11~17位一樣,故ACTH有較弱的MSH的生理作用(圖1-12)。
在蛋白質的一級結構中,參與功能活性部位的殘基或處於特定構象關鍵部位的殘基,即使在整個分子中發生一個殘基的異常,那麼該蛋白質的功能也會受到明顯的影響。被稱之為「分子病」的鐮刀狀紅細胞性貧血僅僅是574個胺基酸殘基中,一個胺基酸殘基即β亞基N端的第6號胺基酸殘基發生了變異所造成的,這種變異來源於基因上遺傳信息的突變(如圖1-13)。
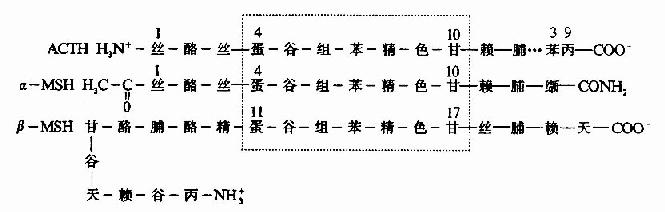
圖1-12 ACTH、α-MSH和β-MSH一級結構比較
| 正常 | DNA | ……TGt GGG CTT CTT TTT…… |
| mRNA | ACA CCC GAA GAA AAA | |
| DNA(β亞基) | N端…蘇-脯-谷-谷-賴…… | |
| 異常 | DNA | ……TGT GGG GAT CTT TTT…… |
| mRNA | ……ACa CCC GUA GAA AAA…… | |
| hbs(β亞基) | N端…蘇-脯-纈-谷-賴…… |
圖1-13 鐮刀狀紅細胞性貧血血紅蛋白遺傳信息的異常
(二)蛋白質空間橡象與功能活性的關係
蛋白質多種多樣的功能與各種蛋白質特定的空間構象密切相關,蛋白質的空間構象是其功能活性的基礎,構象發生變化,其功能活性也隨之改變。蛋白質變性時,由於其空間構象被破壞,故引起功能活性喪失,變性蛋白質在復性後,構象復原,活性即能恢復。
在生物體內,當某種物質特異地與蛋白質分子的某個部位結合,觸發該蛋白質的構象發生一定變化,從而導致其功能活性的變化,這種現象稱為蛋白質的別構效應(allostery)。
蛋白質(或酶)的別構效應,在生物體內普遍存在,這對物質代謝的調節和某些生理功能的變化都是十分重要的。
現以血紅蛋白(hemoglobin,簡寫Hb)為例來說明構象與功能的關係。
血紅蛋白是紅細胞中所含有的一種結合蛋白質,它的蛋白質部分稱為珠蛋白(globin),非蛋白質部分(輔基)稱為血紅素(見圖1-14)。Hb分子由四個亞基構成,每一亞基結合一分子血紅素。正常成人Hb分子的四個亞基為兩條α鏈,兩條β鏈。α鏈由141個胺基酸殘基組成,β鏈由146個胺基酸殘基組成,它們的一級結構均已確定。每一亞基都具有獨立的三級結構,各肽鏈摺疊盤曲成一定構象,β亞基中有8個α-螺旋區(分別稱A、B……H螺旋區),α亞基中有7個α-螺旋區。在此基礎上肽鏈進一步摺疊形成球狀,依賴側鏈間形成的各種次級鍵維持穩定,使之球形表面為親水區,球形向內,在E和F螺旋段間的20多個巰水胺基酸側鏈構成口袋形的疏水區,輔基血紅素就嵌接在其中,α亞基和β亞基構象相似,最後,四個亞基α2β2聚合成具有四級結構的Hb分子(見圖1-15)。在此分子中,四個亞基沿中央軸排布四方,兩α亞基沿不同方向嵌入兩個β亞基間,各亞基間依多種次級健聯繫,使整個分子呈球形,這些次級鍵對於維繫Hb分子空間構象有重要作用,例如在四亞基間的8對鹽鍵(圖1-16),它們的形成和斷裂將使整個分子的空間構象發生變化。
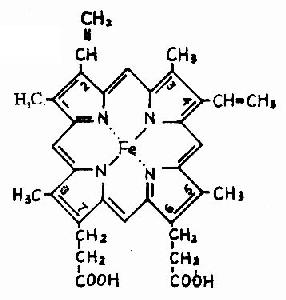
圖1-14 血紅素的結構式
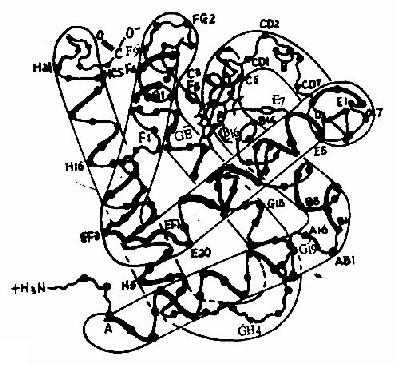
圖1-15 血紅蛋白β亞基的構象
ABCDEFGH分別代表不同的α-螺旋區。共有八個螺旋區;阿拉伯數字代表在該區胺基酸殘基的序號;a-螺旋區之間的移行部位為無規捲曲,用AB,CD,EF,FG…等表示。C1,E7,C5,CF,C3,E3,的中間為血紅素,其中較大的黑點代表Fe2+。
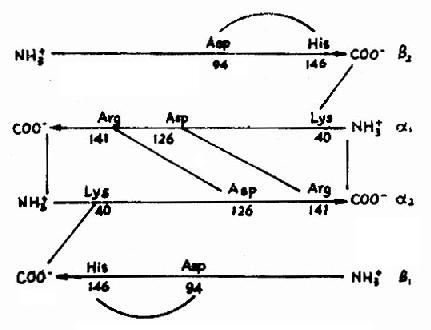
圖1-16 血紅蛋白亞基間鹽鍵示意圖
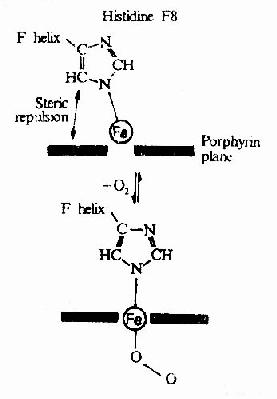
圖1-7 鐵原子在氧合時落入血紅素平面
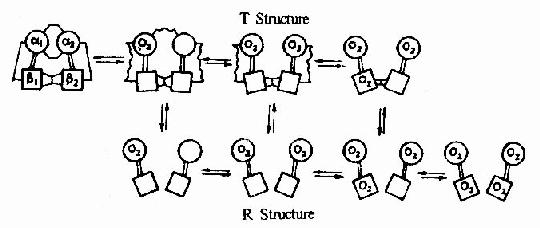
圖1-18
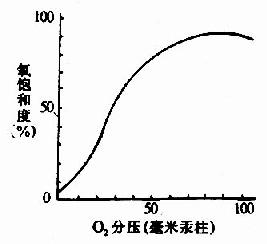
圖1-19 Hb的氧飽和曲線
Hb在體內的主要功能為運輸氧氣,而Hb的別位效應,極有利於它在肺部與O2結合及在周圍組織釋放O2。
Hb是通過其輔基血紅素的Fe++與氧發生可逆結合的,血紅素的鐵原子共有6個配位鍵,其中4個與血紅素的吡咯環的N結合,一個與珠蛋白亞基F螺旋區的第8位組氨酸(F8)殘基的咪唑基的N相連接,空著的一個配位鍵可與O2可逆地結合,結合物稱氧合血紅蛋白。
在血紅素中,四個吡咯環形成一個平面,在未與氧結合時Fe++的位置高於平面0.7Å,一旦O2進入某一個α亞基的疏水「口袋」時,與Fe++的結合會使Fe++嵌入四吡咯平面中,也即向該平面內移動約0.75Å(圖1-17),鐵的位置的這一微小移動,牽動F8組氨酸殘基連同F螺旋段的位移,再波及附近肽段構象,造成兩個α亞基間鹽鍵斷裂,使亞基間結合變松,並促進第二亞基的變構並氧合,後者又促進第三亞基的氧合(圖1-18)使Hb分子中第四亞基的氧合速度為第一亞基開始氧合時速度的數百倍。此種一個亞基的別構作用,促進另一亞基變構的現象,稱為亞基間的協同效應(cooperativity),所以在不同氧分壓下,Hb氧飽和曲線呈「S」型(圖1-19)。
| 關於「生物化學與分子生物學/蛋白質的結構與功能的關係」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |