生物化學與分子生物學/膜受體信號轉導的分子機理
| 醫學電子書 >> 《生物化學與分子生物學》 >> 細胞通訊與細胞信號轉導的分子機理 >> 膜受體介導的信號轉導 >> 膜受體信號轉導的分子機理 |
| 生物化學與分子生物學 |
|
|
|
(一)離子通道型受體及其信號轉導
離子通道型受體是一類自身為離子通道的受體。這種離子通道與受電位控制的離子通道及受化學修飾調控的離子通道不同,它們的開放或關閉直接受配體的控制,其配體主要為神經遞質。
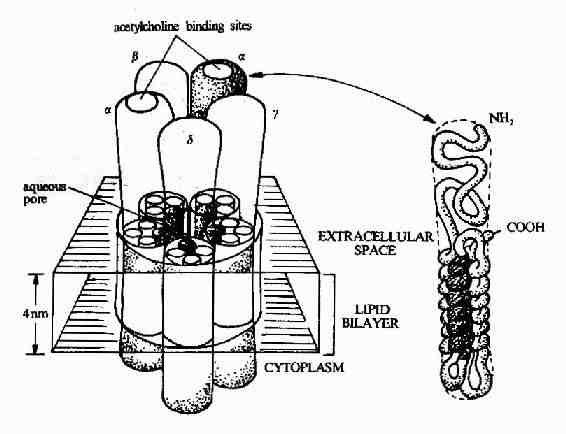
圖21-8 乙醯膽鹼受體的結構模式圖
圖21-8顯示了作為離子通道受體的典型代表-乙醯膽鹼受體的結構模式。乙醯膽鹼受體是由5個同源性很高的亞基構成,包括2個α亞基,1個β亞基,1個γ亞基的和1個δ亞基。每一個亞基都是一個四次跨膜蛋白,分子量約60kd,約由500個胺基酸殘基構成。推測跨膜部分為四條α螺旋結構,其中一條α螺旋含較多的極性胺基酸,就是由於這個親水區的存在,使五個亞基共同在膜中形成一個親水性的通道。乙醯膽鹼的結合部位位於α亞基上。
乙醯膽鹼受體可以以三種構象存在(圖21-9)。兩分子乙醯膽鹼的結合可以使之處於通道開放構象,但即使有乙醯膽鹼的結合,該受體處於通道開放構象狀態的時限仍十分短暫,在幾十毫微秒內又回到關閉狀態。然後乙醯膽鹼與之解離,受體則恢復到初始狀態,做好重新接受配體的準備。
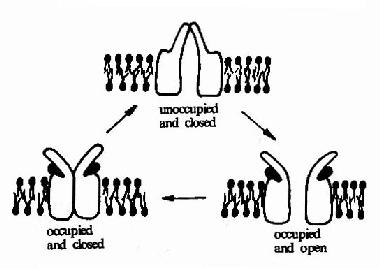
圖21-9 乙醯膽鹼受體的三種構象示意圖
離子通道受體信號轉導的最終作用是導致了細胞膜電位的改變,可以認為,離子通道受體是通過將化學信號轉變成為電信號而影響細胞的功能的。
離子通道型受體可以是陽離子通道,如乙醯膽鹼、谷氨酸和五羥色胺的受體,也可以是陰離子通道,如甘氨酸和γ-氨基丁酸的受體。
(二)G蛋白偶聯型受體及其信號轉導
G蛋白偶聯型受體包括多種神經遞質、肽類激素和趨化因子的受體,在味覺、視覺和嗅覺中接受外源理化因素的受體亦屬G蛋白偶聯型受體。這類受體在結構上均為單體蛋白,氨基末端位於細胞外表面,羧基末端在胞膜內側。完整的肽鏈要反覆跨膜七次(圖21-10),因此亦有人將此類受體稱為七次跨膜受體。由於肽鏈反覆跨膜,在膜外側和膜內側形成了幾個環狀結構,它們分別負責與配體(化學、物理信號)的結合和細胞內的信號傳遞。其胞漿部分可以與一種GTP結合蛋白(簡稱G蛋白)相互作用,這種G蛋白是該信號傳遞途徑中的第一個信號傳遞分子,這也是這類受體被稱為G蛋白偶聯型受體的原因。
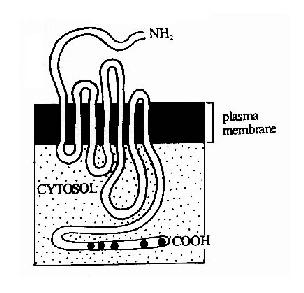
圖21-10 七次跨膜受體-G蛋白偶聯型受體跨膜結構示意圖
G蛋白偶聯受體的信號傳遞過程包括(1)配體與受體結合,(2)受體活化G蛋白;(3)G蛋白激活或抑制細胞中的效應分子;(4)效應分子改變細胞內信使的含量與分布,(5)細胞內信使作用於相應的靶分子,從而改變細胞的代謝過程及基因表達等功能。本節將逐一介紹這一過程的主要環節。
1.G蛋白的循環或活化(G Protein Cycle)
G蛋白偶聯型受體的信號轉導途徑中的第一個信號傳遞分子是G蛋白,其活化過程稱為G蛋白循環。
G蛋白以α、βγ亞基三聚體的形式存在於細胞質膜內側。α亞基已發現有20餘種,分子量為36~52kd。α亞基具有多個活化位點,其中包括可與受體結合併受其活化調節的部位、與βγ亞基相結合的部位、GDP或GTP結合部位以及與下游效應分子相互作用的部位等等。α亞基還具有GTP酶活性。α亞基結合GDP時是無活性狀態,而與GTP結合時則為有活性狀態,GTP的水解又使其返回無活性狀態。
G蛋白中的β和γ亞基亦有數種,但不及α亞基種類多。在細胞內,β和γ亞基形成緊密結合的二聚體,只有在蛋白變性條件下方可解離,因此可以認為它們是功能上的單體。βγ亞基的主要作用是與α亞基形成複合體並定位於質膜內側。近年來的研究表明,βγ亞基亦可作用於其下游效應分子。
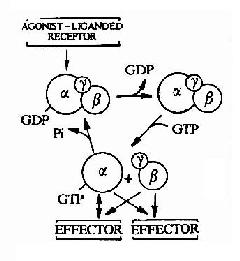
圖21-11 G蛋白循環示意圖
G蛋白循環的具體過程可見圖21-11。當物理或化學信號刺激受體時,受體活化G蛋白使之發生構象改變。α亞基與GDP的親和力下降,結合的GDP為GTP所取代。α亞基結合了GTP後即與βγ亞基發生解離,成為活化狀態的α亞基。活化了的α亞基此時可以作用於下游的各種效應分子。這種活化狀態將一直持續到GTP被α亞基自身具有的GTP酶水解為GDP。一旦發生GTP的水解,α亞基又再次與βγ亞基形成複合體,回到靜止狀態,重新接受新的化學信號。
由於G蛋白的種類不同,因此G蛋白可以作用於不同的效應分子,或對同一效應分子進行不同的調節。
2.效應分子及細胞內信使
G蛋白活化之後,可作用於腺苷酸環化酶和磷脂酶C等效應分子(Effector)上。有的α亞基(Gs)可以激活腺苷酸環化酶;有的α亞基(αi)可以抑制腺苷酸環化酶。腺苷酸環化酶催化ATP生成環狀AMP(cAMP)的反應,因此細胞內的cAMP水平在配體與受體結合後,可受G蛋白α亞單位的作用而升高或降低,從而將細胞外信號轉變為細胞內信號。這種細胞內信號可再作用於下游分子。這種細胞內信號的傳遞方式是G蛋白偶聯型受體傳遞信號的主要方式,這些細胞內信號分子被稱為細胞內信使。細胞內信使亦被稱為第二信使。已知的細胞內信使包括cAMP、cGMP、甘油二酯(DAG)、IP3、和Ca2+等等(圖21-12、13、14)。G蛋白的α亞基種類、其作用的效應分子及所調節的細胞內信使可參見表21-3。
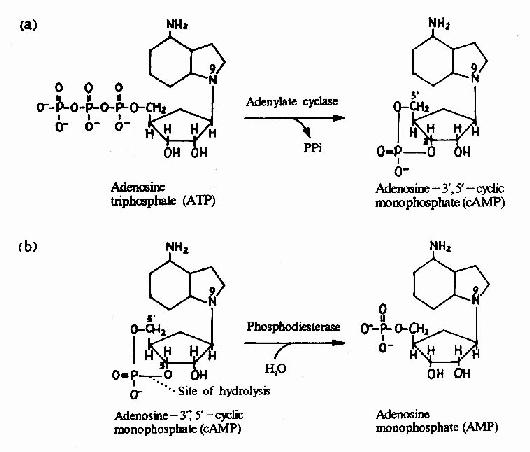
圖21-12 cAMP的生成與水解
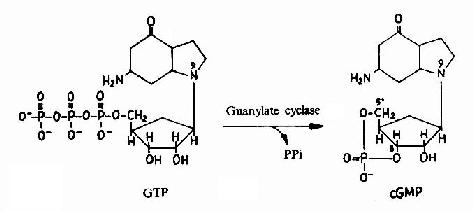
圖21-13 cGMP的生成
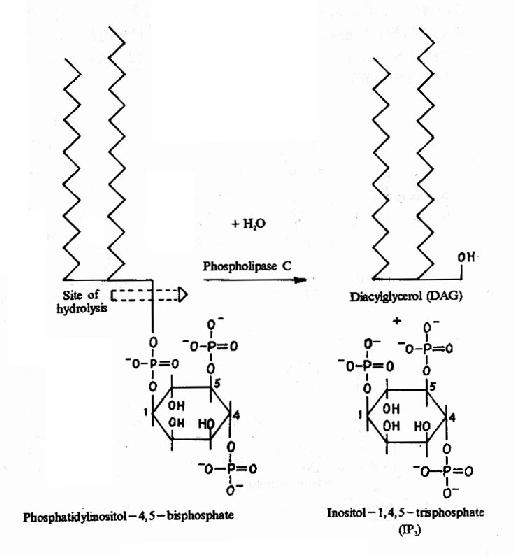
圖21-14 DAG和IP3的生成
細胞內信使一般具有以下三個特點:(1)多為小分子,且不位於能量代謝途徑的中心;(2)在細胞中的濃度或分布可以迅速地改變;(3)作為變構效應劑可作用於相應的靶分子,已知的靶分子主要為各種蛋白激酶。
表21-3 G蛋白的α亞基及其效應分子
| Ca種類 | 效應分子 | 細胞內信使 | 靶分子 |
| as | 腺苷酸環化酶活性急↑ | cAMP↑ | 蛋白激酶A活性↑ |
| ai | 腺苷酸環化酶活性↓ | cAMP↓ | 蛋白激酶A活性↓ |
| aq | 磷脂酶C活性↑ | Ca2+IP↑3DAG | 蛋白激酶C活化↑ |
| at | cGMP磷脂二酯酶↑活性 | cGMP↓ | Na+通道關閉 |
cAMP是第一個被發現的細胞內信使,催化它生成的腺苷酸環化酶為一重要的Gαi和Gαs的效應分子。cAMP是很多激素的細胞內信使。另一類重要的細胞內信使是在磷脂醯肌醇特異性磷脂酶C作用下,由PIP2(二磷酸磷脂醯肌醇)水解生成的三磷酸肌醇(IP3)和甘油二酯(DAG)。
需要指出的是,除G蛋白偶聯型受體在其信號轉導過程中需細胞內信使作為信號的傳遞者外,細胞內還存在受其它的信號轉導方式調控的細胞內信使。九十年代以來,越來越多的以小分子物質作為細胞內信使參與細胞功能調控的過程得以闡明。
G蛋白偶聯型受體在G蛋白介導下的信號傳遞過程可見圖21-15和圖21-16。
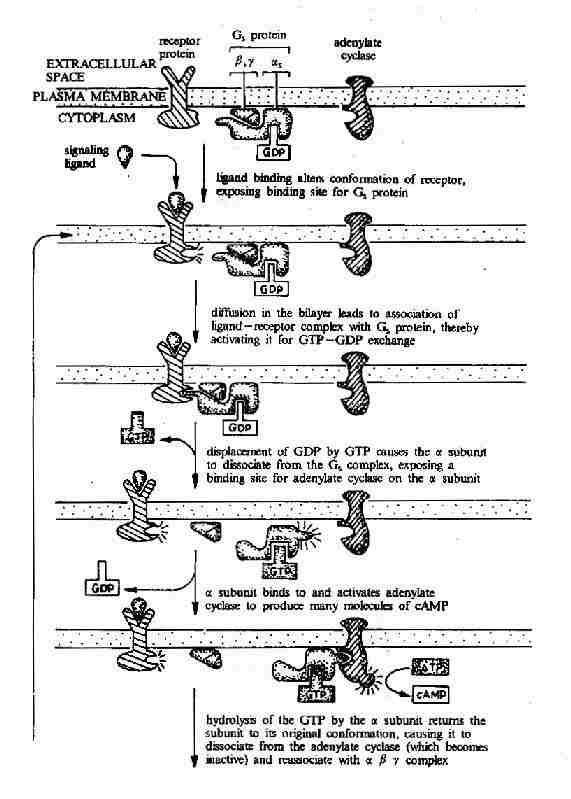
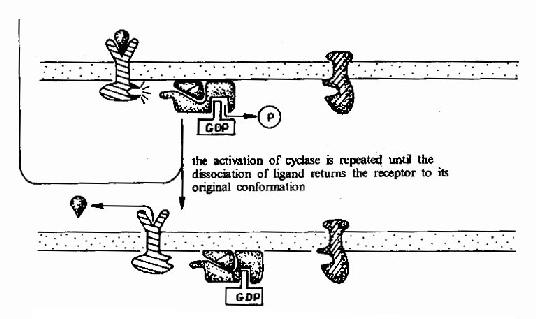
圖21-15 G蛋白偶聯型受體-G蛋白-腺苷酸環化酶信號轉導途徑示意圖
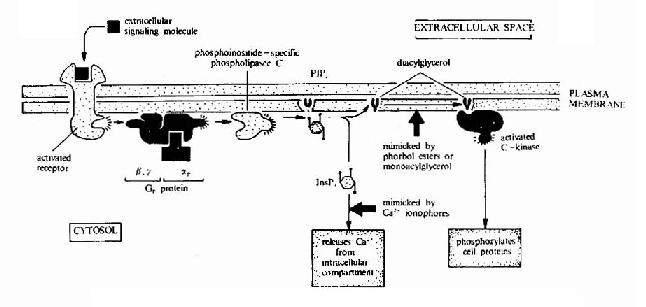
圖21-16 G蛋白偶聯型受體-G蛋白-磷脂酶C信號轉導途徑示意圖
3.細胞內信使作用的主要靶分子
活化的Gα可作用於相應的效應分子,從而使相應的細胞內信使濃度發生迅速的改變。這些細胞內的信使可分別作用於相應的靶分子,從而使得細胞中的各種酶類和蛋白分子的活性發生改變。這些細胞內信使所作用的靶分子主要為各種蛋白激酶(表21-3)
(1)蛋白激酶A
cAMP作用於cAMP依賴性蛋白激酶(cAMP-dependent Protein Kinase,簡稱為cAPK),亦稱為蛋白激酶A(Protein Kinase A, PKA),目前後一種命名較為公認。cAMP可以作為該激酶的變構激活劑,使無活性的蛋白激酶A轉變為有活性的蛋白激酶A(詳見第十一章,圖11-4)。活化了的蛋白激酶A可作用於多種與糖脂代謝相關的酶類、一些離子通道和某些轉導因子,使它們發生磷酸化並改變其活性狀態。
(2)蛋白激酶G
細胞內的另一種環核苷酸信使為環鳥苷酸-cGMP。cGMP作用於cGMP依賴性蛋白激酶-cGMPdependent Protein Kinase, cGPK),亦稱為蛋白激酶G(Protein Kinase G、PKG)。與PKA一樣,PKG是目前較為公認的命名。蛋白激酶G以cGMP作為變構效應劑,在腦和平滑肌中含量較豐富。1997年,人們發現,PKG的基因突變與果蠅的覓食行為有關。我們可以推測,PKG很有可能在神經系統的信號傳遞過程中具有重要作用。
(3)蛋白激酶C
另外一些重要的細胞內信使還包括磷脂醯肌醇的衍生物如DAG、PIP3(三磷酸磷脂醯肌醇)、磷脂醯膽鹼的衍生物、鞘磷脂的衍生物以及Ca2+等等。這些小分子信使的一個重要靶分子是蛋白激酶C(Protein KinaseC、PKC)。
PKC有多種同工酶形式,均以希臘字母排列,有PKCα、PKCβI、PKCβⅡ和PKCγ等等。不同的同功酶在結構和組織分布上各有不同,其對輔助因子(包括上述細胞內小分子信使)的需求亦有差別,並且對底物有選擇性。
PKC在細胞的生長分化的調控中及其它多種細胞功能上具有關鍵性的調節作用,是一類非常重要的信號轉導分子。細胞信號轉導過程中的多條途徑都可以導致PKC的活化。已經有很多實驗研究證明,PKC的抑制劑可以使細胞失去對生長分化刺激信號的反應,表明這些功能都依賴於PKC的調控。例如,肥大細胞的脫顆粒反應(釋放出大量組織胺等血管活性物質)是機體變態反應的重要形式之一。體外實驗表明,如果用PKC抑制劑預先處理細胞,細胞就不會對刺激信號再發生脫顆粒反應。如果用改變細胞膜通透性的方式使胞內的PKC漏出,細胞也會失去發生脫顆粒反應的能力,此時若再加入PKC使之回到細胞中,則又可恢復細胞的脫顆粒反應。其它很多類似的實驗亦表明,細胞的很多其它功能也受到PKC的調控。
(三)單次跨膜受體及其信號轉導
多種生長因子和細胞因子的受體為一類結構上為單次跨膜的糖蛋白。與七次跨膜受體(G蛋白偶聯型受體)相對應,將其稱為單次跨膜受體,即它們的跨膜區僅為單向一次性的,而不像七次跨膜受體那樣有反覆的跨膜區段。
單次跨膜受體依照其結構特點可進一步分成多個家族和亞家族,其分類見表21-4及圖21-7。
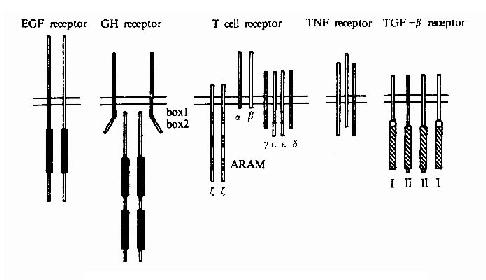
圖21-17 各類單次跨膜受體的代表性舉例
Table21-4Families of ReceptorsActivated by Dimerization or Oligomerization
| Receptor Type | Family | Examples | Characteristics |
| PDGF receptor | PDGFR-α,PDGFR-βSCFR | Five immunoglobulin-like | |
| family | (Kit),CSF-R(Fms),Flk-2 | domains extracellularly | |
| EGF receptor family | EGFR(ErbB),ErbB2(Neu),ErbB3,ErbB4 | Two cysteine-rich | |
| IGF receptor family | insulin R,IGF-1R | domains extracllularly | |
| HGF receptor family | HGFR(Met),MSPR(Ron) | Disulphide-bound heteroteramer of a and βchain | |
| VEGF receptor family | Flt-1,Flk-1(KDR) | Seven immunolobulin-like domains extracellularly | |
| Neurotrophin receptor family | Trk,TrkB,TrkC | ||
| Eph receptor family | Eph ,E1k,Eck,Cck5,Sek,Erk | Two FNIII-like domains and a cysteinerichdomain extracellularly | |
| Class 1 cytokine receptor family | |||
| CH receptor subfamily | GHR,EPOR,PRLR,G-CSFR | Form homodimers | |
| IL-3 receptor subfamily | IL-3R,GM-CSFR,IL-5R | Form complexes with the cβ subunit | |
| IL-6 receptor subfamily | IL-6R,LIFR,CNTFR,IL-11R | Form complexs with gp 130 | |
| IL-2receptor subfamily | IL-2R,IL-2Rβ,IL-4R,IL-7R | Form complexes with il-2Rγ | |
| IFN-α/βR,IFN-γRα,IFN-γRβIL-10R | |||
| TNF receptor family | TNFR-1,TNFR-11MLNGFR,CD40,OX-40,Fas,CD27,CD30 | Form trimers | |
| TCR | Complex of α,β,γ,δ,ε,ζandηsubunits | ||
| BCR | Complex of IgM and heterodimers ofα/βsubunits | ||
| Serine/threonine kinase receptor family | Type Ⅱ receptor family | TGFβR-Ⅱ,ActR-Ⅱ,ActR-ⅡB | Form hetero-oligomers with type Ireceptors,i, e,TGFβ-I,ActR-1,ActR-1B,BMPR-1A,BMPR-1B,ALK-1 |
Receptorfamilies and subfamilies discussed in the text are presented .Abbreviationsused: R, receptor; R, receptor; PDGF,platelet-derived growth factor; SCF, stemcell factor; CSF, colony-stimulationg factor; EGF,epidermal growth factor; FGF,fibroblast growth factor; IGF, insulin-like growth factor;HGF, hepatocytegrowth factor;MSP,macrophage-stimulating protein;VEGF,vascular endothelialgrowth factor;FN,fibronectin;GH,growthhormone;EPO,erythropoietin;PRL,prolactin;IL,interleukin;LIF,leukemia inhibitoryfactor;CNTR,ciliary neurotrophic factore;IFN,interferon;TNF,tumor necrosisfactor;Lngfr,low affinity nerve growth factor rcecptor;TCR,T ,cellrcecptor;BCR,B cell rcecptor;receptor;TGFR,transfoming growth factorβAct,activin;BMP,bone morphogenic protein,Alternative desingations are givenwithin parentheses.
單次跨膜受體所介導的信號傳遞與轉換過程與G蛋白偶聯型受體介導的信號轉導有著很大差別。我們已經知道,G蛋白偶聯型受體所介導的主要是經由G蛋白的激活,然後作用於相應的效應分子,接下來最主要的是導致細胞內信使含量及分布的迅速改變從而調節靶分子的活性並改變細胞的功能狀態。單次跨膜受體介導的信號轉導過程則主要是蛋白分子的相互作用,並且有蛋白酪氨酸激酶的廣泛參與。對這些信號轉導途徑的了解在九十年代中取得了許多重要的進展。為跟蹤和理解這些信號轉導過程,我們首先需要知道參與這一過程的重要信號轉導分子和其中的一些特殊結構。
1.幾類重要的介導單次跨膜受體信號轉導的蛋白分子的結構及功能
(1)蛋白激酶
蛋白激酶是指能夠將γ-磷酸基因從磷酸供體分子上轉移至底物蛋白的胺基酸受體上的一大類酶。磷酸供體可以是ATP,也可以是其它類三磷酸核苷酸。由於蛋白激酶常常是多底物的,因此蛋白激酶是根據底物中胺基酸殘基的特異性而不是根據底物蛋白的特異性來分類的。國際生化學會命名委員會建議將蛋白激酶分為五大類:
| 激 酶 | 磷酸基團的受體 |
| 蛋白絲氨酸/蘇氨酸激酶 | 絲氨酸/蘇氨酸羥基 |
| 蛋白酪氨酸激酶 | 酪氨酸的酚羥基 |
| 蛋白組/賴/精氨酸激酶 | 咪唑環,胍基,ε-氨基 |
| 蛋白半胱氨酸激酶 | 巰基 |
| 蛋白天冬氨酸/谷氨酸激酶 | 醯基 |
前兩類激酶目前了解的較多,很多已經獲得了cDNA克隆,但對後兩者的了解仍很有限。
蛋白絲/蘇氨酸激酶和蛋白酪氨酸激酶的分類見表21-5。
表21-5 蛋白激酶分類
| 1.蛋白絲氨酸/蘇氨酸激酶 |
| (1) Cyclic nucleotide regulated |
| A. PKA α cAMPdependent protein kinase catalytic,α form |
| B. PKA βcAMPdependent protein kinase catalytic, β form |
| C. PKA γcAMPdependent protein kinase catalytic,γ form |
| D. cGPKα cGMPdependent protein kinase α form |
| E. cGPKβ cGMPdependent protein kinase β form |
| (2) Diacylglycerol regulated:[BH] |
| PKC α protein kinase C α |
| PKC β protein kinase C β |
| PKC γ protein kinase C γ |
| PKC δ protein kinase C δ |
| PKC ε protein kinase C ε |
| PKC ζ protein kinase C ζ |
| PKC η protein kinase C η |
| (3)Calcium/calmodulin regulated[BH] |
| CaMⅠ Calcium/calmodulindependent protein kinase Ⅰ |
| CaMⅡα Calcium/calmodulindependent protein kinase Ⅱα |
| CaMⅡβ Calcium/calmodulindependent protein kinase Ⅱβ |
| CaMⅡγ Calcium/calmodulindependent protein kinase Ⅱγ |
| CaMⅢCalcium/calmodulindependent protein kinase Ⅲ |
| CaMⅣCalcium/calmodulindependent protein kinase Ⅳ |
| PSKHI Putative proteinserine kinase |
| (4) Ribosomal S6 protein kinase |
| S6kⅠ,S6KⅡ,70kDaS6 |
| (5) Serpentine receptor kinase |
| ① β ARK βAdrenergic receptor protein kinase |
| ② β ARKrelated protein kinase |
| ③ Rhodopsin kinase |
| (6) Casein kinase Ⅱ |
| (7) Glycogen synthase kinase 3 |
| (8) cdc 2 family |
| (9) cdc 2 related protein kinase |
| (10)MAP kinase (mitogen activated protein kinases) |
| EPK-1, ERK-2, ERK-3, ERK-5(extracellular signal-regulated kinase) |
| JNK(c-Jun N-terminal kinase), P38, etc. |
| (11)MOS/Raf protein kinase |
| 2.蛋白酪氨酸激酶 |
| (1) Growth factor receptors |
| EGFR: EGFR.erbB2,erbB3 |
| INSR:INSR, IGF1R |
| FGFR:FGFR, FGFR2, ckit |
| DGFR:PDGFR, CSFIR |
| (2) Nonreceptor tyrosine kinase |
| src family: src,Yes,Lyn,Fyn,Lck,etc |
| Syk family:Syk, ZAP70 |
| JAK family: JAK1,JAK2, JAK3 |
| Tec family: Btk,Itk,etc |
表中列出的多種蛋白激酶都屬於重要的信號轉導分子,在此不可能一一介紹。在這些蛋白激酶中,對於細胞功能影響較大的有PKA、PKG、PKC、MAPK和PTK等。PKA、PKG和PKC已在G蛋白偶聯受體中提及,因此這裡僅介紹MAPK和PTK。
①MAP激酶(Mitogen Activated Protein Kinase, MAPK)
MAPK屬於蛋白絲/蘇氨酸激酶,是接受膜受體轉換與傳遞的信號並將其帶入細胞核內的一類重要分子,在多種受體信號傳遞途徑中均具有關鍵性作用。在未受刺激的細胞內,MAPK為靜止型,當其接收上游分子棗MAPKK(MAp Kinase Kinase)的磷酸化調控信號後,MAPK中相鄰的蘇氨酸和酪氨酸均被磷酸化,從而成為活化形式的MAPK(圖21-18)。目前在MAPK的上游存在著一個
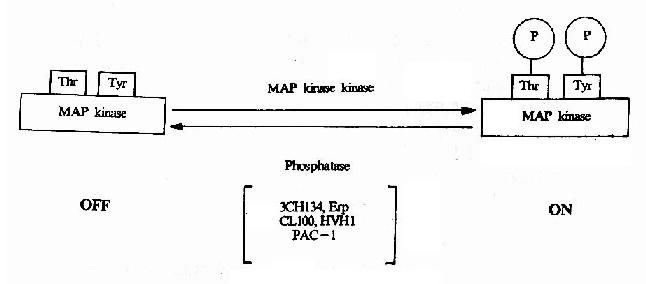
圖21-18 MAPK的活化
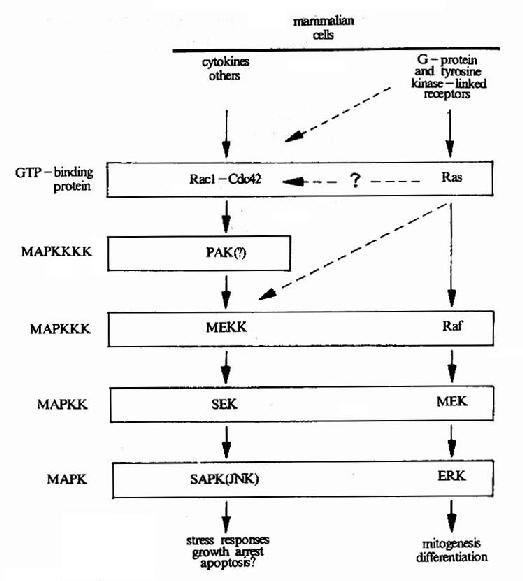
圖21-19 MAPK的逐級激活
由蛋白激酶構成的MAPK逐級激活系統。上述使MAPK磷酸化的MAPKK又受到MAPKKK(MApKinase Kinase Kinase)的調節。這種逐級激活系統又再受其上游分子的調控(圖21-19)。
MAPK被激活以後,轉移至細胞核內。在核內,它可以使一些轉錄因子發生磷酸化從而改變胞內基因表達的狀態。另外,它也可以使一些其它的酶發生磷酸化使之活性發生改變。目前已經知道,MAPK參與多種細胞功能的調控,尤其是在細胞增殖、分化及凋亡過程中,它具有關鍵性作用。
MAPK途徑在果蠅中已發現了7種不種類型,在哺乳動物細胞中已證實至少有三種MAPK成員,即ERK、JNK和P38。它們的調控機制和作用的靶分子均有所差異。
②蛋白酪氨酸激酶(Protein Tyrosine Kinase, PTK)
蛋白酪氨酸激酶作用於蛋白質中的酪氨酸殘基使之磷酸化,很多細胞信號轉導的最早期事即為多種蛋白質的酪氨酸磷酸化。在細胞的生長與分化過程中,酪氨酸磷酸化大部分具有正向調節作用,無論是生長因子作用後正常細胞的增殖、惡性腫瘤細胞的增殖,還是T細胞、B細胞或肥大細胞的活化都伴隨著瞬間發生的多種蛋白分子的酪氨酸磷酸化。蛋白酪氨酸激酶的抑制劑可以阻斷上述細胞的應答反應。
根據蛋白酪氨酸激酶在細胞內的位置可以將其分為三類:
A.蛋白酪氨酸激酶受體
這一類蛋白酪氨酸激酶為跨膜蛋白,其胞外部分為配體結合區,中間有跨膜區,胞內部分含有蛋白酪氨酸激酶的催化結構域(圖21-17)。
蛋白酪氨酸激酶受體與配體結合後往往形成二聚體,繼而發生酶活性的增高,使受體胞內部分的酪氨酸磷酸化增強,磷酸化的受體酶活性進一步增強。此外更重要的是,磷酸化的受體可以慕集含有SH2結構域(見後)的信號分子,從而將信號傳遞至下游分子。
B.位於胞漿部分的蛋白酪氨酸激酶
胞漿內亦含有多種PTKs,這些蛋白激酶或接受受體傳遞的激活信號,或受其它蛋白質的調節而發生活性改變,其主要作用是作為受體和最終效應分子之間的中間介導分子。已知的主要種類有:
(1)src家族:src、Fyn、Lck、Lyn等,與受體結合存在,當配體與受體結合後被激活;
(2)Tec家族:Btk、Itk、Tec等,與受體結合或不結合存在,配體結合後被激活;
(3)ZAP70家族:ZAP70和Syk,與磷酸化的受體結合後被激活;
(4)JAK家族:JAK1、JAK2、JAK3等。
這些PTKs或者直接與受體形成複合物,或者間接地依次被激活,在傳遞受體信號過程中起著接力棒的作用。它們的結構見圖21-20。
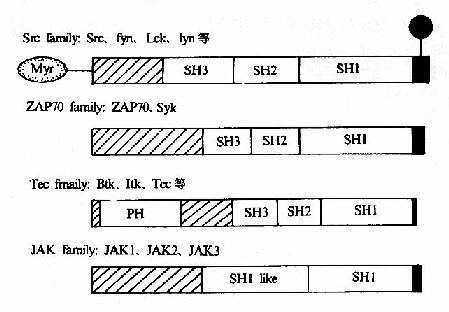
圖21-20 胞漿PTK的結構
C.核內蛋白酪氨酸激酶
大部分的酪氨酸蛋白激酶位於胞膜上或胞漿內,近年來卻發現核內也存在著酪氨酸蛋白激酶,這對於信號在核內的傳遞有重要意義。重要的核內PTKs有Abl和Wee。Abl既存在於胞核內,也存在於胞漿中,已發現它參與轉錄過程和細胞周期的調節;Wee只存在於核內,它可調節Cyclin-2的活性,抑制其磷酸化,對細胞進入有絲分裂期具有調節作用。
(2)蛋白磷酸酶(Protein Phosphotase)
蛋白磷酸(酯)酶是指具有催化已經磷酸化的蛋白分子發生去磷酸化反應的一類酶分子。它們與蛋白激酶相對應存在,共同構成了磷酸化與去磷酸化這一重要的蛋白質活性的開關係統。正如蛋白激酶催化的磷酸化由於底物不同,有的表現為活性增高,有的表現為活性降低一樣,蛋白磷酸酶所催化的去磷酸化反應也對於不同的底物有不同的反應(圖21-21)。
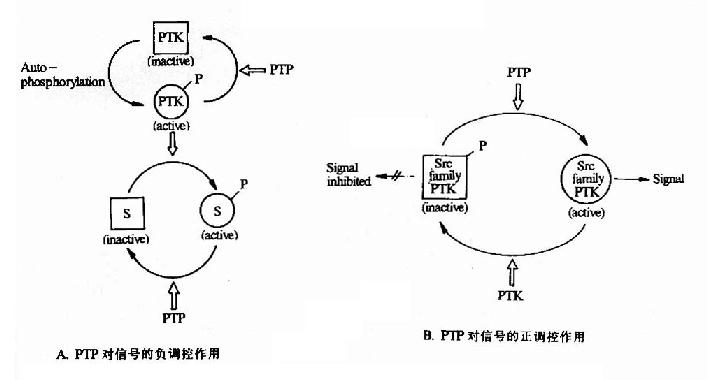
圖21-21 蛋白酪氨酸磷酸酶對蛋白酪氨酸激酶的調控作用
PTK:Protein Tyrosine Kinase PTP:Protein Tyrosine Phosphotase S:Substrate
蛋白磷酸酶的分類也與蛋白激酶類似,是根據它所作用的胺基酸殘基決定的。目前已知的蛋白磷酸酶包括蛋白絲氨酸/蘇氨酸磷酸酶和蛋白酪氨酸磷酸酶兩大類,另外還有個別的蛋白磷酸酶具有雙重作用,即可同時作用於酪氨酸和絲氨酸殘基。
蛋白激酶和蛋白磷酸酶均作用於有限的底物,它們的催化作用的特異性及其在細胞內的分布特異性決定了信號轉導途徑的精確性。
(3)低分子量G蛋白(Small G Protein)
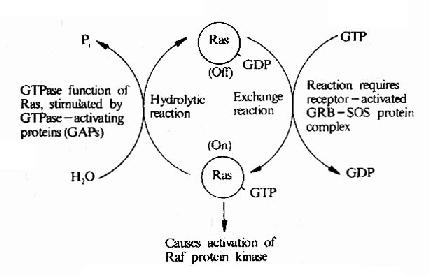
圖21-22 Ras的活化及其調控因子
低分子量GTP結合蛋白在多種細胞反應中具有開關作用,它們位於MAPK系統的上游,是一類重要的信號轉導分子。第一個被發現的低分子量G蛋白是Ras,因此這一類蛋白質被稱為Ras超家族成員。由於它們均由一個GTP酶結構域構成,亦將之稱為Ras樣GTP酶。
低分子量G蛋白的共同特點是,當結合了GTP時即成為活化形式,這時可作用於下游分子使之活化,而當GTP水解成為GDP時(自身為GTP酶)則回復到非活化狀態。這一點與Gα類似,但是Ras家族的分子量明顯低於Gα。
在細胞中存在著一些專門控制低分子量G蛋白活性的低分子量G蛋白調節因子,這些調節因子受膜受體信號的影響,調節低分子量G蛋白活性,低分子量G蛋白再作用於MAPK系統。在這些調節因子中,有的可以增強低分子量G蛋白的活性,如鳥嘌呤核苷酸交換因子(GEF)和鳥嘌呤核苷酸解離抑制因子(GDI),有的可以降低低分子量G蛋白活性,如GTP酶活化蛋白(GAP)等(圖21-22)。
目前已知的Ras超家族成員已超過50種,它們又可以分為數個亞家族,在細胞內分別控制不同的信號轉導途徑,每一個成員都有其各自的特點。
(4)介導信號轉導分子相互作用的結構元件
細胞中存在著眾多的信號轉導分子,它們是如何相互識別、相互作用而構成不同的細胞轉導途徑的呢?90年代以來,人們逐步發現了在信號轉導分子中存在著一些特殊的結構域。這些結構域大約由50~100個胺基酸構成,它們在不同的信號轉導分子中具有很高的同源性。這些結構域的作用是在細胞中介導信號轉導分子的相互識別,共同形成不同的信號傳遞鏈或稱為信號轉導途徑(Signal Transduction Pathway),並進而形成信號轉導的網路(SignalTransduction Network)。換句話講,這些結構域像電路中的接頭元件一樣把不同的信號分子連接起來。這些結構域被稱為調控結合元件(Modular Binding Domain)。目前已經知道了近十種這樣的結構域,例如:
SH2 domain (src Homology 2domain)
SH3 domain(src Homology 3 domain)
PH domain (Pleckstrin Homology domain)
PTB domain(Protein TyrosineBinding domain)
A.SH2結構域:由約100個胺基酸組成,介導信號分子與含磷酸酪氨酸蛋白分子的結合。這種結合依賴於酪氨酸殘基的磷酸化及其周圍的胺基酸殘基所構成的基序(motif)。
例:YEEI與src family的SH2結合
YMXM與growth factor receptor、P13Kp85的SH2結合
YVIP與PLCγ的SH2結合
YXNX與Grb2的SH2結合
B.SH3結構域:由50~100個胺基酸組成,介導信號分子與富含脯氨酸的蛋白分子的結合,其親和力亦與脯氨酸殘基及鄰近胺基酸殘基所構成的基序序列相關。
例:RKLPPRPSK與P13K的親和力為9.1μM
PALPPLPRY與P13K的親和力為17μM
C.PH結構域:由100~120個胺基酸組成,其功能尚未完全確定。目前已知它可以與磷脂類分子PIP2、PIP3、IP3等結合。同時也發現,一些蛋白分子,如PKC和G蛋白的βγ亞單位也可以與PH結構域結合。
D.PTB結構域:由約160個胺基酸組成,與SH2一樣,PTB結構域也可以識別一些含磷酸酪氨酸的基序,但其結合基序與SH2結構域有所差別。
作為調控結合元件,它們在結構和功能上有如下特點:
①一個信號分子可以含有兩種以上的調控結合元件(圖21-23),因此可以同時與兩種以上的其它信號分子相結合,例如,在蛋白酪氨酸激酶Btk中即有PH結構域、SH3結構域和SH2結構域等3個調控結合元件。
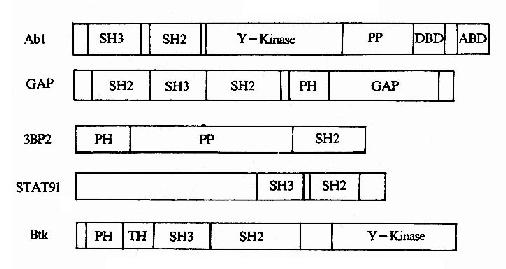
圖21-23 信號轉導分子中的調控結合元件
Y-Kinase:tyrosine kinaseDBD:DNA binding domain PP:Prorich
ABD:actinbinding domainGAP: GTPase activating domain
②同一類調控結合元件可存在於多種不同的信號轉導分子中,例如,PH結構域存在於某些蛋白激酶、低分子量G蛋白調節分子及細胞骨架蛋白等多種信號轉導分子中。這些調控結合元件的一級結構仍然是不同的,因此對所結合的信號分子具有選擇性,這是保證信號分子相互作用具有特異性的基礎。
③這些結構域本身均為非催化結構域。
2.兩條典型的信號轉導途徑
(1)表皮生長因子受體介導的信號轉導途徑
表皮生長因子與其受體-表皮生長因子受體結合後可引發一系列細胞內變化,最終使細胞發生分化或增殖。表皮生長因子受體是一種受體酪氨酸蛋白激酶,而受體酪氨酸蛋白激酶→Ras→MAPK級聯途徑是表皮生長因子刺激信號傳遞到細胞核內的最主要途徑。它由以下成員組成:表皮生長因子受體→含有SH2結構域的接頭蛋白(如Grb2)→鳥嘌呤核苷酸釋放因子(如SOS)→Ras蛋白→MAPKKK(如Raf1)→MAPKK→MAPK→轉錄因子等(圖21-24)。
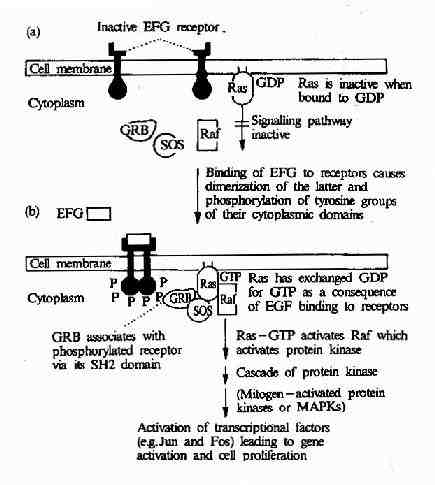
圖21-24 EGF受體介導的信號轉導過程
表皮生長因子與受體結合後,可以使受體發生二聚體化,從而改變了受體的構象,使其中的蛋白酪氨酸激酶活性增強,受體自身的酪氨酸殘基發生磷酸化,磷酸化的受體便形成了與含SH2結構域的蛋白分子Grb2結合的位點,導致Grb2與受體的結合。Grb2中有兩個SH3結構域,該部位與一種稱為SOS的鳥苷酸交換因子結合,使之活性改變,SOS則進一步活化Ras,激活的Ras作用於MAPK激活系統,導致ERK的激活。最後ERK轉移到細胞核內,導致某些轉錄因子的活性改變從而改變基因的表達狀態及細胞的增殖與分化過程。
(2)γ-干擾素受體介導的信號轉導
γ-干擾素是由活化T細胞產生的,它具有促進抗原提呈和特異性免疫識別的作用,並可促進B細胞分泌抗體。γ-干擾素與受體結合以後,也可以導致受體二聚體化,二聚體化的受體可以激活JAK-STAT系統,後者將干擾素刺激信號傳入核內。JAK(Janus Kinase)為一種存在於胞漿中的蛋白酪氨酸激酶,它活化後可使干擾素受體磷酸化。STAT(Signal Transducerand Activator of Transcription)可以通過其SH2結構域識別磷酸化的受體並與之結合。然後STAT分子亦發生酪氨酸的磷酸化,酪氨酸磷酸化的STAT進入胞核形成有活性的轉錄因子,影響基因的表達(圖21-25)。
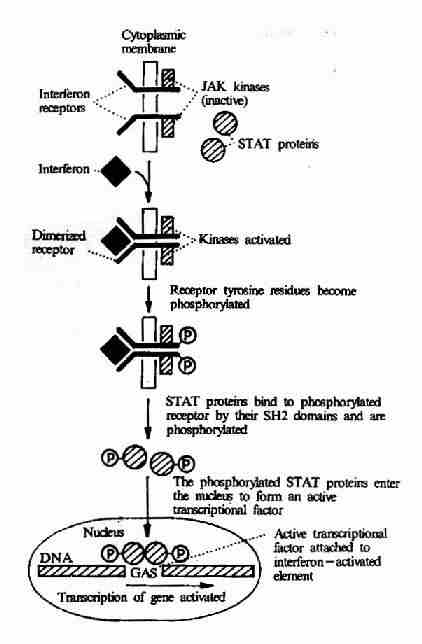
圖21-25 γ-干擾素受體介導的信號轉導過程
JAK:Janus kinase
STAT: Signal Transducer andActivator of Transcription
GAS: γinterferonactivated sequenceelement
上述兩條信號轉導途徑僅僅是多種信號轉導途徑的代表,儘管90年代以來科學家們在細胞信號轉導的分子機理研究方面已經取得了一些成就,但距離闡明細胞中存在的全部傳遞網路系統還十分遙遠,有待科學家們不斷努力,在下個世紀實現人類認識自我的願望。
| 關於「生物化學與分子生物學/膜受體信號轉導的分子機理」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |