臨床生物化學/肝癌的生化機制
| 醫學電子書 >> 《臨床生物化學》 >> 肝膽疾病的生物化學與實驗診斷 >> 某些肝病的生化機制 >> 肝癌的生化機制 |
| 臨床生物化學 |
|
|
㈠某些致癌物質與肝癌發生的關係
⒈乙醯氨基芴(AAF)AAF在肝內經生物轉化後被活化成硫酸AAF,與蛋白質分子中的蛋氨酸殘基及核酸分子中的鳥嘌呤鹼基結合,引起生物高分子的結構與功能的異常。它與DNA結合,使細胞內調控蛋白的合成不足,細菌失去控制,但DNA複製不受影響,從而引起癌變。
⒉黃曲霉毒素 黃曲霉毒素B1被攝入體內後,在肝細菌微粒體混合功能氧化酶催化下轉化成環氧化黃曲霉毒素B1,它可與DNA、RNA結合而致癌。
⒊二甲基氨基偶氨苯(DAB,奶油黃)可引起大鼠實驗性肝癌。DAB在肝細胞混合功能氧化酶作用下N-脫羥化,再在硫酸轉移酶作用下形成N-SO3-O-甲基氨基偶氮苯。後者再與核酸的鳥嘌呤鹼基結合而引起癌變。
㈡肝癌時的代謝變化
⒈蛋白質及胺基酸代謝的變化癌組織中蛋白質合成旺盛,宿主其他組織蛋白質的分解增強。肝癌時,肝癌組織中與胺基酸分解代謝有關的酶(如色氨酸吡咯酶、酪氨酸轉氨酶、蘇氨酸脫水酶、苯丙氨酸轉氨酸及組氨酸酶等)活性顯著降低,表明癌組織中胺基酸分解代謝減弱,可使胺基酸重新用於蛋白質的合成,此現象可能與癌組織的生長有關。另外,與胺基酸轉運有關的γ-谷氨醯轉肽酶活性在肝癌組織中顯著增高。
在肝癌組織中與尿素合成有關的肝組織特異酶-鳥氨酸氨甲醯基轉移酶(OCT)、氨甲醯磷酸合成酶I(CPSI)、精氨酸酶等的活性降低;與核酸合成有關的天冬氨酸氨甲醯基轉移酶(ATC),與細胞增殖及多巴胺合成有關的鳥氨酸脫羧酶(ODC)的活性則增高。在肝癌組織中支鏈胺基酸轉氨酶的活性亦增高,這可能與供能有關。肝癌組織中白蛋白的合成降低。上述事實表明;在肝癌細胞中與增殖有關的酶活性增高,與肝細胞特異性功能有關的酶活性降低。肝癌組織還大量合成甲胎蛋白,呈現腫瘤組織的反分化特徵。
⒉肝癌時糖代謝的變化肝癌組織中與糖代謝有關的酶活性呈下述變化:①糖異生關鍵酶(磷酸烯醇式丙酮酸羧激酶、果糖-1,6-二磷酸酶、葡萄糖-6-磷酸酶等)活性降低,癌瘤惡性程度越高,這些酶活性越低;②糖酵解酶系(已糖激酶、磷酸果糖激酶、丙酮酸激酶等)活性增高,癌瘤惡性程度越高,這些酶的活性越高;③同工酶譜的變化呈現胚胎化,能被調節的高Km型同工酶(已糖激酶Ⅰ-Ⅲ型等)的活性上升。肝癌組織中同工酶譜的變化可使ATP失去對糖酵解的調節作用,這可能是癌細胞失去巴斯德效應的原因之一。肝癌時糖代謝變化的主要特點是:糖的有氧氧化降低(正常肝有氧氧化佔99%,酵解佔1%,肝癌時酵解可佔50%),糖酵解增加,糖異生減少,磷酸戊糖途徑的代謝增強(表10-17)。
⒊肝癌時的脂類代謝在肝癌細胞中可發現磷脂的減少和甘油三酯的增加。在脂質組成中非脂肪酸增加,構成脂質的脂肪酸中出現C20:4的減少和C18:1的增加。在人的肝癌組織中能檢查出非生理性的不飽和脂肪酸,其中最多見的是C20:39。此種不飽和脂肪酸只在血中AFP陽性的肝癌者中出現。
⒋其他據報導:大鼠原發性肝癌、移植性肝癌、癌前期等的肝細胞和正常肝細胞的Na+、K+-ATP酶活性的測定結果是:原發性肝癌和移植性肝癌細胞中該酶的活性都顯著高於正常肝細胞,癌前期肝細胞的Na+、K+-ATP酶活性則高於正常肝細胞而低於癌細胞,提示了肝細胞癌變過程中鈉泵活性的變化規律。肝癌細胞cAMP合成能力大為降低,肝癌組織中腺苷酸環化酶活性明顯低於正常肝組織。
表10-17 正常肝與肝癌組織糖代謝有關酶活性的比較
| 比活性 | |||
| 代謝途徑 | 酶 | ||
| 正 常 肝 | 迅速生長的肝癌組織 | ||
| 已糖激酶 | 100 | 500 | |
| 糖酵解 | 磷酸果糖激酶 | 100 | 229 |
| 丙酮酸激酶 | 100 | 449 | |
| 葡萄糖-6-磷酸酶 | 100 | <1 | |
| 糖異生 | 果糖-1,6-二磷酸酶 | 100 | <1 |
| 磷酸烯醇式丙酮酸羧激酶 | 100 | <1 | |
| 丙酮酸羧化酶 | 100 | <1 | |
| 磷酸戊糖通路 | 6-磷酸葡萄糖脫氫酶 | 100 | 751 |
| 糖酵解/糖異生 | 已糖激酶/葡萄糖-6-磷酸酶 | 100 | 8800 |
| 磷酸果糖激酶/果糖-1,6-二磷酸酶 | 100 | 6463 | |
㈢肝細胞癌變原理
關於細胞癌變的原理除了前述化學致癌物對於細胞的DNA的損傷之外,近10餘年來隨著癌基因與抑癌基因(抗癌基因)研究的進展,人們更加註重肝癌的分子生物學的研究,細胞內本來存在的原癌基因在物理、化學、生物性的致癌因素作用下被激活,通過點突變、基因易位、基因擴增等機制激活後而呈現過度表達,導致更多的癌基因產物(癌蛋白)的產生,造成細胞內基因表達調控的失常,最終導致細胞癌變。在這一癌變過程中不僅有原癌基因的變化,同時伴有抑癌基因的缺失或失活,並且癌變還是多階段一步步地發生,這即多階段癌變學說。所謂多階段癌變學說即是說機體的癌變過程是長期多階段地發生的,正常細胞在癌基因,抑癌基因等的異常的積累過程中,逐漸地離開了正常的細胞增殖控制機制的軌道,分階段地向癌細胞轉化,且惡性程度逐步增加。
近年來,關於肝炎(乙型及丙型)與肝癌的關係日益受到重視。B型肝炎病毒(HBV)與肝癌的發生關係已基本闡明,HBV基因組中的X基因與肝癌有密切關係,用轉基因小鼠實驗證明此X基因可誘發肝癌的發生。X基因編碼的X蛋白使肝細胞的DNA合成提高到發癌的準備狀態,在多階段癌變過程中起到促進作用。X蛋白具有促進DNA合成的作用,在肝細胞癌變過程中,X基因的高水平的持續性的表達是必要的,由於癌變過程中往往幾種癌基因同時表達,因此人們都強調肝細胞癌的發生可能是多種癌基因協同作用的結果。如N-ras表達異常可導致跨膜信號傳遞的改變,進而啟動了ets-2、C-myc、P53等核內表達產物異常,使細胞分裂增加,細胞處於活躍增殖狀態。IGF-Ⅱ和fms表達增強可通過「自分泌」作用使細胞處於不斷生長狀態,多種因素綜合作用最終導致細胞增殖失控而形成肝細胞癌,關於肝細胞癌的多階段癌變學說如圖10-4所示。
C型肝炎病毒與肝癌的發生亦有密切的關係。C型肝炎感染後20年左右導致肝硬化, 30年左右發展成肝癌,在日本肝癌有15%與B型肝炎有關,有80%與C型肝炎有關。本室用PCR技術檢測肝細胞癌中乙型、C型肝炎病毒核酸的結果,表明HBV-DNA陽性率為69.5%,HCV-RNA陽性率為30.4%,在我國C型肝炎與肝細胞癌的關係亦正在日益受到重視。
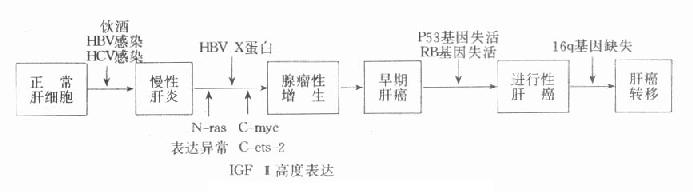
圖10-4 肝細胞癌的多階段癌變學說
| 關於「臨床生物化學/肝癌的生化機制」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |