生物化學與分子生物學/蛋白質合成後的分泌及加工修飾
| 醫學電子書 >> 《生物化學與分子生物學》 >> 蛋白質的生物合成 >> 蛋白質合成後的分泌及加工修飾 |
| 生物化學與分子生物學 |
|
|
|
不論是原核還是真核生物,在細胞漿內合成的蛋白質需定位於細胞特定的區域,有些蛋白質合成後要分泌到細胞外,這些蛋白質叫做分必蛋白。在細菌細胞內起作用的蛋白質一般靠擴散作用而分布到它們的目的地。如內膜含有參與能量代謝和營養物質轉運的蛋白質;外膜含有促進離子和營養物質進入細胞的蛋白質;在內膜與外膜之間的間隙稱為周質,其中含有各種水解酶以及營養物質結合蛋白。
真核生物細胞結構更為複雜,而且有多種不同的細胞器,它們又具有各不相同的膜結構,因此合成好的蛋白質還要面臨跨越不同的膜而到達細胞器械,有些蛋白質在翻譯完成後還要經過多種共價修飾,這個過程叫做翻譯後處理。
(一)細菌中蛋白質的越膜
細胞的內膜蛋白,外膜蛋白和周質蛋白是怎樣越過內膜而到其目的地的呢?絕大多數越膜蛋白的N端都具有大約15-30個以疏水胺基酸為主的N端信號序列或稱信號肽。信號肽的疏水段能形成一段α螺旋結構。在信號序列之後的一段胺基酸殘基也能形成一段α螺旋,兩段α螺旋以反平行方式組成一個髮夾結構,很容易進入內膜的脂雙層結構,一旦分泌蛋白質的N端錨在膜內,後續合成的其它肽段部分將順利通過膜。疏水性信號肽對於新生肽鏈跨膜及把它固定的膜上起一個拐掍作用。之後位於內膜外表面的信號肽酶將信號肽序列切除。當蛋白質全部翻譯出來後,羧端穿過內膜,在周質中摺疊成蛋白質的最終構象(圖18-18)。
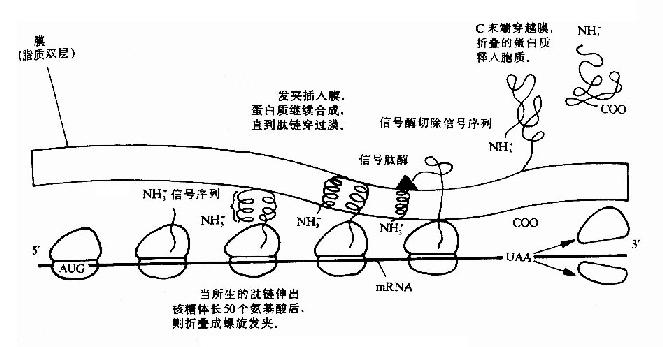
圖18-18 蛋白質合成後的分泌過程
(二)真核生物蛋白質的分泌
真核生物不但有細胞核、細胞質和細胞膜,而且還有許多膜性結構的細胞器,在細胞須內合成的蛋白質怎樣的到達細胞的不同部位呢?了解比較清楚的是分泌性蛋白質的轉運。
像原核細胞一要,真核細胞合成的蛋白質N端也有信號肽也能形成兩個α螺旋的髮夾結構,這個結構可插入到內質網的膜中,將正在合成中的多肽鏈帶和內質網內腔。80年代中期在胞漿中發現一種由小分子RNA和蛋白質共同組成的複合物,它能特異地與信號肽識別而命名為信號肽識別顆粒。它的作用是識別信號肽與核糖體結合併暫時阻斷多肽鏈的合成。內質網外膜上的SRP受體,當ARP與受體結合後,信號肽就可插入內質網進入內腔,被內質網內膜壁上的信號肽酶水解除去SRP與受體結合後,信號肽就可插入內質網進入內腔,被內質網內腔壁上的信號肽酶水解除去SRP與受體解離並進入新的循環,而信號肽後序肽段也進入內質網內腔,並開始繼續合成多肽鏈(圖18-19)。
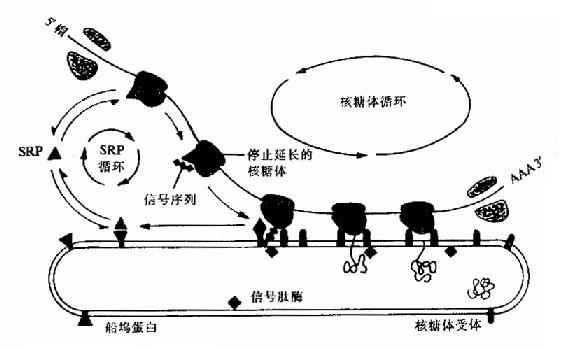
圖18-19 在蛋白質越過內質網的轉運過程中,SRP和船塢蛋白(或SRP受體)的作用
SRP對翻譯階段作用的重要生理意義在於:分泌性蛋白及早進入細胞的膜性細胞,能夠正確的摺疊、進行必要的後期加工與修飾並順利分泌出細胞。
現以哺乳動物的胰島素為例說明這種分泌過程。胰島素由51個胺基酸殘基組成,但胰島素mRNA的翻譯產和在兔網織紅細胞無細胞翻譯體系中為86個胺基酸殘基,稱為胰島素原,在麥胚無細胞翻譯系統中為110個胺基酸殘基組成的前胰島素原,後來證明,在前胰島素原的N末端有一段富含疏水胺基酸的肽段做為信號肽,使前胰島素原能穿越內質網膜進入內質網內腔,在內腔壁上信號肽被水介。所以在哺乳動物細胞內,當多肽鏈合成完成時,前胰島素原已成為胰島素原。然後胰島素原被運到高爾基複合體,切去C肽成為成熟的胰島素,最終排出胞外。像真核細胞的前清蛋白,免疫球白輕鏈,催乳素等都有相似的分必方式。
(三)蛋白質翻譯後加工修飾
從核糖體上釋放出來的多肽鏈,按照一級結構中胺基酸側鏈的性質,自竹捲曲,形成一定的空間結構,過去一直認為,蛋白質空間結構的形成靠是其一級結構決定的,不需要另外的信息。近些年來發現許多細胞內蛋白質正確裝配都需要一類稱做「分了伴娘」的蛋白質幫助才能完成,這一概念的提出並未否定「胺基酸順序決定蛋白空間結構」這一原則。而是對這一理論的補充,分子伴娘這一類蛋白質能介導其它蛋白質正確裝配成有功能活性的空間結構,而它本身並不參與最終裝配產物的組成。目前認為「分子伴娘」蛋白有兩類,第一類是一些酶,例如蛋白質二硫鍵異構酶可以識別和水解非正確配對的二硫鍵,使它們在正確的半胱氨酸殘基位置上重新形成二硫鍵,第二類是一些蛋白質分子,它們可以和部分摺疊或沒有摺疊的蛋白質分子結合,穩定它們的構象,免遭其它酶的水解或都促進蛋白質摺疊成正確的空間結構。總之「分子伴娘」蛋白質合成後摺疊成正確空間結構中起重要作用,對於大多數蛋白質來說多肽鏈翻譯後還要進行下列不同方式的加工修飾才具有生理功能。
1.氨基端和羧基端的修飾
在原核生物中幾乎所有蛋白質都是從N-甲醯蛋氨酸開始,真核生物從蛋氨酸開始。甲醯基經酶水介而除去,蛋氨酸或者氨基端的一些胺基酸殘基常由氨肽酶催化而水介除去。包括除去信號肽序列。因此,成熟的蛋白質分子N-端沒有甲醯基,或沒有蛋氨酸。同時,某些蛋白質分子氨基端要進行乙醯化在羧基端也要進行修飾。
2.共價修飾
許多的蛋白質可以進行不同的類型化學基團的共價修飾,修飾後可以表現為激活狀態,也可以表現為失活狀態。
(1)磷酸化:
磷酸化多發生在多肽鏈絲氨酸,蘇氨酸的羥基上,偶爾也發生在酪氨酸殘基上,這種磷酸化的過程受細胞內一種蛋白激酶催化,磷酸化後的蛋白質可以增加或降低它們的活性,例如:促進糖原分解的磷酸化酶,無活性的磷酸化酶b經磷酸化以後,變居有活性的磷酸化酶a。而有活性的糖原合成酶I經磷酸化以後變成無活性的糖原合成酶D,共同調節糖元的合成與分介。
(2)糖基化:
質膜蛋白質和許多分泌性蛋白質都具有糖鏈,這些寡糖鏈結合在絲氨酸或蘇氨酸的羥基上,例如紅細胞膜上的ABO血型決定簇。也可以與天門冬醯胺連接。這些寡糖鏈是在內質網或高爾基氏體中加入的(圖18-20)。
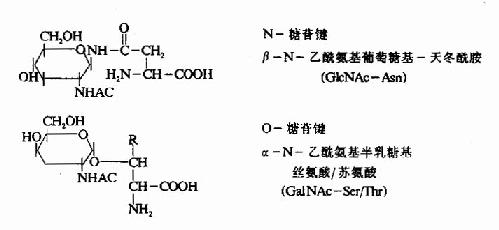
圖18-20 糖蛋白中常見的糖一肽連接鍵
(3)羥基化:
膠原蛋白前α鏈上的脯氨酸和賴氨酸殘基在內質網中受羥化酶、分子氧和維生素C作用產生羥脯氨酸和羥賴氨酸,如果此過程受障礙膠原纖維不能進行交聯,極大地降低了它的張力強度。
(4)二硫鍵的形成:
mRNA上沒有胱氨酸的密碼子,多肽鏈中的二硫鍵,是在肽鏈合成後,通過二個半胱氨酸的疏基氧化而形成的,二硫鍵的形成對於許多酶和蛋白質的活性是必需的。
3.亞基的聚合:
有許多蛋白質是由二個以上亞基構成的,這就需這些多肽鏈通過非共價鍵聚合成多聚體才能表現生物活性。例如成人血紅蛋白由兩條α鏈,兩條β鏈及四分子血紅素所組成,大致過程如下:α鏈在多聚核糖體合成後自行釋下,並與尚未從多聚核糖體上釋下的β鏈相連,然後一併從多聚核糖體上脫下來,變成α、β二聚體。此二聚體再與粒線體內生成的兩個血紅素結合,最後形成一個由四條肽鏈和四個血紅素構成的有功能的血紅蛋白分子。
4.水介斷鏈:
一般真核細胞中一個基因對應一個mRNA,一個mRNA對應一條多肽鏈,但也有少數的情況,即一種三思而行翻譯後的多肽鏈經水介後產生幾種不同的蛋白質或多肽。例如哺乳動物的鴉片樣促黑皮激素原初翻譯產物為265個胺基酸,它在腦下垂體前葉細胞中,POMC初切割成為N-端片斷和C端片段的β-促脂解激素。然後N端片段又被切割成較小的N端片斷和工9肽的促腎上腺皮質激素。而在腦下垂體中葉細胞中,β-促脂解激素再次被切割產生β-內啡肽;ACTH也被切割產生13肽的促黑激素(α-melanotropin)(圖18-21)。
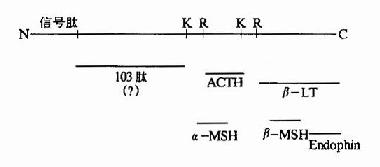
圖18-21 POMC作為多種活性物質的前體
第一行為POMC前體,K、R為賴氨酸和精氨酸殘基
| 關於「生物化學與分子生物學/蛋白質合成後的分泌及加工修飾」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |