生物化學與分子生物學/激素對物質代謝的調節
| 醫學電子書 >> 《生物化學與分子生物學》 >> 物質代謝調節 >> 激素對物質代謝的調節 |
| 生物化學與分子生物學 |
|
|
細胞的物質代謝反應不僅受到局部環鏡的影響,即各種代謝底物、產物的正、負反饋調節,而且還受來自於機體其它組織器官的各種化學信號的控制,激素就屬於這類化學信號。激素是一類由特殊的細胞合成並分泌的化學物質,它隨血液循環於全身,作用於特定的組織或細胞(稱為靶組織或靶細胞,target cell),指導細胞物質代謝沿著一定的方向進行。同一激素可以使某些代謝反應加強,而使另一些代謝反應減弱,從而適應整體的需要。對於每一個細胞來說,激素是外源性調控信號,而對於機體整體而言,它仍然屬於內環境的一部分。通過激素來控制物質代謝是高等動物體內代謝調節的一種重要方式。
激素的作用必須通過其受體來實現。受體是一類可以與相應的配體(ligand)特異地結合的物質,常為糖蛋白或脂蛋白。激素作為一類配體,與受體的結合具有高度的特異性和親和性。只有那些具有相應受體的細胞才可以成為該激素的靶細胞。
在糖、脂類和胺基酸代謝過程中,具有重要調節作用的激素-胰島素、腎上腺素和胰高血糖素等(具體作用見代謝各章)均為水溶性物質,因此不能進入細胞內。但這類激素的受體均存在於細胞膜表面,那麼它們是如何通過與細胞膜表面受體結合,將位於胞外的化學信號傳遞至胞內,又是如何引起細胞內各種代謝過程的改變的呢?這裡以腎上腺素為例做一簡要說明。
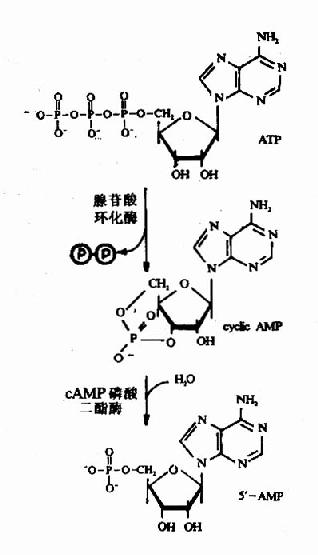
圖9-5 CAMP的結構和代謝
(一)cAMP是激素在細胞內的信使
五十年代初期,Sutherland在實驗中發現,肝細胞組織切片若加入腎上腺素,可以加速肝糖原分解為葡萄糖;測定磷酸化酶(分解肝糖元的酶),發現其活性增加。因此他認為,磷酸化酶是肝糖元分解的限速酶,腎上腺素能激活此酶。但是,若用純化的磷酸化酶與腎上腺素一起溫育,後者對酶則沒有激活作用。由此提示,腎上腺素激活磷酸化酶是一間接過程,需要肝細胞中其它物質的協助。進一步對肝勻漿做試驗,若其中加入ATP、Mg++及腎上腺素,則磷酸化酶又可被激活。若只取肝勻漿離心後的上清液,則不能觀察到腎上腺素的這種激活作用;只有再加入沉澱中的細胞膜,激活效應才又恢復。這一實驗表明,腎上腺素對磷酸化酶的激活至少需要兩種以上的因素。後來的實驗證實,腎上腺素首先作用於細胞膜,使膜上的腺苷酸環化酶活化,後者使細胞內ATP在Mg2+的存在下轉變為cAMP,而cAMP可再使胞漿中的磷酸化酶b轉變為磷酸化酶a。由於腎上腺素並不進入細胞,其作用是通過細胞內cAMP傳遞的,因此將cAMP稱為細胞內信使(Intracellular Messenger)。
cAMP廣泛存在於生物界,但其在正常細胞中的含量甚微,僅為0.1μM,在激素作用下,可升高約100倍。細胞中cAMP的濃度除了與催化cAMP生成的腺苷酸環化酶有關外,還受到催化cAMP分解的磷酸二酯酶的控制(見圖9-5)。
有許多藥物能抑制磷酸二酯酶的活性,如甲基黃嘌呤(包括茶鹼、氨茶鹼和咖啡因等)。二丁基cAMP不易被磷酸二酯酶水解,同時又能抑制此酶活性,故有提高cAMP水平的作用。
激素中多數激素可使cAMP的生成加速,少數激素則可以降低細胞內cAMP的濃度。大部分肽類激素,包括胰高血糖素、甲狀旁腺素、降鈣素、抗利尿激素和催產素等以及兒茶酚胺類激素均可通過相應的受體激活靶細胞膜上的腺苷酸環化酶,從而使胞內cAMP的濃度增加。
現將幾種激素對cAMP濃度的影響及其與受體結合後引起的生理效應列表如下:
表9-3 某些激素對cAMP濃度的影響及其最終生理效應
| 激素 | 靶組織或靶器官 | cAMP濃度 | 對酶或化學反應的影響 | 最終生理效應 |
| 腎上腺素 | 肝 | ↑ | 糖原合成酶↓ | 糖原合成↓ |
| 磷酸化酶↑ | 糖原分解↑ | |||
| 脂肪組織 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 心肌、骨骼肌 | ↑ | 磷酸化酶↑ | 糖原分解↑ | |
| 胰高血糖素 | 肝、心肌 | ↑ | 磷酸化酶↑ | 糖原分解↑ |
| 脂肪組織 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 胰島β-細胞 | ↑ | - | 胰島素分泌↑ | |
| 促腎上腺皮質激素 | 腎上腺皮質 | ↑ | 膽固醇→孕烯醇酮↑ | 糖皮質激素合成↑ |
| (ACTH) | 脂肪組織 | ↑ | 脂肪酶↑ | 脂肪分解↑ |
| 促甲狀腺激素 | 甲狀腺 | ↑ | 磷酸化酶↑ | 糖原分解↑,攝到碘 |
| (TSH) | 及合成分泌T3、T4↑ | |||
| 脂肪組織 | ↑ | 脂肪酶↑ | 脂肪分解↑ | |
| 脂肪組織 | ↓ | 脂肪酶↓ | 脂肪分解↓ | |
| 胰島素 | 肝、骨骼肌 | ↓ | 磷酸化酶↓ | 糖原分解↓ |
| 糖原合成酶↑ | 糖原合成↑ | |||
| 丙酮酸→磷酸烯醇式丙酮酸↓ | 糖異生↑ |
↑代表增高或增強 ↓代表降低或減弱
激素與其專一性細胞膜受體結合後,是如何激活腺苷酸環化酶的呢?近來有人認為,GTP和GTP調節蛋白即G蛋白,起著介導激素對腺苷酸環化酶激活的作用。當激素與受體結合後,G-蛋白與TP結合,生成GTP-G蛋白複合物,後者能活化腺苷酸環化酶(詳見第十二章)。
(二)cAMP依賴性蛋白激酶是cAMP的靶分子
cAMP作為變構劑作用於cAMP依賴性蛋白激酶(cAMP-dependentProtein Kinase A激酶)。這種蛋白激酶由兩個亞基組成,一個亞基是催化亞基,具有催化蛋白質磷酸化的作用;另一個亞基是調節亞基,是催化亞基的抑制物。當調節亞基與催化亞基結合時,酶呈無活性狀態。cAMP的效應是與調節亞基結合,使後者發生變構而脫離催化亞基,從而使催化亞基進入激活狀態(圖9-6)。
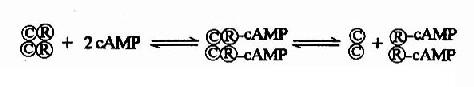
圖9-6 蛋白激酶的激活過程 C為催化亞基 R為調節亞基
活化形式的催化亞基在ATP的作用下,使細胞中的相應底物磷酸化,從而改變這些蛋白質的功能:有些被激活,有些則被抑制。例如,糖原分解過程中的磷酸化酶可在A激酶的作用下被磷酸化而激活(圖9-6),而糖原合成酶則在A激酶的作用下被磷酸化而失去活性。總的效應是糖原分解加強和糖原合成的抑制,使血糖濃度升高。
總之,很多多肽和兒茶酚胺類激素的作用是通過下列過程來實現的,即激素與膜受體結合→腺苷酸環化酶活性↑→cAMP水平↑→A激酶被激活→蛋白質發生磷酸化→生理效應發生。
八十年代中期,對腺苷酸環化酶活化機制的研究導致了另外一種重要的調節蛋白桮蛋白的發現。G蛋白在膜受體和腺苷酸環化酶間具有中介作用。它的發現使我們更為深入地認識了激素的作用機理(詳見第十二章)。
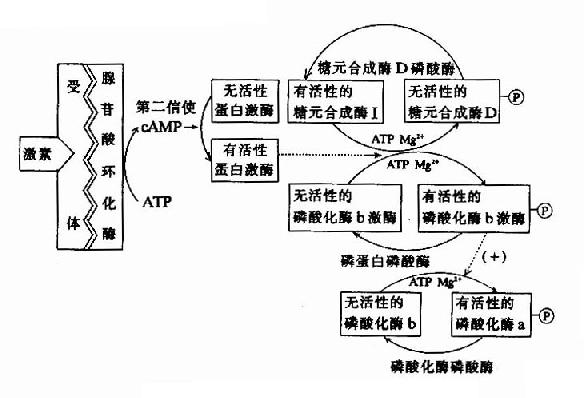
圖9-7 激素調節糖原代謝的連續激活反應
| 關於「生物化學與分子生物學/激素對物質代謝的調節」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |