臨床生物化學/胎盤激素
| 醫學電子書 >> 《臨床生物化學》 >> 妊娠的臨床生物化學 >> 妊娠期的內分泌特點 >> 胎盤激素 |
| 臨床生物化學 |
|
|
妊娠期胎盤能合成大量甾體激素如雌激素(雌二醇、雌酮、雌三醇)、孕激素(孕酮、孕二醇)等,此外胎盤還合成大量蛋白激素如絨毛膜促性腺激素、胎盤生乳素等。人類胎盤合成分泌的主要激素有:
人類胎盤絨毛膜促性腺激素(human chorionicgonadotropin,hCG)為蛋白,分子量約為39000u,由α-亞基與β-亞基以11-12個硫鍵互聯而成,它在胎盤合體滋養層細胞內合成,為胎盤獨有。α-亞基分子量為14900,含92個胺基酸及40%糖;β亞基則由145胺基酸組成,其分子量為23000u,含糖約30%。黃體生成素(LH)、卵泡刺激素(FSH)及促甲狀腺激素(TSH)的α-亞基結構與hCG的α-亞基結構大致相同,這四種激素的區別僅在於β-亞基結構不同。胚胎著床後hCG的生成量呈對數遞增,到6-8周達高峰,妊娠60-80天達到最高峰,隨後逐漸下降,到妊娠160-180天時下降到最低點,此後稍又回升繼續保持到分娩。妊娠早期hCG的主要功能是維持卵巢的黃體分泌孕酮以維持早期胚胎髮育的需要;它在胎兒-胎盤複合體中還促進類固醇激素的生物合成。
(二)人類胎盤催乳素
人類胎盤催乳素(human placenta lactogen,hPL)也稱人類絨毛膜促生長催乳素(human chorionicsomatamammotropin,hCS),為單鏈多肽類激素,其分子量為21600u,由190個胺基酸殘基合成,含有兩條鏈內二硫鍵。人胎盤催乳素與人生長激素有160個相同的胺基酸殘基序列,因此二者在免疫學與生物學方面密切相關。hPL也由胎盤合體滋養層細胞合成與分泌,分泌後大部分進入絨毛間隙和胎盤血竇,很少出現於胎體內。
妊娠5-6周即可用放射免疫法測出血漿中的hPL,以後分泌量緩慢上升,自15-30周時即迅速增高,到妊娠34周時達高峰,約7.75mg/L-10.6mg/L以後維持此水平直到分娩。hPL的半壽期在21-23分鐘之間,分泌量與胎盤體積成正比;足月妊娠時,每日每百克胎盤約分泌0.5g hPL,以此計算整個胎盤每日分泌1-2g 左右的hPL,產後迅速下降,3-6小時即測不出。
hPL的功能是在孕婦體內與胰島素、皮質激素協同作用促進乳腺發育及促進正氮平衡,有利於妊娠期蛋白質的蓄積。hPL還抑制脂肪沉積作用,促進脂肪分解使血中游離脂酸升高。當血液中游離脂酸較葡萄糖佔優勢時,肌組織主要以游離脂酸作為能源,減少對葡萄糖的攝取,有利於胎兒從母血大量地攝取葡萄糖。hPL這一功能是胎兒迅速生長發育的重要條件。hPL在母血中含量與胎盤重量及胎兒體重相關,可直接反映胎盤的功能狀態。
(三)孕酮
孕激素主要有孕酮及其代謝產物孕烷二醇,屬甾體激素。孕酮由卵巢和腎上腺合成。
胎盤能利用孕母血中的膽固醇合成孕酮,從妊娠36天起它即能生產足夠孕酮。非孕婦血漿孕酮值在0-15ng/ml,孕婦於妊娠第5周時血清中的濃度為24±7.3ng/ml,到孕32周時增高到125.2±37ng/ml,到37孕周達到最高峰為150ng/ml,一直保持到臨產前才稍降。待胎盤娩出後迅速降至10-20ng/ml。這證明妊娠末期孕婦血清高水平的孕酮來自胎盤分泌。妊娠早期孕酮日分泌為30-50mg左右(未孕婦僅1-25mg/d),主要為妊娠黃體分泌,到孕末期分泌量為250-300mg/d。胎盤合成的孕酮大部分進入母體與胎兒並進行代謝,主要代謝產物為孕烷二醇,後者主要在肝轉變成葡萄糖酸苷及硫酸酯等結合形式,結合型水溶性增加,易從尿中排出,妊娠期末期孕婦尿液中孕烷二醇日排泄量約為35-40mg。血中孕烷二醇的水平隨孕酮水平而變動,尿中排泄量也與孕婦血中孕酮量成正比。胎盤內孕酮的合成過程以圖14-1簡示。
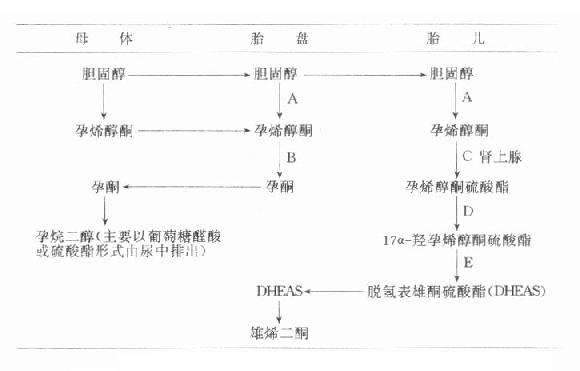
圖14-1 胎兒-胎盤複合體孕酮合成途徑
有關酶類:A=C20-22裂解酶;B=3β-脫氫酶;C=硫酸酯激酶;
D=17α-羥化酶;E=C17-20裂解酶
從圖14-1可見,胎盤合成孕酮的原料是膽固醇,它來源於母血供應。母血還可直接輸送孕酮的前身物-孕烯醇酮,用於合成孕酮。
(四)雌激素
雌激素屬甾體激素,非孕婦女主要由卵巢、腎上腺皮質合成。雌激素主要有雌酮(E1)、雌二醇(E2)及雌三醇(E3)。由於胎盤組織也能合成雌酮、雌二醇及雌三醇,故正常妊娠婦女的雌激素水平隨妊娠月份進展而不斷增高,到妊娠第7周時胎盤生成的雌激素已超過50%,因此妊娠期婦女除妊娠頭幾周外,胎盤才是雌激素的重要合成器官。
正常早期孕婦,雌酮、雌二醇主要來源於卵巢,雌三醇是前兩者在外周組織的代謝產物。妊娠期雌激素75%-95%來源於胎兒-胎盤複合體。這是因為胎盤中合成雌激素的某些酶活性極低,而這些酶在胎兒腎上腺、胎肝內卻十分豐富。因此要完成整個雌激素的合成與代謝,必須依賴正常的胎兒與胎盤的共同活動,即把胎兒與胎盤視為一個完整的功能單位與統一體,稱之為胎兒-胎盤複合體。但此複合體又與母體不可分割,因為合成雌激素的前體來自母血供應。所以母體與胎兒-胎盤複合體在合成雌激素時三位一體,只不過胎盤是雌三醇最終生成部位而已。
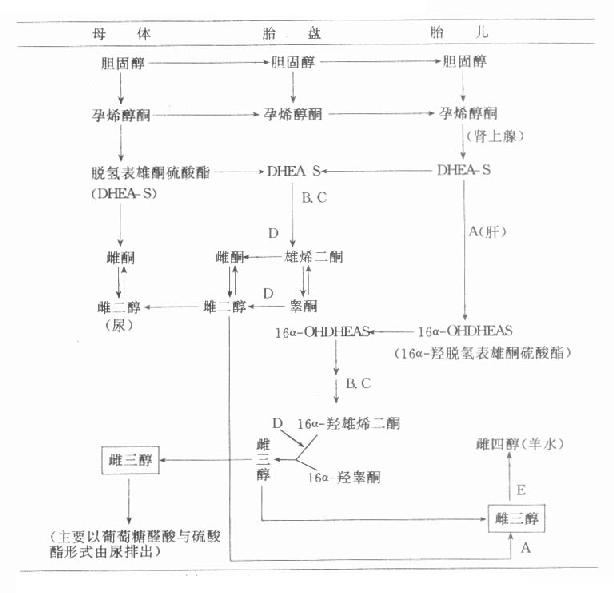
圖14-2 胎兒-胎盤複合體雌激素合成途徑
有關酶類:A=16α-羥化酶;B=硫酸酯酶;C=3β-羥化酶;D=芳香化酶;E=15α-羥化酶
從圖14-1可見,胎兒也能利用從胎盤輸送來的膽固醇,或自身合成的膽固醇作為原料,在C20-22裂解酶作用下轉變成孕烯醇酮。胎兒腎上腺中存在活性很強的硫酸酯激酶,後者經17α-羥化酶作用下生成17α-羥孕烯醇酮硫酸酯,繼而它又在C17-20裂解酶催化下生成脫氫表雄酮硫酯(dehydroepiandrosteronesul-fate,DHEAS)。胎兒生成的DHEAS可返回胎盤在硫酸酯酶及3β-羥化酶作用下生成雄烯二酮,成為合成雌激素的原料。
雄烯二酮可轉變成睾酮,睾酮經胎盤內的芳香化酶作用生成雌二醇。雄烯二酮還可直接芳香化而成雌酮,胎盤生成的這兩種激素可返回到母體內,成為孕婦血中激素最重要來源。胎兒體內生成的DHEAS還可在胎肝內存在的16α-羥化酶作用下生成16α-羥脫氫表雄酮硫酸酯(16α-OHDHEAS)。16α-OHDHEAS進入胎盤後生成16α-羥雄烯二酮及16α-羥睾酮,這兩種雄激素經胎盤內芳香化酶作用轉變成雌三醇,雌三醇可返回母體或進入胎兒體內(圖14-2)。
胎盤生成的雌二醇在胎兒體內經16α-羥化酶作用轉變為雌三醇,進入胎兒體內的雌三醇,在胎肝內經15α-羥化酶作用最科均生成雌四醇(圖14-2)。胎兒生成的雌四醇可出現在羊水等體液內,孕婦尿液中的雌四醇的最主要來源也是最終經胎肝生成的。
正常妊娠期婦女血液激素組分的變化可參見表14-1。
表14-1 正常妊娠期血液激素組分的變化
| 激 素 | 非妊娠婦女(範圍) | 妊娠後期婦女(範圍) |
| 黃體生成素(LH mIU/ml) | 5-25 | <2 |
| 促卵泡成熟激素(FSH mIU/ml) | 2-15 | <2 |
| 垂體生乳素(PRL ng/ml) | 5-25 | 100-300 |
| 生長激素(GH ng/ml) | <5 | <7 |
| 促腎上腺皮質激素(ACTH ng/ml) | 7.8-120 | 12-60 |
| 總T4μg/dl | 5-12 | 7-8 |
| 總T3μg/dl | 50-250 | 120-280 |
| 可的松μg/dl | 5-25 | 10-40 |
| DOC ng/dl | 4-16 | 50-200 |
| 醛固酮ng/dl | 2-10 | 40-150 |
| 雌三醇ng/dl | 0.07-0.3 | 5-25 |
| 孕酮ng/dl | 1-25 | 7.0-250 |
| 1,25-(OH)2D3pg/ml | 10-90 | 20-200 |
| 關於「臨床生物化學/胎盤激素」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |