生物化學與分子生物學/酶分子結構的調節
| 醫學電子書 >> 《生物化學與分子生物學》 >> 物質代謝調節 >> 細胞水平的代謝調節 >> 酶分子結構的調節 |
| 生物化學與分子生物學 |
|
|
(一)變構調節
1.變構調節的概念 某些物質能與酶分子上的非催化部位特異地結合,引起酶蛋白的分子構象發生改變,從而改變酶的活性,這種現象稱為酶的變構調節或稱別位調節(allosteric regulation)。受這種調節作用的酶稱為別構酶或變構酶(allostericenzyme),能使酶發生變構效應的物質稱為變構效應劑(allosteric effector);如變構後引起酶活性的增強,則此效應劑稱為激活變構劑(allosteric activator)或正效應物;反之則稱為抑制變構劑(allostericinhibitor)或負效應物。變構調節在生物界普遍存在,它是人體內快速調節酶活性的一種重要方式。現將某些代謝途徑的變構效應劑列表如下:
| 代謝途徑 | 變構酶 | 激活變構劑 | 抑制變構劑 |
| 糖氧化分解 | 已糖激酶 | G-6-P | |
| 磷酸果糖激酶 | AMP、ADP、FDP、Pi | ATP、檸檬酸 | |
| 丙酮酸激酶 | FDP | ATP、乙酸CoA | |
| 異檸檬酸脫氫酶 | AMP | ATP、長鏈脂醯CoA | |
| 檸檬酸合成酶 | ADP、AMP | ATP | |
| 糖異生 | 果糖-1,6-二磷酸酶 | AMP | |
| 丙酮酸羥化酶 | 乙醯CoA、ATP | ||
| 脂肪酸合成 | 乙醯CoA羥化酶 | 檸檬酸、異檸檬酸 | 長鏈脂醯CoA |
2.變構調節的生理意義 變構效應在酶的快速調節中佔有特別重要的地位。在前面已經提及,代謝速度的改變,常常是由於影響了整條代謝通路中催化第一步反應的酶或整條代謝反應中限速酶的活性而引起的。這些酶對底物不遵守米曼氏動力學原則。它們往往受到一些代謝物的抑制或激,這些抑制或激活作用大多是通過變構效應來實現的。因而,這些酶的活力可以極靈敏地受到代謝產物濃度的調節,這對機體的自身代謝調控具有重要的意義。例如,變構酶對於人體能量代謝的調節具有重要意義。在休息狀態下,機體能量消耗降低,ATP在細胞內積聚,而ATP是磷酸果糖激酶的抑制變構劑,所以導致F-6-P和G-6-P的積聚,G-6-P又是已糖激酶的抑制變構劑,從而減少葡萄糖的氧化分解。同時,ATP也是丙酮酸激酶和檸檬酸合成酶的抑制變構劑,更加強了對葡萄糖氧化分解的抑制,從而減少了ATP的進一步生成。反之,當體內ATP減少而ADP或AMP增加時,AMP則可抑制果糖1,6-二磷酸酶,降低糖異生,同時激活磷酸果糖激酶和檸檬酸合成酶等酶,加速糖的分解氧化,利於體內ATP的生成。這樣,通過變構調節,使體內ATP的生成不致過多或過少,保證了機體的能源被有效利用。
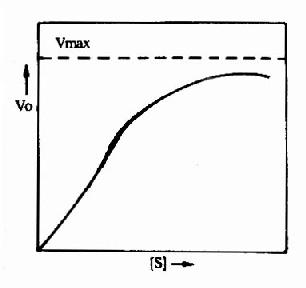
圖9-1 變構酶的底物濃度曲線
3.變構調節的機理 目前已知,能受變構調節的酶,常常是由兩個以上亞基組成的聚合體。有的亞基與作用物結合,起催化作用,稱為催化亞基;有的亞基與變構劑結合,發揮調節作用,稱調節亞基。但也可在同一亞基上既存在催化部位又存在調節部位。變構劑與調節亞基(或部位)間是非共價鍵的結合,結合後改變酶的構象(如,變為疏鬆或緊密),從而使酶活性被抑制或激活。變構酶與米-曼氏酶不同,其動力學不符合米曼氏方程式:酶促反應速度和作用物濃度的關係曲線不呈矩形而常常呈S形,S形曲線與氧合血紅蛋白的解離曲線相似(圖9-1)。
當變構劑與調節亞基(或部位)結合後,變物劑對酶分子的構象發生什麼樣的影響呢?下面以果-1,6-二磷酸酶為例闡述這一過程。果糖-1,6-二磷酸酶是由四個結構相同的亞基所組成,每個亞基的分子量約為310,000Da。每個亞基上既有催化部位也有調節部位。在催化部位上能結合一分子FDP,在調節部位上能結合一分子變構劑。此酶有兩種存在形式,即緊密型(T型、高活性)與鬆弛型(R型、低活性)。AMP是此酶的抑制變構劑。當酶處於T型時,因其調節部位轉至聚合體內部而難以與AMP結合,故對AMP不敏感而表現出較高的活性。在第一個AMP分子與調節部位結合後,T型逐步轉變成R型,各亞基構象相繼發生改變,調節部位相繼暴露,與AMP的親和力逐步增加,酶的活性逐漸減弱,這就是果糖-1,6-二磷酸酶由緊密型變成鬆弛型的變構過程。抑制變構劑促進高活性型至低活性型的轉變,激活變構劑則促進低活性型至高活性型的轉變。這一變構過程是可逆的(圖9-2)。圖中3-磷酸甘油醛和脂肪酸-載體蛋白可使活性型轉變為高活性型。
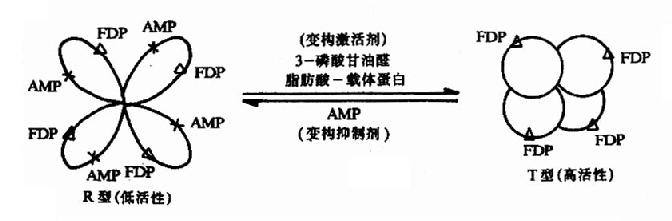
圖9-2 果糖-1,6二磷酸酶的變構效應
△:酶亞基上的催化部位 X:酶亞基上的調節部位 FDP:果糖-1,6-二磷酸
變構效應劑可以是酶的底物,也可以是酶系的終產物,還有的是與它們結構不同的其他化合物,一般說,都是小分子物質。一種酶可有多種變構效應劑存在。
果糖-1,6-二磷酸酶的變構過程是T型與R型的可逆轉變。有些酶的變構效應還可表現為酶分子的聚合或解聚,如乙醯CoA羧化酶,它是脂肪酸合成過程中的關鍵酶。它是由四種不同亞基構成的原聚體,每個亞基有不同的功能,分別是:生物素載體蛋白,它能結合輔基生物素;生物素羧化酶,它能催化生物素髮生羧化反應;羧基轉移酶,它能將生物素上的羧基轉移給乙醯CoA形成丙二醯CoA;和調節亞基,它能與檸檬酸或異檸檬酸結合,使原聚體聚合為多聚體。Kieinschmidt等已在電子顯微鏡下看到了由檸檬酸和異檸檬酸使原聚體聚合形成的纖維狀的多聚體(圖9-3)。只有多聚體酶才有催化活性。ATPMg++可使多聚體解聚為原聚體而使酶失活。長鏈脂醯CoA可拮抗檸檬酸的促聚合作用,因此,它們都是該酶的變構抑制劑。
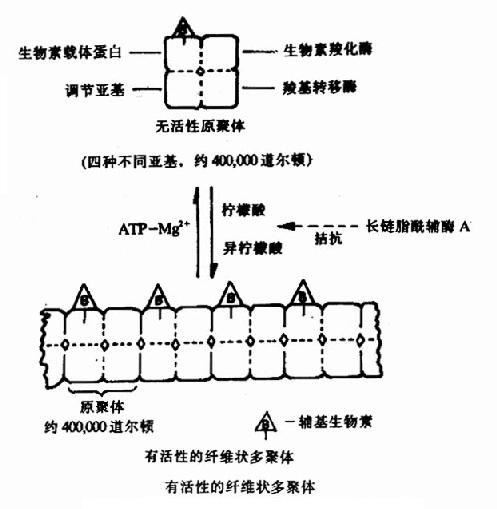
圖9-3 乙醯CoA羧化酶聚合解聚示意圖
(二)酶分子化學修飾調節
1.酶分子化學修飾的概念
酶分子肽鏈上的某些基團可在另一種酶的催化下發生可逆的共價修飾,從而引起酶活性的改變,這個過程稱為酶的酶促化學修飾(chemical modification)。如磷酸化和脫磷酸,乙醯化和去乙醯化,腺苷化和去腺苷化,甲基化和去甲基化以及-SH基和-S-S-基互變等,其中磷酸化和脫磷酸作用在物質代謝調節中最為常見。
細胞內存在著多種蛋白激酶(ProteinKinase),它們可以將ATP分子中的γ-磷酸基團轉移至特定的蛋白分子底物上,使後者磷酸化(phosphorylation)。磷酸化反應可以發生在絲氨酸、蘇氨酸或酪氨酸殘基上。催化絲氨酸或蘇氨酸殘基磷酸化的酶統稱為蛋白絲氨酸/蘇氨酸激酶(Protein Serine/Threonine Kinase)。催化酪氨酸殘基磷酸化的酶統稱為蛋白酪氨酸激酶(ProteinTyrosine Kinase)。與此相對應的,細胞內亦存在著多種蛋白絲氨酸/蘇氨酸磷酸酶(ProteinSerine/Threonine Phosphotase)和蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphotase),它們可將相應的磷酸基團移去。酶的化學修飾如變構調節一樣,也是機體物質代謝中快速調節的一種重要方式,表9?列出了一些酶的酶促化學修飾的實例。
表9-2 某些酶的酶促化學修飾調節
| 酶類 | 反應類型 | 效應 |
| 糖無磷酸化酶 | 磷酸化/脫磷酸 | 激活/抑制 |
| 磷酸化酶b激酶 | 磷酸化/脫磷酸 | 激活/抑制 |
| 磷酸化酶磷酸酶 | 磷酸化/脫磷酸 | 抑制/激活 |
| 糖元合成酶 | 磷酸化/脫磷酸 | 抑制/激活 |
| 丙酮酸脫羥酶 | 磷酸化/脫磷酸 | 抑制/激活 |
| 脂肪酶(脂肪細胞) | 磷酸化/脫磷酸 | 激活/抑制 |
| 谷氨醯胺合成酶(大腸桿菌) | 腺苷化/脫腺苷 | 抑制/激活 |
| 黃嘌呤氧化(脫氫)酶 | -SH/-S-S- | 脫氫/氧化 |
2.酶促化學修飾的機理
肌肉糖元磷酸化酶的酶促化學修飾是研究得比較清楚的一個例子。該酶有兩種形式,即無活性的磷酸化酶b和有活性的磷酸化酶a。磷酸化酶b是二聚體,分子量約為85,000Da。它在酶的催化下,使每個亞基分別接受ATP供給的一個磷酸基團,轉變為磷酸化酶a,後者具有高活性。兩分子磷酸化酶a二聚體可以再聚合成活性較低的(低於高活性的二聚體)磷酸化酶a四聚體(圖9-4)。
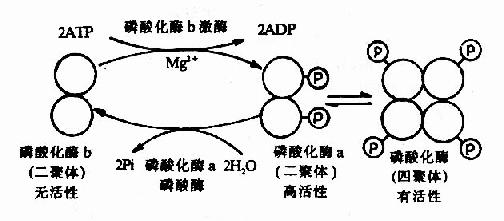
圖9-4 肌肉磷酸化酶的酶促化學修飾作用
3.酶促化學修飾的特點
(1)絕大多數酶促化學修飾的酶都具有無活性(或低活性)與有活性(或高活性)兩種形式。它們之間的互變反應,正逆兩向都有共價變化,由不同的酶進行催化,而催化這互變反應的酶又受機體調節物質(如激素)的控制。
(2)存在瀑布式效應。由於酶促化學修飾是酶所催化的反應,故有瀑布式(逐級放大)效應。少量的調節因素就可通過加速這種酶促反應,使大量的另一種酶發生化學修飾。因此,這類反應的催化效率常較變構調節為高。
(3)磷酸化與脫磷酸是常見的酶促化學修飾反應。一分子亞基發生磷酸化常需消耗一分子ATP,這與合成酶蛋白所消耗的ATP相比,顯然是少得多;同時酶促化學修飾又有放大效應,因此,這種調節方式更為經濟有效。
(4)此種調節同變構調節一樣,可以按著生理的需要來進行。在前述的肌肉糖元磷酸化酶的化學修飾過程中,若細胞要減弱或停止糖元分解,則磷酸化酶a在磷酸化酶a磷酸酶的催化下即水解脫去磷酸基而轉變成無活性的磷酸化酶b,從而減弱或停止了糖元的分解。
此外,酶促化學修飾與變構調節只是兩種主要的調節方式。對某一種酶來說,它可以同時受這兩種方式的調節。如,糖元磷酸化酶受化學修飾的同時也是一種變構酶,其二聚體的每個亞基都有催化部位和調節部位。它可由AMP激活,並受ATP抑制,這屬於變構調節。細胞中同一種酶受雙重調節的意義可能在於,變構調節是細胞的一種基本調節機制,它對於維持代謝物和能量平衡具有重要作用,但當效應劑濃度過低,不足以與全部酶分子的調節部位結合時,就不能動員所有的酶發揮作用,故難以應急。當在應激等情況下,若有少量腎上腺素釋放,即可通過cAMP,啟動一系列的瀑布式的酶促化學修飾反應,快速轉變磷酸化酶b成為有活性的磷酸化酶a,加速糖元的分解,迅速有效地滿足機體的急需。
| 關於「生物化學與分子生物學/酶分子結構的調節」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |