生物化學與分子生物學/膠原蛋白
| 醫學電子書 >> 《生物化學與分子生物學》 >> 結締組織生化 >> 膠原蛋白 |
| 生物化學與分子生物學 |
|
|
膠原蛋白(collagen)存在所有多細胞動物體內,是體內含量最多的一類蛋白質,存在於幾乎所有組織中,是一種細胞外蛋白質,以不溶纖維形式存在,具高度抗張能力,是決定結締組織韌性的主要因素。
目錄 |
一、膠原蛋白的結構
單個的Ⅰ型膠原分子分子量約285kD,寬14A,長約3000A。由三條多肽鏈組成。哺乳動物個體中有30種不同的多肽鏈構成16種不同的膠原,其中最常見的列於表13-3中。
表13-3 膠原的主要類型
| 類型 | 鏈組成 | 分布 |
| Type | Chain Composition | Distribution |
| Ⅰ | [a1(Ⅰ)]2a2(I) | 皮膚、骨、肌腱、血管、角膜 |
| Ⅱ | [a1(Ⅱ)]3 | 軟骨、椎間盤 |
| Ⅲ | [al(Ⅲ)]3 | 血管、新生兒皮膚 |
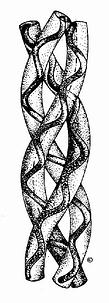
圖13-6 膠原的右手超螺旋結構
膠原蛋白的胺基酸組成有如下特徵:①甘氨酸幾乎佔總胺基酸殘基的三分,即每隔兩個其他胺基酸殘基(X,Y)即有一個甘氨酸,故其肽鏈可用(甘-X-Y)n來表示。②含有較多在其他蛋白質中少見的羧脯氨酸和羧賴氨酸殘基,也有較多脯氨酸(pro)和賴氨酸。如脯氨酸(Pro)和4-羥脯氨酸(4-hydroxyproline,Hyp)含量高達15~30%。同時還含有少量3-羥脯氨酸(3hydroxyproline)和5-羥賴氨酸(5-hydroxylysine,Hyl)。羥脯氨酸殘基可通過形成分子內氫鍵穩定膠原蛋白分子。例如,正常膠原在39℃變性,而在缺乏脯氨酸羥化酶條件下合成的膠原在24℃變性成為白明膠(gelatin)。而羥賴氨酸上可結合半乳糖-葡萄糖苷,與特定組織功能相關。如在基底膜膠原(Ⅳ型)中含hyl較多,含糖也較多,可能與基底膜的濾過功能有關。③膠原中缺乏色氨酸,所以它在營養上為不完全蛋白質。
在膠原纖維中,膠原蛋白分子單位稱為原膠原(tropo collagen)。每個原膠原分子由三條α-肽鏈組成,α-肽鏈自身為α螺旋結構,三條α-肽鏈則以平行、右手螺旋形式纏繞成「草繩狀」三股螺旋結構(圖13-6)。肽鏈中每三個胺基酸殘基中就有一個要經過此三股螺旋中央區,而此處空間十分狹窄,只有甘氨酸適合於此位置,由此可解釋其胺基酸組成中每隔兩個胺基酸殘基出現一個甘氨酸的特點。而且三條α-肽鏈是交錯排列的,因而使三條α-肽鏈中的Gly、X、Y殘基位於同一水平上,借Gly中的N-H基與相鄰鏈X殘基上羥基形成牢固的氫鍵(圖13-7),以穩定其分子結構。
原膠原分子平行排列成束,通過共價交聯,可形成穩定的膠原微纖維(microfibvil),進一步行聚集成束,形成膠原纖維。膠原分子通過分子內或分子間的交聯成為不溶性的纖維。因膠原分子胺基酸組成中缺乏半胱氨酸,不可能象角蛋白那樣以二硫鍵相聯,而是通過組氨酸與賴氨酸間的共價交聯,一般發生在膠原分子的C-或N末端之間。
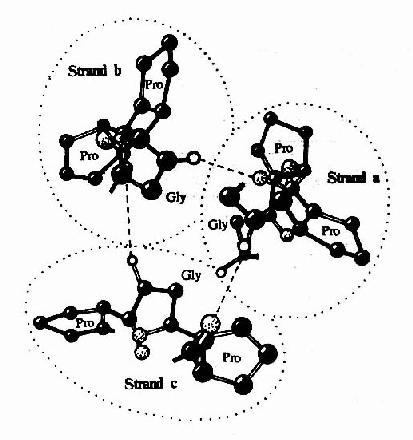
圖13-7 膠原樣多聚體三螺旋軸的C端投影圖
膠原纖維在不同組織中的排列方式與其功能相關。如在肌腱、皮膚及軟骨,要分別在一維、二維和三維方向承受張力,因而其膠原纖維排列分別為平行束狀,多角的纖維片層及不規則排列等方式。(表13-4)
表13-4 膠原纖維在不同組織中的排列
| 組織 | 排列 |
| 肌腱 | 平行束 |
| 皮膚 | 多角的纖維片層 |
| 軟骨 | 無規則排列 |
| 角膜 | 交叉排布的光滑片層使光的散身最小化 |
二、膠原的生物合成
結締組織中的原膠原分子主要由成纖維細胞合成,軟骨中膠原由軟骨細胞合成,骨膠原來自成骨細胞,基底膜中膠原則由上皮或內皮細胞合成。膠原的生物合成可分為細胞內和細胞外兩大階段。

圖13-8 膠原結構示意圖
1.細胞內合成階段
在結締組織細胞中,首先是按蛋白質合成的原則先合成一條很長的,約1400個胺基酸殘基的肽鏈,稱為溶膠原蛋白,而後轉入內質網中進行羥基化和糖基化修飾。
(1)羥基化修飾
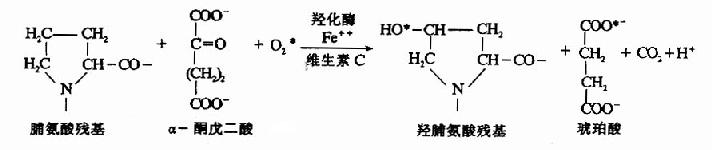
膠原分子組成中含有羥脯氨酸和羥賴氨酸,這兩種胺基酸並無遺傳密碼、反密碼及tRNA引導入肽鏈,而是在內質網中,由脯氨酸、賴氨酸殘基經羥化生成的。由脯氨酸羥化酶(prolylhydroxylase)和賴氨酸羥化酶(lysyl hydroxylase)催化,此酶為加單氧酶,需Fe++和維生素C為輔因子,α-酮戊二酸作輔底物。如脯氨酸的羥化反應:
此羥化反應中需分子氧,缺氧會妨礙膠原的生成,因而缺氧可使傷口癒合延遲。而維生素C是維持羥化酶活性所必需的,缺乏維生素C,膠原合成不能形成正常的纖維,可出現皮膚結節,血管脆弱及傷口癒合緩慢等症状。羥化作用對三股螺旋的堅固性有重要作用,羥化不足的鏈在體溫下不能形成堅固的三股螺旋,因而不能從細胞內排出。
(2)糖基化修飾
膠原分子中含有共價連接的糖基,根據組織不同,糖含量可達0.4-12%。其中糖基主要為葡萄糖、半乳糖及它們的雙糖。在內質網中由半乳糖基轉移酶及葡萄糖基轉移酶催化將糖基聯於5-羥賴氨酸殘基上。
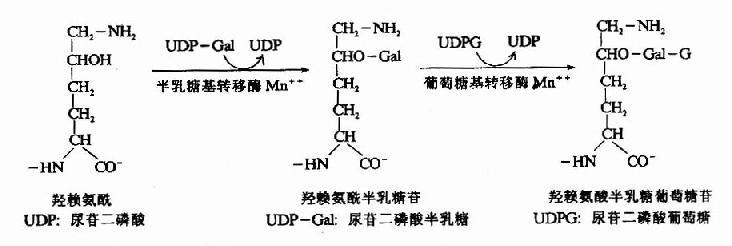
糖基化的作用目前尚未完全闡明,研究發現這些糖基位於膠原纖維中原膠原的接頭處。推測糖基化與纖維的定向排列有關。
經羥基化和糖基化修飾的溶膠原蛋白,形成三股螺旋而排出細胞外。
2.細胞外膠原纖維成熟階段
分泌到細胞外的溶膠原由內切酶作用,水解N-末端和C—末端的附加肽鏈,形成原膠原蛋白,原膠原分子可在中性pH條件下,借分子間各部分不同電荷的相互吸引而自動聚合成膠原纖維,此種聚合不穩定,經共價交聯成網使之進一步固定。
膠原纖維的共價交聯由賴氨酸氧化酶(lysyloxidase)催化,此酶含Cu++,是參與交聯反應過程的唯一酶,能將賴氨酸轉變為醛賴氨酸(allysine)ε-醛賴氨酸與另一α-肽鏈的ε賴氨酸醛醛縮合生成ε-醛賴氨酸醛酸(Allysinealdol),再與組氨酸反應生成醇醛組氨酸(aldol histidine),後者再與5-羥賴氨酸進行醛胺縮合形成希夫鹼結構(圖13-9)可使4條α-肽鏈間共價交聯。
通過共價交聯,膠原微纖維的張力加強,韌性增大,溶解度降低,最終形成不溶性的膠原纖維。
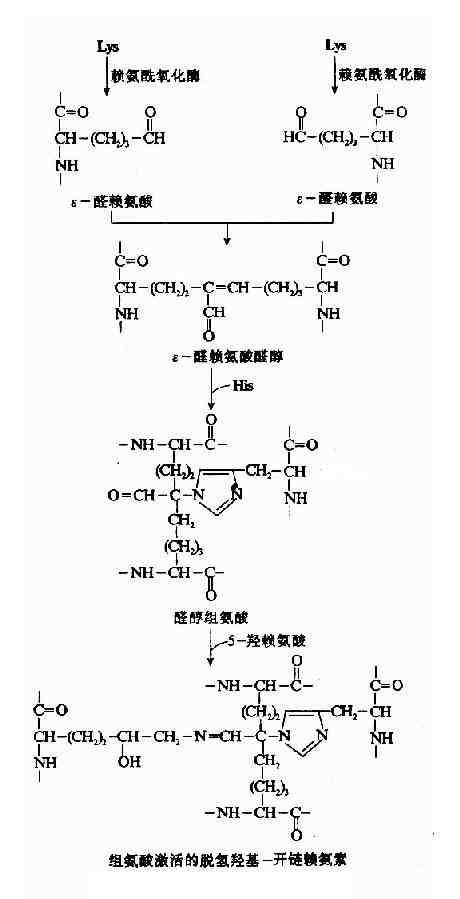
圖13-9 膠原纖維的交聯過程
膠原蛋白分子共價交聯對膠原正常功能有重要意義。例如人或動物進食山藜豆所致的山藜豆中毒(lathyrivsm)表現為嚴重的骨、關節及大血管壁的異常,其發病即因為山藜豆毒素β—氨基丙晴(β—mino propionitrile)
![]()
與賴氨酸氧化酶活性位點共價結合而使之失活,從而導致膠原纖維變脆弱。
膠原蛋白與許多人類疾病相關。如骨形成不全(osteogenesis imperfecta)或稱脆骨病(brittle bonediesease),即是由於膠原蛋白生物合成或轉錄後的修飾作用障礙所致。現已清楚是由於I型膠原突變所致,據突變發生的位置及性質不同,發病的嚴重性亦不同。此外,有些膠原性疾病涉及多種膠原合成紊亂或合成過程中酶(如賴氨酸羥化酶,賴氨酸氧化酶)活性的異常。如EhlersDanlos症候群即有10種以上不同膠原的缺陷,其症状主要為關節過度伸張,皮膚彈性增高、脆弱,血管脆弱及外傷後皮下粘蛋白或皮下脂肪小結形成等,又被稱為「印第安橡皮人」(Indiarubber man)。
三、膠原的分解代謝
膠原纖維由於廣泛的共價交聯,其結構穩定,不易被一般蛋白酶水解。體內有特異作用於膠原的膠原酶(calagenase),對其分解起關鍵作用。此酶在N椂嗽?/4處切斷原膠原,切斷後的碎片可自動變性,經細胞外非特異性蛋白酶及肽酶水解或被細胞吞噬後由溶酶體酶進一步分解,形成小分子寡肽或游離胺基酸。
膠原酶在某些修復或再生組織如分娩後子宮、重建的骨組織以及癒合的傷口等含量較高,Ca++為其激活劑。血清中α2巨球蛋白能與膠原酶結合而抑制其活性。膠原酶對溫度十分敏感,36℃時酶活性比30℃大10倍。炎症局部溫度升高,可能因此加速膠原分解。
膠原分解後產生的寡肽及胺基酸中均含有羥脯氨酸,這在其它蛋白分解產物中少見。因而測定尿中羥脯氨酸或含羥脯氨酸的短肽的含量,可作為判斷體內膠原分解的指標。
參看
| 關於「生物化學與分子生物學/膠原蛋白」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |