生物化學與分子生物學/蛋白多糖
| 醫學電子書 >> 《生物化學與分子生物學》 >> 結締組織生化 >> 蛋白多糖 |
| 生物化學與分子生物學 |
|
|
結締組織基質中蛋白質與多糖以共價和非共價鍵相連構成多種巨大分子稱為蛋白多糖(proteoglycans)或粘蛋白(mucoproteins)。其分子組成以多糖鏈為主,蛋白質部分所佔比例較小。往往一條多糖鏈上聯結多條多肽鏈,分子量可達數百萬以上。
目錄 |
一、化學結構
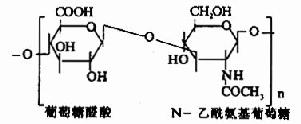
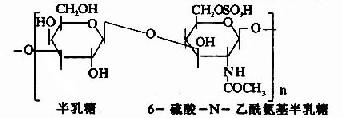
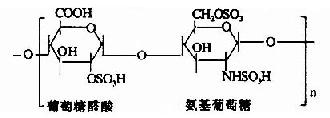
蛋白多糖中的多糖鏈為雜多糖,因其組成成分中均含氨基已糖,所以稱為氨基多糖或糖胺聚糖(glycosaminoglycans)。人體組締組織中常見的氨基多糖包括透明質酸(hyaluronicacid)、硫酸軟骨素(chondroitin sulfate)、硫酸角質素(keratan sulfate)和肝素(heparin)等。
表13-2 人體中常見的糖胺多糖
| 名稱 | 基本結構單位 | 主要存在部位 |
| 透明質酸 |
|
關節液、軟骨、結締組織基質、皮膚、臍帶、玻璃體液 |
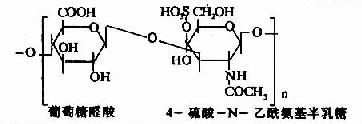
| 4-硫酸軟骨素(硫酸軟骨素A) |
|
骨、軟骨、角膜、皮膚、血管 |
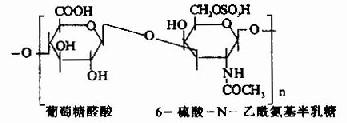
| 6-硫酸軟骨素(硫酸軟骨素C) |
|
軟骨、肌腱、臍帶、椎間盤 |
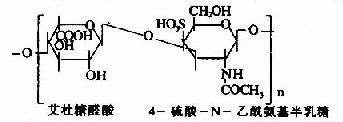
| 硫酸皮膚素(硫酸軟骨素B) |
|
皮膚、韌帶、動脈、心瓣膜 |
| 硫酸角質素 |
|
角膜、軟骨、髓核 |
| 肝素 |
|
肺、皮膚、肝、腸等肥大細胞及嗜鹼性白細胞內 |
其中硫酸軟骨素B又稱為硫酸皮膚素(dermatan sulfate)。各種糖胺多糖的結構單元為二糖單位,均含有乙醯氨基已糖和糖醛酸(硫酸角質素例外,不含糖醛酸而代之以半乳糖)。除透明質酸外都含硫酸。因而糖胺多糖為酸性,加之分子大具有粘性,故又稱為酸性粘多糖(acidmucopolysaccharide,AMPS)。
經電子顯微鏡圖形及實驗推測,蛋白多糖為「瓶刷狀」分子結構(圖13-1),其蛋白多糖亞單位(「刷毛」)非共價附著於透明質酸主鏈上(backbone),其間相隔200-300A。
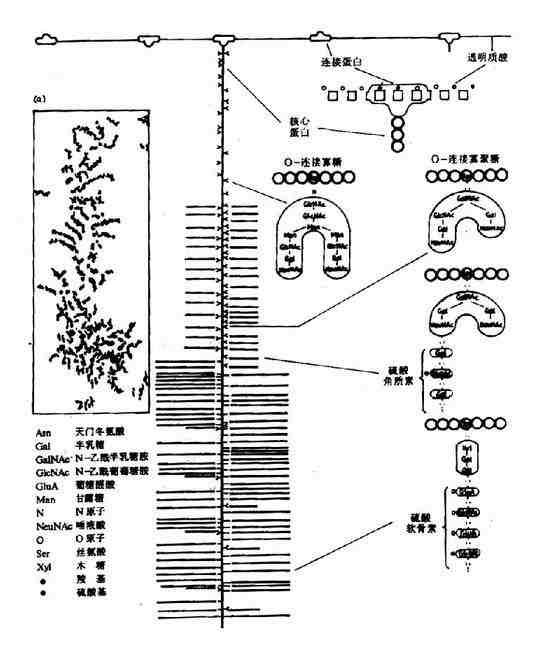
圖13-1 蛋白多糖的分子結構
蛋白多糖亞單位由一個核心蛋白(coreprotein)和共價連接其上的糖胺多糖組成,後者主要為硫酸角質素和硫酸軟骨素。人體中有多種不同的核心蛋白,分子量達200~300kD,是所有組織細胞中分泌的最大的一種多肽。核心蛋白高度伸展N-末端,形成一球狀區,約60-70kD,非共價連接於透明質酸鏈上,另一種約40-60kD的連接蛋白(link protein)參與穩定球狀區與透明質酸鏈的非共價連接。核心蛋白及多糖組成的亞單位可分為三區:
(1)N-端區:包括球狀連接區,含有較少的寡糖鏈。
(2)富含寡糖區:為硫酸角質素寡糖鏈的主要附著區。寡糖鏈共價連接於核心蛋白分子中絲氨酸和蘇氨酸殘基側鏈氧原子上。
(3)C-末端區:富含硫酸軟骨素。通過半乳糖半乳糖木糖三糖連接於核心蛋白的絲氨酸殘基。
蛋白多糖的透明質酸主鏈長度為4000~40,000,可附著上百個核心蛋白,每條核心蛋白可結合50條硫酸角質素鏈和100條硫酸軟骨素鏈,由此可見蛋白多糖分子巨大,分子量可高達數千萬。
二、蛋白多糖的生理功能
蛋白多糖分子大,具高度親水性,對保持結締組織水分及與組織間物質交換均有重要作用。例如軟骨組織中膠原纖維排列成網格狀,網格間隙中填充蛋白多糖,因其有高度親水性,吸附大量水份在其中,當軟骨受壓時,水分可被擠壓出去,而減壓後又可重吸進來。關節軟骨無血管供應,其營養物質的交換主要靠運動產生壓力變化使液體流動。由此可以解釋長期不運動導致關節軟骨的萎縮。
蛋白多糖的糖鏈上含有較多的酸性基團,對於細胞外液中Ca++、Mg++、K+、Na+等陽離子有較大的親和力,因此能調節這些陽離子在組織中的分布。
蛋白多糖分子巨大,有較大的粘滯性,附著於組織表面,能緩衝組織之間的機械磨擦,因而具有潤滑、保護作用。例如關節液中的蛋白多糖有潤滑關節面的作用。類風濕關節炎患者,關節液中蛋白多糖減少,失去原有潤滑作用,因而關節面易被破壞。
蛋白多糖與創傷的癒合亦有密切關係。皮膚創傷後的肉芽形成過程中,通常先有糖胺多糖的增生,進而促進膠原纖維的合成,其機理尚不清楚。近年來發現蛋白多糖可調節某些蛋白生長因子的作用。例如鹼性成纖維細胞生長因子(basic fibrotlast growth factor,bFGF)結合於蛋白多糖的肝素或硫酸角質素鏈上,而且要以bFGF糖胺多糖複合物形式與細胞表面受體結合。bFGF與肝素或硫酸角質素結合能保護bFGF免被降解。當核蛋白水解或肝素或硫酸角質素鏈部分降解時可釋放出活性bFGF糖胺多糖複合物,刺激細胞增殖及分化。其它一些生長因子也有類似作用機制,很明顯,廣泛和大量存在的蛋白多糖可局限這些生長因子在其分泌細胞短距離內作用。這對於組織的特有結構具有重要意義。
三、蛋白多糖的生物合成
蛋白多糖的合成首先按蛋白質生物合成的原理,在核糖體上合成多肽,並分泌入內質網中,在內質網中修飾過程中,由相應的轉移酶催化活性單糖轉移到胺基酸的側鏈上,合成胺基多糖。但糖鏈的延伸和加工修飾在高爾基體進行。所以說多肽的合成受專一基因控制,而氨基多糖的合成主要由酶的分隔定位和對酶特異性所決定。
參與胺基多糖合成的各種單糖及其衍生物需先活化成活性單糖,即與二磷酸尿苷(UDP)結合,而各種單糖及其衍生物均可由葡萄糖轉變而來,如下圖13-2所示:
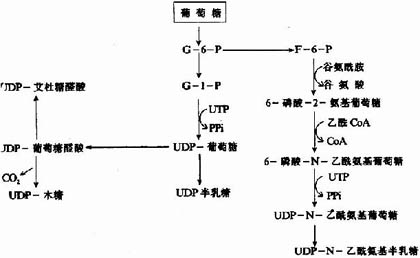
圖13-2 各種單糖及其衍生物的來源
糖胺多糖合成的起始步驟是在木糖轉移酶(Xylose transfevase)的催化下,將一分子木糖基連接到核心蛋白多肽鏈的絲氨酸殘基上,形成O-糖苷鍵(O-glycosidicbond)。再由半乳糖轉移酶(galactose transforase)催化依次轉移兩分子半乳糖,構成「木棸霔半」三糖連接區。然後再由高度特異的糖基轉移酶作用逐漸按順序延長,糖鏈合成後再進一步修飾。由差向異構酶催化將葡萄糖醛酸轉變為艾杜糖醛酸,而硫酸基則是由活性硫酸根(PAPS)提供,由硫酸轉移酶
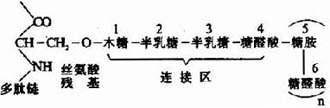
圖13-3 糖胺多糖鏈與多肽鏈的連接
催化加到新合成的多糖鏈的氨基或羥基上。(圖13-4為硫酸軟骨素A合成過程示意圖),當Vit A缺乏時硫酸轉移酶活性下降,糖胺多糖合成受限,可引起組織生長、發育的障礙。
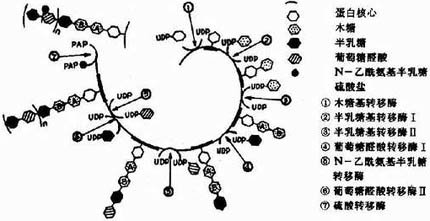
圖13-4 硫酸軟骨素A的合成示意
四、蛋白多糖的分解代謝
結締組織基質中的蛋白多糖主要受組織蛋白酶D等的作用,部分肽鏈水解產生的帶多糖鏈的小片段可被細胞吞噬,進而在溶酶體中逐步水解成各種單糖及其衍生物。因此,溶酶體是糖胺多糖分解的主要場所。
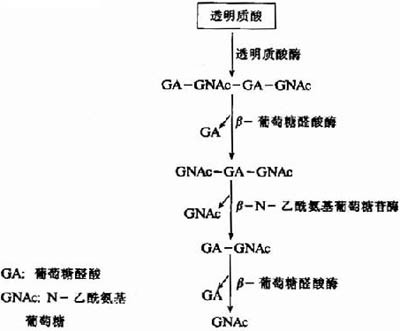
圖13-5 透明質酸的水解
溶酶體中分解糖胺多糖的酶包括內切糖苷酶、外切糖苷酶及硫酸酯酶等。如圖13-5所示透明質酸的水解過程:首先透明質酸酶(hyaluronidase)為一種內切酶,能水解透明質酸、硫酸軟骨素A和C中的β-N-乙醯氨基已糖糖苷鍵,產生主要為四糖或六糖的寡糖。隨後再由β-葡萄糖醛酸酶及β-N-乙醯氨基葡萄糖苷酶等外切酶進一步水解,成為單糖及其衍生物。
大多數糖胺多糖都含有硫酸基團。溶酶體中也存在多種硫酸酯酶,能水解各種硫酸酯鍵。有些糖苷酶有很強的底物特異性、不能水解帶硫酸基的寡糖鏈,因此,硫酸酯酶的先天性缺乏會引起糖胺多糖分解障礙,導致粘多糖症(mucoplysaccharidoses)。
參看
| 關於「生物化學與分子生物學/蛋白多糖」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |