微管
| A+醫學百科 >> 微管 |
目錄 |
分子結構
微管(microtubule)
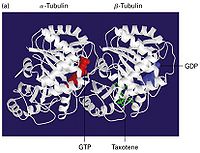
微管是一種具有極性的細胞骨架。微管是由α,β兩種類型的微管蛋白亞基形成的微管蛋白二聚體,由微管蛋白二聚體組成的長管狀細胞器結構。微管由微管蛋白異源二聚體為基本構件, 螺旋盤繞形成微管的壁。在每根微管中微管蛋白二聚體頭尾相接, 形成細長的原纖維(protofilament), 13條這樣的原纖維縱向排列組成微管的壁。微管是直徑為24-26nm的中空圓柱體。外徑平均為24nm, 內徑為15nm。微管壁大約厚5nm,微管通常是直的, 但有時也呈弧形。細胞內微管呈網狀和束狀分布, 並能與其他蛋白共同組裝,可裝配成單管,二聯管(纖毛和鞭毛中),三聯管(中心粒和基體中),紡錘體、基粒、軸突、神經管等結構。它是由13 條原纖維(protofilament)構成的中空管狀結構,直徑22—25奈米。微管蛋白二聚體由結構相似的α和β-微管蛋白構成,兩種亞基均可結合GTP,α-微管蛋白結合的GTP從不發生水解或交換,是α-微管蛋白的固有組成部分;而作為GTP酶,β-微管蛋白可水解結合的GTP,結合的GDP可交換為GTP。微管和微絲一樣,具有生長速度較快解離速度較慢的(+)端和生長速度較慢解離速度較快的(-)端。微管在細胞內起支撐作用。另外它還是兩種運載分子,驅動蛋白(Kinesin)和運動蛋白(Dynein)的行走軌道。微管可能連帶附在其上的運動蛋白會發放信號促進粘著斑的解聚,後者是粘著斑的周轉和尾部與底質分離過程中重要的一步。
微管的功能:維持細胞形態,輔助細胞內運輸,與其他蛋白共同裝配成紡錘體,基粒,中心粒,鞭毛,纖毛神經管等結構。
微管可在所有哺乳類動物細胞中存在,除了紅細胞外,所有微管均由約55ku的α及β微管蛋白(tubulin)組成。它們正常時以αβ二聚體形式存在(110ku)並以頭尾相連的方式聚合,形成微管蛋白原纖維(protofilament),由13根這樣的原纖維構成一個中空的微管。
微管結合蛋白
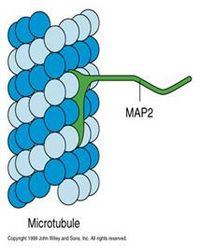
微管結合蛋白(microtubule associated proteins MAPs)分子至少包含一個結合微管的結構域和一個向外突出的結構域。突出部位伸到微管外與其它細胞組分(如微管束、中間纖維、質膜)結合(圖9-17)。
MAP的主要功能是:①促進微管聚集成束;②增加微管穩定性或強度;③促進微管組裝。包括I 型和II型兩大類, I 型對熱敏感,如MAP1a、 MAP1b,主要存在於神經細胞 。II型熱穩定性高,包括 MAP2a、b、c,MAP4和tau蛋白。其中 MAP2隻存在於神經細胞,,MAP2a的含量減少影響樹突的生長。
微管組織
微管組織中心(microtubule organizing center MTOCs)是微管進行組裝的區域,著絲粒、成膜體、中心體、基體均具有微管組織中心的功能。所有微管組織中心都具有γ微管球蛋白,這種球蛋白的含量很低,可聚合成環
狀複合體,像模板一樣參與微管蛋白的核化,幫助α和β球蛋白聚合為微管纖維。
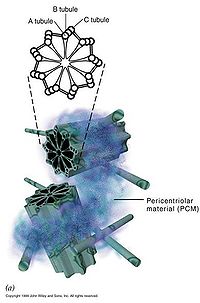
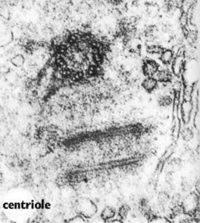
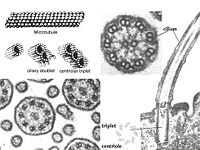
中心體(centrosome)位於細胞的中心部位(圖9-18)。由兩個相互垂直的中心粒(centriole)構成(圖9-19),周圍是一些無定形或纖維形、高電子密度的物質,叫做外中心粒物質(PCM,pericentriolar material)。中心粒直徑0.2mm,長0.4mm,由9組3聯微管構成,不直接參与微管蛋白的核化,具有召集PCM的作用。
微管蛋白以環狀的γ球蛋白複合體為模板核化、先組裝出(-)極,然後開始生長,因此中心體周圍的微管(-)極指向中心體,(+)級遠離中心體。
1972年R. Weisenberg證明提純的微管,在微酸性環境(PH=6.9),適宜的溫度下,存在GTP
、Mg和去除Ca的條件下能自發的組裝成微管。但這種微管只有11條原纖維,可能是因為沒有γ微管球蛋白構成的模板。
微管β球蛋白結合的GTP水解並不是微管組裝所必需的步驟,但是結合GTP的微管蛋白二聚體能加合到微管纖維上,在快速生長的纖維兩端微管球蛋白結合的GTP來不及水解,形成的「帽子」,使微管纖維較為穩定。一旦暴露出結合GDP的亞單位微管,則開始去組裝。
微管的功能
1、支架作用
細胞中的微管就像混凝土中的鋼筋一樣,起支撐作用,在培養的細胞中,微管呈放射狀排列在核外,(+)端指向質膜(圖9-20),形成平貼在培養皿上的形狀。在神經細胞的軸突和樹突中,微管束沿長軸排列,起支撐作用,在胚胎髮育階段為管幫助軸突生長,突入
周圍組織,在成熟的軸突中,微管是物質運輸的路軌。
2、細胞內運輸
微管起細胞內物質運輸的路軌作用,破壞微管會抑制細胞內的物質運輸。
與微管結合而起運輸作用的馬達蛋白有兩大類:驅動蛋白kinesin,動力蛋白dynein,兩者均需ATP提供能量。
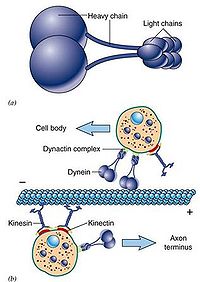
Kinesin發現於1985年,是由兩條輕鏈和兩條重鏈構成的四聚體(圖9-21),外觀具有兩個球形的頭(具有ATP酶活性)、一個螺旋狀的桿和兩個扇子狀的尾。通過結合和水解ATP,導致頸部發生構象改變,使兩個頭部交替與微管結合,從而沿微管「行走」,將「尾部」結合的「貨物」(運輸泡或細胞器)轉運到其它地方。據估計哺乳動物中類似於kinesin的蛋白(KLP, kinesin-like protein or KRB, kinesin-related protein)超過50餘種,大多數KLP能向著微管(+)極運輸小泡,也有些如Ncd蛋白(一種著絲點相關的蛋白)趨向微管的(-)極。
Dynein發現於1963年,因與鞭毛和纖毛的運動有關而得名。dynein分子量巨大(接近1.5Md),由兩條相同的重鏈和一些種類繁多的輕鏈以及結合蛋白構成(鞭毛二聯微管外臂的動力蛋白具有三個重鏈)。其作用主要有以下幾個方面:在細胞分裂中推動染色體的分離、驅動鞭毛的運動、向著微管(-)極運輸小泡(圖9-22)。
3、形成紡錘體
紡錘體是一種微管構成的動態結構,其作用是在分裂細胞中牽引染色體到達分裂極。
4、纖毛與鞭毛的運動
纖毛與鞭毛是相似的兩種細胞外長物,前者較短,約5~10um;後者較長,約150um,兩者直徑相似,均為0.15~0.3um。
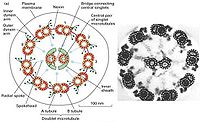
鞭毛和纖毛均由基體和鞭桿兩部分構成(圖9-23),鞭毛中的微管為9+2結構,即由9個聯微管和一對中央微管構成,其中二聯微管由AB兩個管組成,A管由13條原纖維組成,B管由10條原
纖維組成,兩者共用3條。A管對著相鄰的B管伸出兩條動力蛋白臂(圖9-24),並向鞭毛中央發出一條輻。基體的微管組成為9+0,並且二聯微管為三聯微管所取代,結構類似於中心粒。
纖毛和鞭毛的運動是依靠動力蛋白(dynein)水解ATP,使相鄰的二聯
活力造成的。這種病人同時還患有慢性支氣管炎,主要是因為是鞭毛和纖毛沒有動力蛋白臂,不能排出侵入肺部的粒子。
|
|||||||||||||||||||||||||||||||||||||||||||||||
| 關於「微管」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |