臨床生物化學/血清酶變化的病理生理機制
| 醫學電子書 >> 《臨床生物化學》 >> 診斷酶學 >> 診斷酶學概述 >> 血清酶變化的病理生理機制 |
| 臨床生物化學 |
|
|
|
前面已提到不同類型的酶,其變化機制會有所不同,如把所有可能影響因素都考慮進去,可以得到一個總的酶由細胞內進入血液以及在血中變化的總的模式圖(圖7-1):
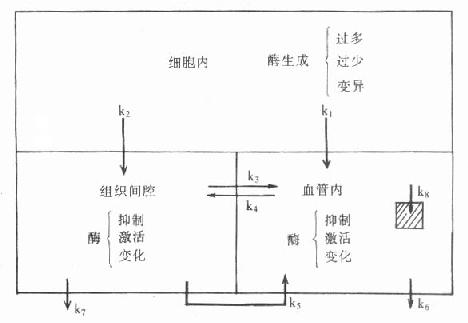
圖7-1 血清酶變化機制
式中k1,k2分別代表細胞內酶進入細胞間隙或(和)直接進入血液的速率,如某些種類細胞直接與血液接觸,不需經過組織間隙就直接進入血液,則血中酶變化不僅出現早而且明顯。K3和k4分別代表酶從兩個不同方向通過毛細血管壁的速率,某些組織或器官中毛細血管壁很緻密,這些值較低,則可能有相當一部分酶經由淋巴管才進入血液,此速率常數為k5。而k6、k7則代表了酶在細胞間隙和血液的清除速率。K8代表酶被血中細胞或網狀內皮系統細胞攝入的速率常數。少數酶屬於血漿特異酶和分泌酶,如細胞出現增生性病變,則酶可以產生增多,並進入血液,反之也可能產生減少,從而引起血中酶濃度下降。
不同組織或器管中酶進入血中途徑不一,清除方法也有差異,這就構成不同疾病酶變化的多樣性,也只有在總的規律基礎上,掌握各種器官疾病的特殊性,才能解釋和掌握酶變化規律,正確用於臨床。從臨床角度,可以將上述各種因素歸納為以下四個面加以敘述。
(一)細胞酶的釋放
細胞靠細胞膜來維持其完整性,細胞膜代謝十分活躍,依靠膜上一系列ATP依賴的離子泵來維持細胞內外Na+、K+和Ca2+濃度的差異,這過程需要耗費大量能源,當缺氧或能量代謝障礙、ATP供應減少、離子泵功能障礙時,無法維持正常離子的梯度差,改變了細胞的內滲透壓,從而引起細胞腫脹,特別是Ca2+進入細胞內,引起細胞膜的泡狀突出,膜孔隙增大,酶開始從細胞內向外溢出,其速度和數量受多種因素影響。主要的有:
⒈細胞內外酶濃度的差異 對於非血漿特異酶,細胞內外濃度差可在千倍以上,因此只要有少量細胞壞死或者細胞有輕度病變,血中酶濃度就可能明顯升高。有人計算過只要有1/1000肝細胞壞死,所釋放的酶可使血中酶增加一倍。鳥氨酸氨甲醯基轉移酶(OCT)在細胞內外濃度差異可達到105:1,此酶在肝臟病變時變化極為明顯,可惜的是,由於測定方法不方便,臨床應用不多。但對於血漿特異酶而言,由於細胞內外濃度差異小,細胞病變很少引起血中酶濃度明顯升高。
⒉酶在細胞內定位與存在形式 從上述酶釋放的機制不難理解最容易釋放入血的是胞質中游離的酶,如ALT,LD等。而在細胞亞顯微結構中的酶則較難溢出,除非細胞病變進一步加重,不局限於細胞膜。特別是粒線體酶,由於有兩層緻密的粒線體膜,往往當細胞出現壞死病變時,才開始釋放入血。在一個典型的AMI病程中,粒線體AST是最後一個出現升高的酶,而且到達峰值時間也最遲。臨床通過線體酶的測定,有助於判斷疾病的不良預後。又如肝細胞中AST大部分存在於粒線體,雖然其絕對量超過ALT,但在急性肝炎時,由於細胞病變較輕,胞質中含有大量ALT,故血中ALT往往超過AST。而在肝硬化時,主要病變為肝細胞壞死,粒線體中AST大量溢出,血中往往AST大於ALT。
細胞膜上也含有多種酶,如γ-谷氨醯基轉移酶(GGT)大量存在於肝中毛細膽管上皮膜上,當膽道梗阻、膽汁瀦留在肝中時,膽汁酸鹽有表面活性劑作用,可將GGT從細胞膜上洗脫下來,而此時不一定伴有細胞膜病變。正因為血中不同酶變化機制有差異,這樣GGT和ALT在各種肝膽疾病時的變化常不一致。
⒊酶蛋白分子量的大小 不少實驗都證實酶的釋放速度大致與酶的分子量成反比。由於臨床上測定的十餘種酶之間分子量差異不太大,此因素對血中酶濃度高低影響恐不如上述因素,但對酶在血中出現升高時間先後有相當大影響。例如在AMI時,血中最先升高的CK分子量為85000,而分子量為125000的LD出現升高明顯推遲。
(二)酶在細胞外間隙的分布和運送
細胞中的酶經過三種途徑進入血液:一種如血細胞和血管內皮細胞中的酶,不經過稀釋就直接進入血液。第二種途徑,細胞酶既和組織間隙也和血液直接相接觸。如肝脾,它們釋放的酶很快直接入血,另有小部分進入組織間隙。第三種途徑,大多數組織或器官中,由於存在著結構緻密的毛細血管,所釋放的酶大部分進入組織液。除一小部分通過毛細血管壁進入血液外,主要經由淋巴系統進入血液。由於血液只佔細胞外液的20%,淋巴液和血液一天交換量可達50%-100%,其結果通過此途徑進入血液的酶量不僅增高程度較低,在血中出現增高時間也較遲。臨床醫師不能忽視淋巴系統對血清酶濃度的影響。在一組動物實驗中,單純肌肉損傷加以固定,血中酶濃度變化不大;如加上被動運動,則AST明顯升高;如移去實驗動物胸導管,即使有被動運動,AST也不升高。
有作者認為在壞死病變時血中粒線體酶很少達到像胞質酶這樣高的程度,也是因為壞死病灶無淋巴液或很少淋巴液流動,這樣大量粒線體酶堆積在壞死區,只有少部分壞死邊緣區酶通過淋巴進入血液。劇烈運動後血中酶升高與其說是由於細胞損傷引起,還不如說與酶在不同體液中重新分布有關。首先運動引起血壓升高,血漿容量減少,血液濃縮;更重要的是運動加速了淋巴液迴流入血,大量組織液中酶進入血液。因此即使細胞中酶無明顯釋放入血,血液酶濃度也可增高。
不同入血途徑還可引起別一種差異,通過第三途徑入血的往往是一些分子量小的單純酶蛋白,通過前兩種途徑入血的不僅有單純酶蛋白、大分子量的酶多聚體和抗體的複合物,乃至一些和細胞碎片結合的酶都易進入血液,臨床上所觀察的巨酶血症常與肝病有關,可能原因在此。
(三)血中酶的清除
為了很好解釋臨床上複雜情況,還必須了解不同酶從血中清除率的差異以及清除機制。弄清酶的清除率有助於理解,為什麼同一疾病不同酶升高持續時間有差異。一般以血中酶的半壽期來代表酶從血中清除快慢,表7-2是一些常用酶的半壽期數據。
表7-2 血漿中酶的半壽期
| 酶 | 半壽期 |
| AST | 17±5h |
| ALT | 47±10h |
| GLD | 18±1h |
| LD1 | 113±60h |
| LD5 | 10±2h |
| CK | 約15h |
| CK-MM | 17±4h |
| Ck-MB | 12±4h |
| CK-BB | 約5h |
| ALP | 3-7天 |
| GGT | 3-4天 |
| CHE | 約10天 |
| AMY | 3-6h |
| LPS | 3-6h |
從表7-2中不難理解為什麼在急性肝炎恢復期時AST先於ALT恢復正常,也很好解釋在AMI時CK-MB持續時間最短,因其半壽期只有6小時,而LD1因其半壽期長達100餘小時,持續時間最長。
有關酶從血中清除的機制,可說是目前最不清楚的問題,酶雖然也是蛋白質,但它們的半壽期明顯比一般血清蛋白質為短,說明酶蛋白除遵守一般蛋白質代謝規律外,還有其特殊的清除機制。目前發現對於一小部分分子量小於60000的酶,如AMY可以從腎小球濾過一部分,從尿中排出,腎臟嚴重疾病時AMY升高也證實此一推論。但對於大多數酶而言,這種清除機制顯然是不存在的。
過去曾強調,通過膽汁可能排泄一部分酶,並認為這是梗阻性黃疸時,血中ALP、亮氨酸氨基肽酶(LAP)的升高機制。而目前更多傾向認為此時升高機制是肝細胞受刺激合成更多的酶,因為如給以抑制蛋白合成的藥物,雖有黃疸,這些酶也不升高。
目前有人強調單核吞噬細胞系統在清除酶中的作用,它們可將酶迅速吞噬入細胞中,並進一步分解破壞。有學者用Riley病毒選擇性地感染小鼠單核吞噬細胞系統,引起血中LD、AST、AMY和CK等酶升高,用其它化合物封閉單核吞噬細胞系統也得類似結果。使用乙芪酚刺激單核吞噬細胞系統可加速這些酶的清除,但是也不能過高評價這種結果,就在同一試驗中,一些酶如LD1和ALT就不受影響。此外,從臨床角度來看,目前,尚無任何證據顯示任何人的病毒感染疾病引起酶清除機制的障礙。
(四)酶合成異常
對於血漿特異酶,細胞內酶合成下降是引起血中酶變化的重要因素,這些酶大多在肝臟合成,因此當肝功能障礙時,膽鹼酯酶常與白蛋白同時下降。酶合成減少和變異還見於不少遺傳疾病,由於酶基因變異,可引起特定的酶合成減少乃至消失,如肝-豆狀核症候群患者,血中銅氧化酶活性可明顯下降乃至於零。在增生性疾病如骨骼疾病時,可因為骨細胞增生,合成分泌更多的ALP,引起血中此酶升高。惡性腫瘤患者血中酶升高有一部分可能與腫瘤細胞中酶合成增加有關,如前列腺癌細胞可產生大量酸性磷酸酶。
酶的誘導作用也可引起血中一些酶濃度增高,最明顯例子是服用苯巴比妥後常可引起肝中GGT合成增加,血中濃度升高並不意味著肝細胞有什麼病理變化,停藥後GGT就會下降至正常。乙醇、巴比妥類、杜冷丁類以及雙苯內醯脲類藥物都有此種誘導作用,誘導的酶除GGT外還可以是ALP。
(五)其它
實驗室所測到的酶活性濃度值主要和酶量多少相關,但還受到其它物質特別是抑制劑和活化劑的影響。在病理情況下,應考慮有無抑制作用,因為某些藥物和毒物有抑制酶的作用。當使用某些藥物治療肝炎後,還應考慮此藥物有無可能抑制ALT活性,此時血中ALT量不一定下降,只是活性受到抑制,使所測活性下降而已。有機磷中毒時所測的血清膽鹼脂酶和紅細胞中真性膽鹼酯酶活性濃度可以很低,此時並不是酶含量降低,只是和有機磷結合,而有機磷是這些酶的不可逆抑制劑,使酶活性無法發揮。
| 關於「臨床生物化學/血清酶變化的病理生理機制」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |