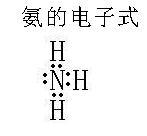氨
| A+醫學百科 >> 氨 |
氨(Ammonia,即阿摩尼亞),或稱「氨氣」,分子式為NH3,是一種無色氣體,有強烈的刺激氣味。極易溶於水,常溫常壓下1體積水可溶解700倍體積氨。氨對地球上的生物相當重要,它是所有食物和肥料的重要成分。氨也是所有藥物直接或間接的組成。氨有很廣泛的用途,同時它還具有腐蝕性等危險性質。由於氨有廣泛的用途,氨是世界上產量最多的無機化合物之一,多於八成的氨被用於製作化肥。由於氨可以提供孤對電子,所以它也是一種路易斯鹼。
目錄 |
簡介
化學式:NH3
電子式:如右圖
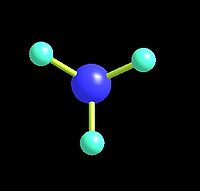
一、結構:氨分子為三角錐形分子,是極性分子。N原子以sp3雜化軌道成鍵。
二、物理性質:氨氣通常情況下是有刺激性氣味的無色氣體,密度比空氣小,極易溶於水,易液化,液氨可作製冷劑。以700:1的溶解度溶於水。
摩爾質量:17.0306 CAS: 7664-41-7 密度:0.6942
熔點:-77.73 °C 沸點:-33.34 °C
在水中溶解度:89.9 g/100 mL, 0 °C
偶極距:1.42 D
主要化學性質
1、NH3遇HCl氣體有白煙產生,可與氯氣反應。
2、氨水(混稱氫氧化銨,NH4OH)可腐蝕許多金屬,一般若用鐵桶裝氨水,鐵桶應內塗瀝青。
3、氨的催化氧化是放熱反應,產物是NO,是工業制硝酸的重要反應,NH3也可以被氧化成N2。
在水中產生少量氫氧根離子,是弱鹼.
主要用途
NH3用於制氨水、液氨、氮肥(尿素、碳銨等)、HNO3、銨鹽、純鹼,廣泛應用於化工、輕工、化肥、製藥、合成纖維、塑料、染料等。
製法
1.合成氨的工藝流程
(1)原料氣製備 將煤和天然氣等原料製成含氫和氮的粗原料氣。對於固體原料煤和焦炭,通常採用氣化的方法製取合成氣;渣油可採用非催化部分氧化的方法獲得合成氣;對氣態烴類和石腦油,工業中利用二段蒸汽轉化法製取合成氣。
(2)淨化 對粗原料氣進行淨化處理,除去氫氣和氮氣以外的雜質,主要包括變換過程、脫硫脫碳過程以及氣體精製過程。
① 一氧化碳變換過程
在合成氨生產中,各種方法製取的原料氣都含有CO,其體積分數一般為12%~40%。合成氨需要的兩種組分是H2和N2,因此需要除去合成氣中的CO。變換反應如下:
CO+H2O→H2+CO2 ΔH =-41.2kJ/mol
由於CO變換過程是強放熱過程,必須分段進行以利於回收反應熱,並控制變換段出口殘餘CO含量。第一步是高溫變換,使大部分CO轉變為CO2和H2;第二步是低溫變換,將CO含量降至0.3%左右。因此,CO變換反應既是原料氣製造的繼續,又是淨化的過程,為後續脫碳過程創造條件。
② 脫硫脫碳過程
各種原料製取的粗原料氣,都含有一些硫和碳的氧化物,為了防止合成氨生產過程催化劑的中毒,必須在氨合成工序前加以脫除,以天然氣為原料的蒸汽轉化法,第一道工序是脫硫,用以保護轉化催化劑,以重油和煤為原料的部分氧化法,根據一氧化碳變換是否採用耐硫的催化劑而確定脫硫的位置。工業脫硫方法種類很多,通常是採用物理或化學吸收的方法,常用的有低溫甲醇洗法(Rectisol)、聚乙二醇二甲醚法(Selexol)等。
粗原料氣經CO變換以後,變換氣中除H2外,還有CO2、CO和CH4等組分,其中以CO2含量最多。CO2既是氨合成催化劑的毒物,又是製造尿素、碳酸氫銨等氮肥的重要原料。因此變換氣中CO2的脫除必須兼顧這兩方面的要求。
一般採用溶液吸收法脫除CO2。根據吸收劑性能的不同,可分為兩大類。一類是物理吸收法,如低溫甲醇洗法(Rectisol),聚乙二醇二甲醚法(Selexol),碳酸丙烯酯法。一類是化學吸收法,如熱鉀鹼法,低熱耗本菲爾法,活化MDEA法,MEA法等。 4
③ 氣體精製過程
經CO變換和CO2脫除後的原料氣中尚含有少量殘餘的CO和CO2。為了防止對氨合成催化劑的毒害,規定CO和CO2總含量不得大於10cm3/m3(體積分數)。因此,原料氣在進入合成工序前,必須進行原料氣的最終淨化,即精製過程。
目前在工業生產中,最終淨化方法分為深冷分離法和甲烷化法。深冷分離法主要是液氮洗法,是在深度冷凍(<-100℃)條件下用液氮吸收分離少量CO,而且也能脫除甲烷和大部分氬,這樣可以獲得只含有惰性氣體100cm3/m3以下的氫氮混合氣,深冷淨化法通常與空分以及低溫甲醇洗結合。甲烷化法是在催化劑存在下使少量CO、CO2與H2反應生成CH4和H2O的一種淨化工藝,要求入口原料氣中碳的氧化物含量(體積分數)一般應小於0.7%。甲烷化法可以將氣體中碳的氧化物(CO+CO2)含量脫除到10cm3/m3以下,但是需要消耗有效成分H2,並且增加了惰性氣體CH4的含量。甲烷化反應如下:
CO+3H2→CH4+H2O ΔH=-206.2kJ/mol
CO2+4H2→CH4+2H2O ΔH=-165.1kJ/mol
(3)氨合成 將純淨的氫、氮混合氣壓縮到高壓,在催化劑的作用下合成氨。氨的合成是提供液氨產品的工序,是整個合成氨生產過程的核心部分。氨合成反應在較高壓力和催化劑存在的條件下進行,由於反應後氣體中氨含量不高,一般只有10%~20%,故採用未反應氫氮氣循環的流程。氨合成反應式如下:
N2+3H2→2NH3(g) ΔH=-92.4kJ/mol
2.合成氨的催化機理
熱力學計算表明,低溫、高壓對合成氨反應是有利的,但無催化劑時,反應的活化能很高,反應幾乎不發生。當採用鐵催化劑時,由於改變了反應歷程,降低了反應的活化能,使反應以顯著的速率進行。目前認為,合成氨反應的一種可能機理,首先是氮分子在鐵催化劑表面上進行化學吸附,使氮原子間的化學鍵減弱。接著是化學吸附的氫原子不斷地跟表面上的氮分子作用,在催化劑表面上逐步生成—NH、—NH2和NH3,最後氨分子在表面上脫吸而生成氣態的氨。上述反應途徑可簡單地表示為:
xFe + N2→FexN
FexN +〔H〕吸→FexNH
FexNH +〔H〕吸→FexNH2
FexNH2 +〔H〕吸FexNH3→xFe+NH3
在無催化劑時,氨的合成反應的活化能很高,大約335 kJ/mol。加入鐵催化劑後,反應以生成氮化物和氮氫化物兩個階段進行。第一階段的反應活化能為126 kJ/mol~167 kJ/mol,第二階段的反應活化能為13 kJ/mol。由於反應途徑的改變(生成不穩定的中間化合物),降低了反應的活化能,因而反應速率加快了。
3.催化劑的中毒
催化劑的催化能力一般稱為催化活性。有人認為:由於催化劑在反應前後的化學性質和質量不變,一旦製成一批催化劑之後,便可以永遠使用下去。實際上許多催化劑在使用過程中,其活性從小到大,逐漸達到正常水平,這就是催化劑的成熟期。接著,催化劑活性在一段時間裡保持穩定,然後再下降,一直到衰老而不能再使用。活性保持穩定的時間即為催化劑的壽命,其長短因催化劑的製備方法和使用條件而異。
催化劑在穩定活性期間,往往因接觸少量的雜質而使活性明顯下降甚至被破壞,這種現象稱為催化劑的中毒。一般認為是由於催化劑表面的活性中心被雜質佔據而引起中毒。中毒分為暫時性中毒和永久性中毒兩種。例如,對於合成氨反應中的鐵催化劑,O2、CO、CO2和水蒸氣等都能使催化劑中毒。但利用純淨的氫、氮混合氣體通過中毒的催化劑時,催化劑的活性又能恢復,因此這種中毒是暫時性中毒。相反,含P、S、As的化合物則可使鐵催化劑永久性中毒。催化劑中毒後,往往完全失去活性,這時即使再用純淨的氫、氮混合氣體處理,活性也很難恢復。催化劑中毒會嚴重影響生產的正常進行。工業上為了防止催化劑中毒,要把反應物原料加以淨化,以除去毒物,這樣就要增加設備,提高成本。因此,研製具有較強抗毒能力的新型催化劑,是一個重要的課題。
4.我國合成氨工業的發展情況
解放前我國只有兩家規模不大的合成氨廠,解放後合成氨工業有了迅速發展。1949年全國氮肥產量僅0.6萬噸,而1982年達到1021.9萬噸,成為世界上產量最高的國家之一。
近幾年來,我國引進了一批年產30萬噸氮肥的大型化肥廠設備。我國自行設計和建造的上海吳涇化工廠也是年產30萬噸氮肥的大型化肥廠。這些化肥廠以天然氣、石油、煉油氣等為原料,生產中能量損耗低、產量高,技術和設備都很先進。
5.化學模擬生物固氮的研究
目前,化學模擬生物固氮的重要研究課題之一,是固氮酶活性中心結構的研究。固氮酶由鐵蛋白和鉬鐵蛋白這兩種含過渡金屬的蛋白質組合而成。鐵蛋白主要起著電子傳遞輸送的作用,而含二個鉬原子和二三十個鐵和硫原子的鉬鐵蛋白是絡合N2或其他反應物(底物)分子,並進行反應的活性中心所在之處。關於活性中心的結構有多種看法,目前尚無定論。從各種底物結合物活化和還原加氫試驗來看,含雙鉬核的活性中心較為合理。我國有兩個研究組於1973—1974年間,不約而同地提出了含鉬鐵的三核、四核活性中心模型,能較好地解釋固氮酶的一系列性能,但其結構細節還有待根據新的實驗結果精確化。
國際上有關的研究成果認為,溫和條件下的固氮作用一般包含以下三個環節:
①絡合過程。它是用某些過渡金屬的有機絡合物去絡合N2,使它的化學鍵削弱;②還原過程。它是用化學還原劑或其他還原方法輸送電子給被絡合的N2,來拆開N2中的N-N鍵;③加氫過程。它是提供H+來和負價的N結合,生成NH3。
目前,化學模擬生物固氮工作的一個主要困難是,N2絡合了但基本上沒有活化,或絡合活化了,但活化得很不夠。所以,穩定的雙氮基絡合物一般在溫和條件下通過化學還原劑的作用只能析出N2,從不穩定的雙氮絡合物還原制出的NH3的量相當微少。因此迫切需要從理論上深入分析,以便找出突破的途徑。
固氮酶的生物化學和化學模擬工作已取得一定的進展,這必將有力地推動絡合催化的研究,特別是對尋找催化效率高的合成氨催化劑,將是一個有力的促進。
氨
藥物名稱
氨
簡介
化學式:NH3
藥物別名: 暫無
英文名稱: Ammonia
藥物說明: 稀氨溶液〔典〕(Dilute Ammonia Solution):每100ml中含氨10g,為無色的澄清液體;有刺激性特臭,呈鹼性反應。對昏迷、麻醉不醒者,嗅入本品有催醒作用。亦用於手術前醫生手的消毒,每次用本品25ml,加溫開水5L稀釋後供用。
主要成分: 暫無
性狀特徵: 暫無
功能主治: 吸入或口服本品,可刺激呼吸道或胃粘膜,反射性興奮呼吸和循環中樞。昏迷、醉酒者吸入氨水有蘇醒作用,對昏厥者作用較好。外用配成25%搽劑作為刺激藥,尚有中和酸的作用,用於昆蟲咬傷等。
用法用量: 暫無
不良反應: 暫無
注意事項: 暫無
衛生標準
MAC(NH3)=30mg/m3 , 44.11ppm;
STEL(NH3)=35ppm
IDLH(NH3)=300PPM
ERPG 濃度(ppm) 危害
ERPG1 25 引起刺激作用
ERPG2 200 可引起永久性損傷
ERPG3 1000 可致死
1,血氨增高原因
血氨清除不足 肝內鳥氨酸循環合成尿素是機體清除氨的主要代謝途徑。當供給鳥氨酸循環的ATP不足,催化鳥氨酸循環的有關酶的活性降低,其循環所需底物嚴重缺乏,以及腸道吸收的氨經門—體分流直接進入循環等多個環節2作用,最終導致血氨的增高。
血氨生成增多 1.腸道產氨增多 肝病致吸收不良,血液循環不暢、膽汁水泌不夠,食物消化不良致大量細菌繁殖增生,作用於腸道積聚的蛋白質及尿素,使產氨明顯增多。2.腎衰致血液中的尿素等非蛋白氮含量高於正常,因而彌散至腸腔內的尿素大大增加,使產氨增多。3.煩躁不安、震顫等肌肉活動增強,使肌肉中的腺苷酸分解代謝增強,也是血氨產生增多的原因之一。
腸道PH降低\尿液PH值升高 尿液中PH升高,則進入腎小管腔的NH3與H+結合減少,則NH3以氨根離子的形式隨尿排出的形式減少,致血氨升高。 腸道PH降低,氨根離子易於H+結合生成NH3,而不易隨糞便排出,使其吸收增加,致血氨濃度升高。
2,氨中毒機理
1.氨能夠干擾腦細胞的能量代謝 氨抑制丙酮酸脫羧酶的活性,使乙醯CoA生成減少,影響三羧酸循環的正常進行;消耗大量
α-酮戊二酸和還原型輔酶Ι ,造成ATP生成不足;氨與谷氨酸結合生成谷氨醯胺的過程中大量消耗ATP。總之,氨耗大是ATP,又使得腦細胞ATP生成減少以抑制腦細胞。
2.腦內神經遞質的改變 氨引起腦內谷氨酸、Ach等興奮神經遞質的減少,又使谷氨醯胺、γ-氨基丁酸等抑制性神經遞質增多,從而造成對中樞神經系統的抑制。
3.對神經細胞的抑制作用 NH3干擾神經細胞膜上的Na- K-ATP酶,使復極後膜離子轉動障礙,導致膜電位改變和興奮性異常;NH3與K+有競爭作用,影響Na K 在神經的細胞膜上的正常分布,從而干擾神經傳導活動。
綜上,氨中毒主要抑制中樞神經系統,正常情況下,中樞神經系統能夠抑制外周的低級中樞,當中樞神經系統受抑制,使得其對外周低級中樞的抑制作用減弱甚至消失,從而外周低級中樞興奮,出現一系列如肌隨意性興奮、角弓反射及抽搐等本能反應。
| 關於「氨」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |