鹼性磷酸酶
| A+醫學百科 >> 鹼性磷酸酶 |
目錄 |
生物化學特徵
鹼性磷酸酶名字
alkaline phosphatase (ALP 或 AKP)
現多用ALP
系統名phosphate-monoester phosphohydrolase (alkaline optimum)
其他名稱還有alkaline phosphomonoesterase; phosphomonoesterase; glycerophosphatase; alkaline phosphohydrolase; alkaline phenyl phosphatase; orthophosphoric-monoester phosphohydrolase (alkaline optimum);basic phosphatase
CAS 號: 9001-78-9
鹼性磷酸酶
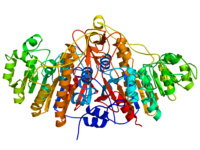
屬於同源二聚體蛋白,分子量為56KDa。每個單體由449個胺基酸組成,完整的AKP分子呈現典型的α/β的拓撲結構,同時每個單體均具有一個活性中心,活性中心區域由Asp101-Ser102-Ala103三連體、Arg166、水分子、三個金屬離子及其配體胺基酸組成。AKP被phoA 基因編碼,與很多分泌蛋白一樣,在細胞質內合成氨基末端帶有信號肽的單體前體,信號肽引導前體跨內膜運輸後被切除,同源二聚體形成。
鹼性磷酸酶是一種能夠將對應底物去磷酸化的酶,即通過水解磷酸單酯將底物分子上的磷酸基團除去,並生成磷酸根離子和自由的羥基,這類底物包括核酸、蛋白、生物鹼等。而該脫去磷酸基團的過程被稱為去磷酸化或脫磷酸化。鹼性磷酸酶是磷酸酶的一種,磷酸酶的作用與激酶的作用正相反,激酶是磷酸化酶,可以利用能量分子,如ATP,將磷酸基團加到對應底物分子上。鹼性磷酸酶在鹼性環境有最大活力,對來源於細菌中的ALP來說,其最適pH是8.0,而對來源於牛的ALP則是8.5。
ALP是一種含鋅的糖蛋白,在鹼性環境中(最適Ph為10左右)可以水解各種天然及人工合成的磷酸單酯化合物底物。
人體內的來源
人體內情況
鹼性磷酸酶是廣泛分布於人體各臟器器官中,其中以肝臟為最多其次為腎臟,骨骼、腸、和胎盤等組織,。這種酶能催化核酸分子脫掉5』磷酸基團,從而使DNA或RNA片段的5』-P末端轉換成5』-OH末端。但它不是單一的酶,而是一組同功酶。目前已發現有 AKP1 、 AKP2 、 AKP3 、 AKP4 、 AKP5 與 AKP6 六種同功酶。其中第 1 、 2 、 6 種均來自肝臟,第 3 種來自骨細胞,第 4 種產生於胎盤及癌細胞,而第 5 種則來自小腸絨毛上皮與成纖維細胞。 血清中的ALP主要來自肝臟和骨骼。生長期兒童血清內的大多數來自成骨細胞和生長中的骨軟骨細胞,少量來自肝。尿中的直接來自於腎小管細胞,並非來源於血液。
鹼性磷酸酶主要用於阻塞性黃疸、原發性肝癌、繼發性肝癌、膽汁淤積性肝炎等的檢查。患這些疾病時,肝細胞過度製造ALP,經淋巴道和肝竇進入血液,同時由於肝內膽道膽汁排泄障礙,反流入血而引起血清鹼性磷酸酶明顯升高。但由於骨組織中此酶亦很活躍。因此,孕婦、骨折癒合期、骨軟化症。佝僂病、骨細胞癌、骨質疏鬆、肝膿腫、肝結核、肝硬變、白血病、甲狀腺機能亢進時,血清鹼性磷酸酶亦可升高,應加以鑒別。
研究應用
鹼性磷酸酶也是目前免疫診斷試劑產品最常用的標記酶之一。與辣根過氧化物酶(HRP)相比,ALP用作標記酶的優點是,穩定性高、靈敏度高,缺點是成本高,標記困難。
在研究中最常用的ALP如下:
◇細菌鹼性磷酸酶Bacterial alkaline phosphatase (BAP), 來源:Escherichia coli C4 ;
◇ Shrimp alkaline phosphatase (SAP), 來源:一種北極蝦 (Pandalus borealis) ;
◇ 小牛腸鹼性磷酸酶Calf Intestinal Alkaline Phosphatase (CIP);
◇ 胎盤鹼性磷酸酶Placental alkaline phosphatase (PALP)和分泌性鹼性磷酸酶the secreted alkaline phosphatase (SEAP),後者是前者的C末端短缺版——與PALP相比,SEAP沒有PALP的C末端最後24個胺基酸(這24個胺基酸構成了與糖基化磷脂醯肌醇靶向錨定的區域)
ALP主要應用於分子生物學和酶免分析中:
★分子生物學中主要用作核酸的去磷酸化。因為DNA通常會在5'端結合磷酸基團,用ALP去磷酸化能防止DNA分子5'端與3'端連接,從而在後續步驟準備好之前讓DNA分子抑制處於線性化狀態;同樣,通過去磷酸化可用作放射標記示蹤。通常用作這些目的用的最多的是Shrimp alkaline phosphatase (SAP),因為在反應完成之後它是最容易滅活的。
★酶免分析中應用最多的是ELISA,以競爭法測小分子抗原為例,抗體先與固相載體結合,然後讓待測樣品與事先經ALP標記過的該抗原競爭地與抗體結合,洗去未反應的過量ALP-抗原,加入顯色底物。則可以通過與按梯度濃度變化的標準品繪出的標準曲線對比從而知道待測樣品中抗原的濃度。ELISA中用的比較多的是 辣根過氧化物酶(HRP),底物為OPD, 深桔黃色 ,檢測波長492nm;TMB, 藍綠色,檢測波長450nm 鹼性磷酸酶,底物為PNPP(對-消基苯磷酸酯), 黃色 ,檢測波長405nm
★目前工業上一個普遍的應用是作為檢驗牛奶的巴斯的滅菌的標誌:被巴斯德過高溫滅菌的分子會被滅活,向其中和未巴斯滅菌的牛奶中加入ALP的底物,2分鐘後未滅菌的樣品應該顯黃色,如果待測樣品(指被巴斯滅菌過的牛奶)也能呈現相同顏色,則說明巴斯滅菌溫度未過度。當然總有例外,因為有少數細菌會產生耐熱的ALP。
測定方法
有很多種,我國曾應用較廣的為磷酸苯二鈉比色法,但現在應用較多的是連續檢測法。
正常範圍
正常範圍(連續監測法)
女性,1-12歲小於500U/L;大於15歲,40-150U/L;
男性,1-12歲小於500U/L;12-15歲,小於750U/L;大於15歲,40-150U/L。
高值可能說明有單管阻塞現象;低值更多出現於兒童和孕婦身上。高值表明有可能發生了活性骨沉積(這個可能譯的不准,請指正,原文為active bone deposition),因為ALP是成骨細胞活動(造骨)的副產物(例如在佩吉氏斯症[畸形性骨炎]的案例中)。
一般來說,低值要比高值少見。
臨床意義
臨床上測定ALP主要用於骨骼 、肝膽系統疾病的診斷和鑒別診斷,尤其是黃疸的鑒別診斷。對於不明原因的高ALP血清水平,可測定同工酶以協助明確其器官來源。
1.生理性增高:兒童在生理性的骨骼發育期,鹼性磷酸酶活力可比正常人高1~2倍。處於生長期的青少年,以及孕婦和進食脂肪含量高的食物後均可以升高。
2.病理性升高:
(1)骨骼疾病如佝僂病、軟骨病、骨惡性腫瘤、惡性腫瘤骨轉移等;
(2)肝膽疾病如肝外膽道阻塞、肝癌、肝硬化、毛細膽管性肝炎等;
(3)其他疾病如甲狀旁腺機能亢進。
3.病理性降低:見於重症慢性腎炎、兒童甲狀腺機能不全、貧血等。
抑制作用
除來源於胎盤外所有哺乳動物的ALP同工酶都能被高精氨酸所抑制;而除來源於腸和胎盤外所有的ALP同工酶都能被左旋咪唑所抑制;而除了來源於胎盤的ALP(PALP和SEAP)外,幾乎所有的ALP都能在65℃2小時即被滅活。
單乙醇胺對鹼性磷酸酶有溫度依賴的抑制作用;
較高濃度的無機磷可競爭性地抑制鹼性磷酸酶的活性;
EDTA通過絡合鹼性磷酸酶而導致該酶活性中心微環境構象發生變化,從而不可逆地抑制鹼性磷酸酶的活性;
其他的抑制劑還有聯苯胺(競爭性)、L-苯丙氨酸和丹醯-L-苯丙氨酸(反競爭性)、含氮雜環氧釩配合物(選擇性)、五氯酚(對人胎盤鹼性磷酸酶反競爭性抑制)等。
| 關於「鹼性磷酸酶」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |