益賽普
| A+醫學百科 >> 益賽普 |
益賽普為白色凍乾粉針劑,適用於中度及重度活動性類風濕關節炎患者。
目錄 |
基本信息
[英文名] RecombinantHumanTumorNecrosisFactor-O Receptor
藥品名稱: 益賽普
生產廠家: 上海中信國健藥業有限公司
國藥准字: S20050058
藥品規格: 12.5mg/支
藥品簡介
性 狀
本品為白色凍乾粉針劑。
藥理毒理
已知TNF是類風濕性關節炎(PA)病理過程中的一種主要炎性介質,其參與調控的炎症反應可導致關節的病理改變。本品的作用機製為競爭性地與血中腫瘤壞死因子(TNF)-。結合,阻斷它和細胞表面TNF受體結
合,降低其活性。急性毒性試驗結果顯示給予小鼠靜脈注射160mg/kg的益賽普,未見毒性反應;給予猴4周的長期毒性試驗結果顯示,15mg/kg劑量的益賽普,無明顯毒性反應。
藥代動力學
臨床研究表明,本品皮下注射後,在注射部位緩慢吸收。單次給藥後,約48/I、時後可達血藥濃度峰值。絕對生物利用度約為76%。每周給藥2次,達穩態時的血藥濃度約為單次給藥峰度的2倍。 11名活動性類風濕關節炎患者皮下注射25mg/次,每周2次,連續給藥6周後,rhTNFR:Fc達穩態的時間為408i20h,達穩態時峰濃度(Css)max為3.0i0.2LJg/mi,達穩態時谷濃度(Css)min為2.610.2ug/mi,平均穩態濃度Css為2.810.3ug/mi,波動係數F●為12.8±3.3%。最後一次給藥後rhTNFR:Fc的半衰期T1/2為74i4h,Tmax為5316h,CL為102.8i10.4ml/h。在健康人和急性腎臟或肝臟功能異常的病人中觀察到的血藥濃度沒有十分顯著的差別,因此,對於腎臟功能受損的病人無需調整劑量。在研究中未觀察到甲氨喋呤(MTX)對重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白的藥動學的影響。
主要成分
每瓶含重組人II型腫瘤壞死因子受體一抗體融合蛋白(rhTNFR:Fc)12.5毫克或25毫克,甘露醇40毫克,蔗糖10毫克,三羥甲基氨基甲烷1.2毫克。用1毫升滅菌注射用水溶解。
功能主治
本品適用於中度及重度活動性類風濕關節炎患者。
用法用量
成人推薦劑量為每次mg,皮下注射,每周二次。注射前用1毫升注射用水溶解,溶解後可冷藏72/I、時。
不良反應
1、常見不良反應
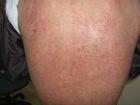
常見不良反應是注射部位局部反應,包括輕至中度紅斑、搔癢、疼痛和腫脹等,注射部位反應通常發
生在開始治療的第一個月內,在隨後的治療中發生頻率降低。注射部位反應平均持續3-5天。其它不良反應為頭痛、眩暈、皮疹,咳嗽,腹痛等。
2、感染
最常見的感染是上呼吸道感染。在安慰劑對照試驗中,沒有觀察到嚴重感染的發生率有顯著升高(安慰劑和重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白組的發生率都約為1%)。在所有臨床試驗中,RA患者中發生的嚴重感染有:腎盂腎炎,支氣管炎,化膿性關節炎,腹部膿腫,蜂窩組織炎,骨髓炎,傷口感染,肺炎,足膿腫,腿部潰瘍,腹瀉,鼻竇炎和敗血症。開放性試驗中嚴重感染的發生率和對照試驗中的發生率比較也基本相似。在上市後的應用中,嚴重感染包括敗血症和死亡都有報導。有些發生在開始使用後幾周內。許多患者除了患有RA外,還合併有其它問題(如糖尿病、充血性心衰、活動性或慢性感染)。一個有關敗血症的臨床試驗(並非均為RA患者)提示重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療可增加已患敗血症患者的死亡率。
3、免疫原性
對接受過重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療的RA、銀屑病性關節炎、強直性脊柱炎或銀屑病患者進行了多時間點的抗重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白抗體的檢測。大約6%接受過重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療的RA、銀屑病性關節炎、強直性脊柱炎或銀屑病患者至少一次檢測出針對TNF受體和其它重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白藥物蛋白成分的抗體,均為非中和性抗體。未發現抗體產生與臨床療效及不良事件的相關關係。重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白的長期免疫原性尚不清楚。
4、自身抗體
對RA患者取多點血清對自身抗體進行了檢測。在RA試驗I和II中,ANA新發陽性(≥1:40)的患者比例重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白組(11%)較安慰劑治療組(5%)為高。重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療後新發抗雙鏈DNA抗體的患者比例也較高,放射性免疫方法中重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療組15%,安慰劑治療組4%,綠蠅短膜蟲方法中重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療組為3%,安慰劑組則無。新發抗心磷脂抗體的患者比例,重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療組與安慰劑治療組相似。在RA試驗III中,和MTX組比較,重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療後新發自身抗體無明顯差別。但長期應用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白對自身免疫性疾病的影響還不清楚。
5、惡性腫瘤
在使用重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白的對照試驗中(對照治療時間為3-6個月),3435名接受重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療者中有2例淋巴瘤,1335名對照患者中未發生。
在有3389名RA患者接受重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療,平均治療時間28個月(約8000人-年)的臨床試驗中,觀察到有6例淋巴瘤(0.07例每100人-年)。在對照和開放試驗中,4650名接受重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療患者中(約9062人-年)觀察到7例淋巴瘤,是正常人群中預期淋巴瘤發生率的2倍。
另外還有45例腫瘤發生,最常見的是結腸,乳腺,肺和前列腺腫瘤,發生率和類型同正常人群中的預期類似。在3年的觀察中,對每6個月的腫瘤發生率進行分析發現沒有明顯變化。
6、血液系統
以重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療的病人有發生較罕見的紅細胞、白細胞、血小板下降及極為罕有再生不良性貧血。因此 在以重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療期間, 如果發生血液系統的異常或感染的症状(例如:持續高熱、咽喉疼痛、瘀斑、出血及面色蒼白)應立即就醫,而且立即對這些病人進行血常規檢測;如果確認有血液系統的不良反應,應中止本品的治療。
7、中樞神經系統
在重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白治療的病人中有發生中樞神經系統的脫髓鞘病變。不過與重組人Ⅱ型腫瘤壞死因子受體-抗體融合蛋白的關係目前尚不清楚。因此建議醫生在使用本品前,對於既往有脫髓鞘病變的病人,應慎重考慮。
禁 忌
敗血症,活動性結核病患者、對本品或製劑中其他成分過敏者禁用。
注意事項
1.患者有反覆發作的感染史或者有易導致感染的潛伏疾病時,考慮使用本品時應極為慎重。
2.在使用本品過程中患者出現上呼吸道反覆感染或有其他明顯感染傾向時,應及時到醫院就診,由醫生根據具體情況指導治療。
3. 當發生嚴重感染如糖尿病繼發感染,結核桿菌感染等時,患者應暫停使用本品。
4.在使用本品的過程中,應注意過敏反應的發生,包括血管性水腫、蕁麻疹以及其他嚴重反應, 因此,一旦出現過敏反應 的發生,應立刻中止本品的治療,並予適當處理。
5. 由於TNF可調節炎症及細胞免疫反應, 因此在使用本品時,應充分考慮到可能會影響患者的抗感染及惡性腫瘤的作用。
6. 目前尚無接受本品的患者在接種活疫苗後造成傳播感染的數據,但在使用本品期間不可接種活疫苗。 7.在同類品種上市後報導中發現有可能導致充血性心衰的病人病情惡化, 因此,對於有充血性心衰的患者在需要使用本品 時應極為慎重。
7. FDA調查發現,在使用TNF抑制劑的兒童和青少年中,有48人患上了淋巴瘤等癌症,在使用2年半後罹患癌症的風險將會升高。FDA自2008年6月開始對TNF抑制劑的副作用進行調查。一份分析報告稱,兒童和青少年在接受TNF抑制劑治療30個月以後罹患癌症的幾率將會增加。其中,約半數病例為淋巴瘤。
| 關於「益賽普」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |