生物化學與分子生物學/酶的分子組成和化學結構
| 醫學電子書 >> 《生物化學與分子生物學》 >> 酶 >> 酶的分子組成和化學結構 |
| 生物化學與分子生物學 |
|
|
|
一、酶的分子組成
根據酶的組成成份,可分單純酶和結合酶兩類。
單純酶(simpleenzyme)是基本組成單位僅為胺基酸的一類酶。它的催化活性僅僅決定於它的蛋白質結構。脲酶、消化道蛋白酶、澱粉酶、酯酶、核糖核酸酶等均屬此列。
結合酶(conjugatedenzyme)的催化活性,除蛋白質部分(酶蛋白apoenzyme)外,還需要非蛋白質的物質,即所謂酶的輔助因子(cofactors),兩者結合成的複合物稱作全酶(holoenzyme),即:
| 全酶 | =酶 蛋 白 | + 輔助因子 |
| (結合蛋白質) | (蛋白質部分) | (非蛋白質部分) |
酶的輔助因子可以是金屬離子,也可以是小分子有機化合物。常見酶含有的金屬離子有K+、Na+、Mg2+、Cu2+、(或Cu+)、Zn2+和Fe2+(或Fe3+)等。它們或者是酶活性的組成部分;或者是連接底物和酶分子的橋樑;或者在穩定酶蛋白分子構象方面所必需。小分子有機化合物是些化學穩定的小分子物質,其主要作用是在反應中傳遞電子、質子或一些基團,常可按其與酶蛋白結合的緊密程度不同分成輔酶和輔基兩大類。輔酶(coenzyme)與酶蛋白結合疏鬆,可以用透析或超濾方法除去;輔基(prostheticgroup)與酶蛋白結合緊密,不易用透析或超濾方法除去,輔酶和輔基的差別僅僅是它們與酶蛋白結合的牢固程度不同,而無嚴格的界限。
現知大多數維生素(特別是B族維生素)是組成許多酶的輔酶或輔基的成分(見表2-1)。它們的化學結構式見生物氧化章。體內酶的種類很多,而輔酶(基)的種類卻較少,通常一種酶蛋白只能與一種輔酶結合,成為一種特異的酶,但一種輔酶往往能與不同的酶蛋白結合構成許多種特異性酶。酶蛋白在酶促反應中主要起識別底物的作用,酶促反應的特異性、高效率以及酶對一些理化因素的不穩定性均決定於酶蛋白部分。
表2-1 B族維生素及其輔酶形式
| B族維生素 | 輔酶形式 | 主要作用 |
| 硫胺素(B1) | 硫胺素焦磷酸酯(TPP) | α-酮酸氧化脫羧酮基轉換作用 |
| 硫辛酸 |
6,8-二硫辛酸 |
α-酮酸氧化脫羧 |
| 泛酸 | 輔酶A(CoA) | 醯基轉換作用 |
| 核黃素(B2) | 黃素單核苷酸(FMN) 黃素腺嘌呤二核苷酸(FAD) |
氫原子轉移 氫原子轉移 |
| 尼克醯胺(PP) | 尼克醯胺腺嘌呤二核苷酸(NAD+) 尼克醯胺腺嘌呤二核苷酸磷酸(NADP+) |
氫原子轉移 氫原子轉移 |
| 吡哆素(B6) | 磷酸吡哆醛 | 胺基酸代謝 |
| 生物素(H) | 生物素 | 羧化作用 |
| 葉酸 | 四氫葉酸 | 「一碳基團」轉移 |
| 鈷胺素(B12) | 5-甲基鈷銨素 5-脫氧腺苷鈷銨素 |
甲基轉移 |
二、酶的分子結構和活性中心
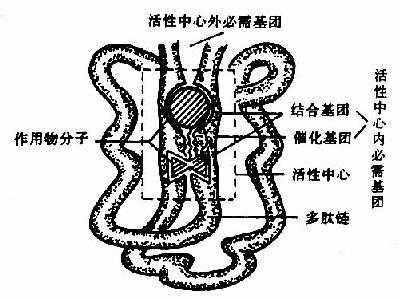
圖2-1 酶活性中心示意圖
酶的分子中存在有許多功能基團例如,-NH2、-COOH、-SH、-OH等,但並不是這些基團都與酶活性有關。一般將與酶活性有關的基團稱為酶的必需基團(essentialgroup)。有些必需基團雖然在一級結構上可能相距很遠,但在空間結構上彼此靠近,集中在一起形成具有一定空間結構的區域,該區域與底物相結合併將底物轉化為產物,這一區域稱為酶的活性中心(active center),對於結合酶來說,輔酶或輔基上的一部分結構往往是活性中心的組成成分。
構成酶活性中心的必需基團可分為兩種,與底物結合的必需基團稱為結合基團(binding group),促進底物發生化學變化的基團稱為催化基團(catalyticgroup)。活性中心中有的必需基團可同時具有這兩方面的功能。還有些必需基團雖然不參加酶的活性中心的組成,但為維持酶活性中心應有的空間構象所必需,這些基團是酶的活性中心以外的必需基團。
酶分子很大,其催化作用往往並不需要整個分子,如用氨基肽酶處理木瓜蛋白酶,使其肽鏈自N端開始逐漸縮短,當其原有的180個胺基酸殘基被水解掉120個後,剩餘的短肽仍有水解蛋白質的活性。又如將核糖核酸酶肽鏈C末端的三肽(棻麠絲楃?切斷,餘下部分也有酶的活性,足見某些酶的催化活性僅與其分子的一小部分有關。
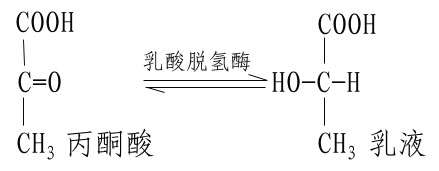
不同的酶有不同的活性中心,故對底物有嚴格的特異性。例如乳酸脫氫酶是具有立體異構特異性的酶,它能催化乳酸脫氫生成丙酮酸的可逆反應:
L(+)乳酸通過其不對稱碳原子上的桟H3、桟OOH及桹H基分別與乳酸脫氫酶活性中心的A、B及C三個功能基團結合,故可受酶催化而轉變為丙酮酸。而D(-)乳酸由於桹H、桟OOH的空間位置與L(+)乳酸相反,與酶的三個結合基團不能完全配合,故不能與酶結合受其催化(圖2)。由此可見,酶的特異性不但決定於酶活性中心的功能基團的性質,而且還決定於底物和活性中心的空間構象,只有那些有一定的化學結構,能與酶的結合基團結合,而且空間構型又完全適應的化合物,才能作為酶的底物。
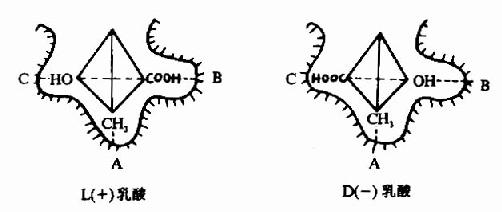
圖2-2 乳酸脫氫酶的立體異構特異性
A、B、C分別為LDH活性中心的三個功能基團
但是,酶的結構不是固定不變的,有人提出酶分子(包括輔酶在內)的構型與底物原來並非吻合,當底物分子與酶分子相碰時,可誘導酶分子的構象變得能與底物配合,然後底物才能與酶的活性中心結合,進而引起底物分子發生相應化學變化,此即所謂酶作用的誘導契合學說(induced fit theory)。用X衍射分析的方法已證明,酶在參與催化作用時發生了構象變化。
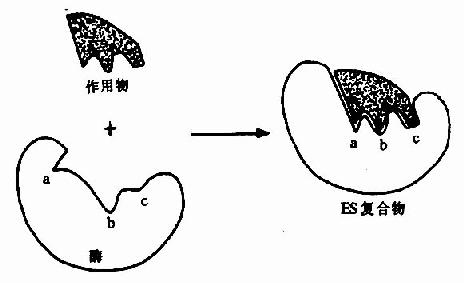
圖2-3 底物與酶相互作用的「誘導契合」模式圖
| 關於「生物化學與分子生物學/酶的分子組成和化學結構」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |