生物化學與分子生物學/參考:別構機制的模式
| 醫學電子書 >> 《生物化學與分子生物學》 >> 酶 >> 參考:別構機制的模式 |
| 生物化學與分子生物學 |
|
|
|
別構機制的模式
為了解釋別構酶協同效應的機制並推導出動力學曲線的方程式,不少人曾提出過各種模式,各有優缺點,現在主要把Hill模式敘述如下:
Hill模式
在協同結合模式中最早的一種是Hill在1909年提出的,企圖解釋氧結合至血紅蛋白的S形飽和曲線,現稱為Hill模式,後來經Atkinson應用於別構酶反應,他設想在這個系統中,n分子的配體(S)能夠一步結合到酶上去:
![]()
即此反應的總解離常數(K's)由下式決定
| K'S=[E][S]n/[ESS] | (6-7) |
而酶的飽和分數
| YS=每分子酶蛋白上已結合的底物分子數/每分子酶蛋白上底物結合位點的總數 | (6-8) |
又因總的酶濃度[E0]=[E]+[ES0]
| 故 YS=[ESn]/[E0]=[ESn]/[ESn]+[E] | (6-9) |
合併式6-7和式6-9,消去[ESn],則
| YS=[S]n/K'S+[S]n | (6-10) | ||
| YSK'S+YS[S]n=[S]n, | |||
| YSK'S=(1-Y)[S]n | (6-11) | ||
| Ys/1-Ys=[S]n/K'S | (6-11) | ||
| log | YS | =nlog[S]-logK'S | (6-13) |
| 1-YS | |||
因此以
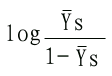 對log[S]作圖的話,可得斜率為n,縱軸截距為-logK'S的直線(見下圖)。
對log[S]作圖的話,可得斜率為n,縱軸截距為-logK'S的直線(見下圖)。
因v=k0[ESu],Vm=k0[E0],故
|
|
(6-14) |
將式6-10代入式6-14,即得
| [S]n/K'S+[S]n=v/Vm | |
| Vm[S]n=K'Sv+v[S]n | (6-15) |
| (Vm-v)[S]n=K'Sv | (6-16) |
| v/Vm-v=[S]n/K'S | (6-17) |
| logv/Vm-v=nlog[S]-logK'S | (6-18) |
式6-13或6-18即為Hill方程式,式6-18如以logv/Vm-v對log[S]作圖,也可得一直線(見下圖)。
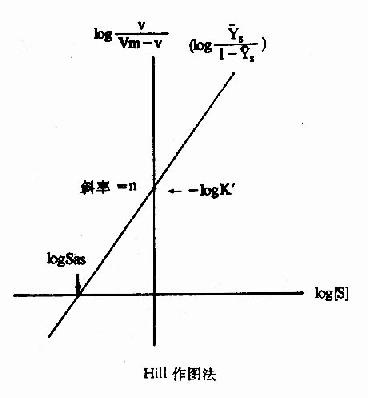
Hill作圖法
如v=Vm/2時,式6-19為log1=nlog[S]-logK'S=0(6-19)
此時的[S]即S0.5,故nlogS0.5=logK'5(6-20)式6-18所得的直線斜率為n,縱軸截距為-logk'S,而橫軸截距為logK'S/n,即log[S]0.5,但[S0.5]也可在已知logK'S後通過式6?0求取。
上節已述及,S0-5就相當於米曼氏動力學中的Km,當K0《k-1/k1時,可反映別構酶對底物的親和力,S0.5愈小,親和力愈大,而K's實際上已與親和力關係不大,因受到n的影響。故反映底物親和力的參數,已從非別構酶的Km一項移到別構酶的[S]一項,並且式6?0可看出K'S是隨[S]而改變的,不是一個常數。由於K'S的測定是假設V=(1/2)Vm或[S]=S0.5的條件下計算的,故有些作者用S0.5S,來代表別構酶的K'5,以免與Km混淆。
Hill作圖法的斜率n,稱為Hill係數,即前述的協同係數,一般可用nH或h代表。當nH=1時,式6-1變為V=Vm[S]/(K1+[S]),即米曼氏方程式,表示無協同作用,此時K'或S0.5S,=S0-5=Km,至於nH>1為正協同,nH<1為負協同。
Hill模式比較簡單,式6-1或式6-10都是S形曲線方程式,但有不少缺點:(1)按理,Hill係數應等於酶分子中可能有結合底物的位點數,但因忽略了ESn-1,ESn-2…ES1等中間形式的酶底物複合體,根據Hill氏作圖計算出來的n值一般均低於真實的位點數。以別構蛋白Hb為例,理論上每分子Hb可結合四分子氧,即n=4,但計算結果n=2.6~2.8。在負協同效應時,每分子酶也結合n個底物(n>1)但計算結果卻是n<1。故Hill係數已不能代表結合底物的位點數,而只能作為底物協同性的指標。(2)在S濃度過高(酶90%以上被S飽和)或過低(酶僅10%以下被S飽和)時,Hill線的斜率n常等於1,故當測定別構酶活力時,[S]的範圍較廣,得出的Hill線不是直線而是折線(見下圖)。(3)n分子的底物同時和酶作用,反應的級數為n+1,如n-4則為五級反應,這在動力學上是不可能的。但儘管如此,Hill作圖法仍不失是一個求取別構酶S0.5和鑒定協同類型及協同作用大小的常用方法。
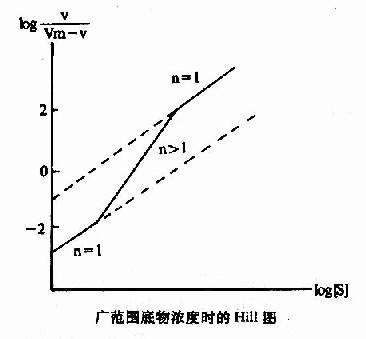
廣範圍底物濃度時的Hill圖
| 關於「生物化學與分子生物學/參考:別構機制的模式」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |