生物化學與分子生物學/酶促反應的動力學
| 醫學電子書 >> 《生物化學與分子生物學》 >> 酶 >> 酶促反應的動力學 |
| 生物化學與分子生物學 |
|
|
|
酶促反應動力學(kineticsof enzyme-catalyzed reactions)是研究酶促反應速度及其影響因素的科學。這些因素主要包括酶的濃度、底物的濃度、pH、溫度、抑制劑和激活劑等。在研究某一因素對酶促反應速度的影響時,應該維持反應中其它因素不變,而只改變要研究的因素。但必須注意,酶促反應動力學中所指明的速度是反應的初速度,因為此時反應速度與酶的濃度呈正比關係,這樣避免了反應產物以及其他因素的影響。
酶促反應動力學的研究有助於闡明酶的結構與功能的關係,也可為酶作用機理的研究提供數據;有助於尋找最有利的反應條件,以最大限度地發揮酶催化反應的高效率;有助於了解酶在代謝中的作用或某些藥物作用的機理等,因此對它的研究具有重要的理論意義和實踐意義。
目錄 |
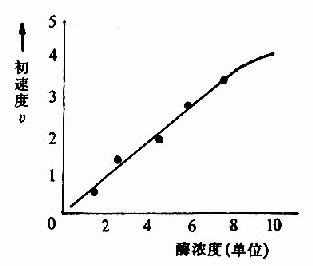
一、酶濃度對反應速度的影響
在一定的溫度和pH條件下,當底物濃度大大超過酶的濃度時,酶的濃度與反應速度呈正比關係(圖2-7)。
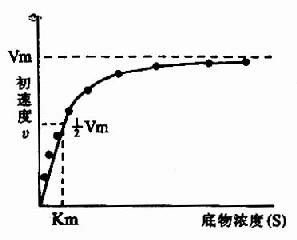
二、底物濃度對反應速度的影響
在酶的濃度不變的情況下,底物濃度對反應速度影響的作用呈現矩形雙曲線(rectangular hyperbola)(圖2-8)。
|
|
|
| 圖2-7 酶濃度對反應初速度的影響 | 圖2-8 底物濃度對反應初速度的影響 |

在底物濃度很低時,反應速度隨底物濃度的增加而急驟加快,兩者呈正比關係,表現為一級反應。隨著底物濃度的升高,反應速度不再呈正比例加快,反應速度增加的幅度不斷下降。如果繼續加大底物濃度,反應速度不再增加,表現為0級反應。此時,無論底物濃度增加多大,反應速度也不再增加,說明酶已被底物所飽和。所有的酶都有飽和現象,只是達到飽和時所需底物濃度各不相同而已。
(一)米曼氏方程式
解釋酶促反應中底物濃度和反應速度關係的最合理學說是中間產物學說。酶首先與底物結合生成酶椀孜鋦春銜?中間產物),此複合物再分解為產物和游離的酶。
Michaelis和Menten在前人工作的基礎上,經過大量的實驗,1913年前後提出了反應速度和底物濃度關係的數學方程式,即著名的米椔戲匠淌?michaelismenten equation).
V=Vmax[S]/Km+[S]
Vmax指該酶促反應的最大速度,[S]為底物濃度,Km是米氏常數,V是在某一底物濃度時相應的反應速度。當底物濃度很低時,[S]《Km,則V≌Vmax/Km[S],反應速度與底物濃度呈正比。當底物濃度很高時,[S]》Km,此時V≌Vmax,反應速度達最大速度,底物濃度再增高也不影響反應速度(圖2-9)。
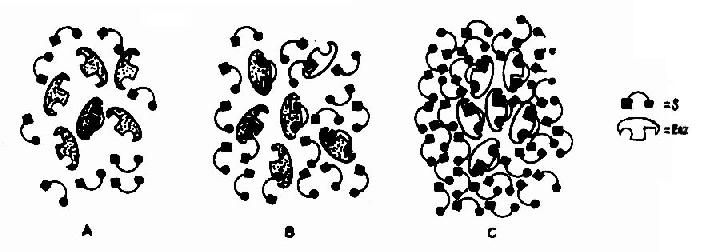
圖2-9 酶與不同濃度的底物相互作用模式
(二)米-曼氏方程式的推導
米-曼氏方程式提出後又經riggs和Haldane的充實和發展,經補充和發展的米-曼氏方程工推導如下:
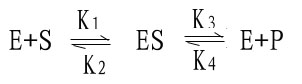 (1)
(1)
式中K1、K2、K3、K4分別為各向反應的速度常數。
從式(1)中知,ES的生成途徑來自E+S和E+P,但其中E+P生成ES的速度極小(尤其在起始階段,P的生成很少),可以忽略不計,又因為底物濃度大大超過酶的濃度,[S]》[E],中間產物ES中的S濃度可以忽略不計,因此,ES的生成速度為:
| d[ES] | = | K1([Et]-[ES]).[S] | (2) |
| dt |
其中[Et]-[ES]為游離酶的濃度,ES的分解速度為:
| - | [ES] | = | K2[ES]+K3[ES]=(K2+K3)[ES] | (3) |
| dt |
當反應體系處於穩態時,ES生成和分解的速度相等,即
K1([Et]-[ES]).[S]=(K2+K3)[ES]
| K2+K3 | = | [Et]-[ES] | .[S] |
| K1 | [ES] |
令K2+K3/K1=Km 則 Km=[Et]-[ES]/[ES].[S]
[ES]=[Et][S]/Km+[S] (4)
由於反應速度取決於產物P的生成量,故
V=K3[ES (5)
在酶促反應達最大速度時,所有的酶分子都已與底物結合形成中間產物,此時
[Et]=[ES] (6)
那麼 Vmax=K3[Et] (7)
在(4)式兩邊乘以K3得:
K3.[ES]=K3.[Et][S]/Km+[S] 以(5)和(7)式代入,即:
V=Vmax[S]/Km+[S]
(三)米氏常數的意義
當反應速度為最大速度一半時,米氏方程可以變換如下:
½Vmax=Vmax[S]/Km+[S]
進一步整理可得到:
Km=[S]
可知,Km值等於酶反應速度為最大速度一半時的底物濃度。
因為Km=K2+K3/K1,當K2》K3,即ES解離成E和S的速度大大超過分離成E和P的速度時,K3可以忽略不計,此時Km值近似於ES解離常數KS,此時Km值可用來表示酶對底物的親和力。
Km=K2/K1=[E][S]/[ES]=KS
Km值愈大,酶與底物的親和力愈小;Km值愈小,酶與底物親和力愈大。酶與底物親和力大,表示不需要很高的底物濃度,便可容易地達到最大反應速度。但是KS值並非在所有酶促反應中都遠小於K2,所以Ks值(又稱酶促反應的底物常數)和Km值的涵義不同,不能互相代替使用。
Km值是酶的特徵性常數,只與酶的性質,酶所催化的底物和酶促反應條件(如溫度、pH、有無抑制劑等)有關,與酶的濃度無關。酶的種類不同,Km值不同,同一種酶與不同底物作用時,Km值也不同。各種酶的Km值範圍很廣,大致在10-1~10-6M之間。
當K3不遠遠小於K2和K1時,Km表示整個反應的化學平衡的常數。
如果Km值已知,任何底物濃度時酶的飽和度(形成中間產物的酶佔總酶的比例,saturation fraction fEs)fEs便可計算出來。
fES=[ES]/[Et]=K3[ES]/K3[Et]=V/Vmax=[S]/Km+[S]
(四)Km和Vmax的求法
如圖2?所示,底物濃度曲線是矩形雙曲線。
從圖中很難精確地測出Km和Vmax。為此人們將米氏方程進行種種變換,將曲線作圖轉變成直線作圖。
1.雙倒數作圖(doublereciprocal plot or LineweaverBurk plot)
將米氏方程兩邊取倒數,可轉化為下列形式:
1/V=Km/Vmax.1/[S]+1/Vmax
從圖2-10可知,1/V對1/[S]的作圖得一直線,其斜率是Km/V,在縱軸上的截距為1/Vmax,橫軸上的截距為-1/Km。此作圖除用來求Km和Vmax值外,在研究酶的抑制作用方面還有重要價值。
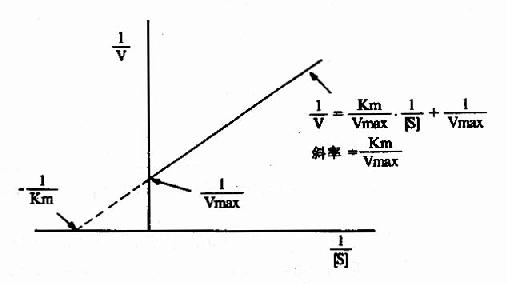
圖2-10 雙倒數作圖法
![v對v/[s]作圖法](http://p.ayxbk.com/images/f/ff/Gra28hdm.jpg)
圖2-11 v對v/[s]作圖法
2.V對V〖〗[S][SX)]法(EadieHofstee plot)
將米氏方程經移項整理後可寫成
VKm+V[S]=Vm[S]
V[S]=Vm[S]-VKm
故V=Vm-KmV/[S]
以V為縱坐標對V/[S]橫坐標作圖,所得直線,其縱軸的截距為Vmax,斜率為Km(圖2-11)。
必須指出米氏方程只適用於較為簡單的酶作用過程,對於比較複雜的酶促反應過程,如多酶體系、多底物、多產物、多中間物等,還不能全面地籍此概括和說明,必須藉助於複雜的計算過程。
三、pH對反應速度的影響
酶反應介質的pH可影響酶分子,特別是活性中心上必需基團的解離程度和催化基團中質子供體或質子受體所需的離子化狀態,也可影響底物和輔酶的解離程度,從而影響酶與底物的結合。只有在特定的pH條件下,酶、底物和輔酶的解離情況,最適宜於它們互相結合,並發生催化作用,使酶促反應速度達最大值,這種pH值稱為酶的最適pH(optimum pH)。它和酶的最穩定pH不一定相同,和體內環境的pH也未必相同。
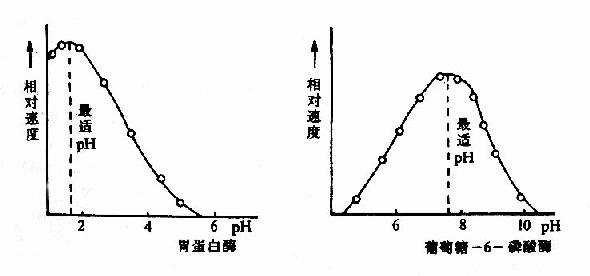
圖2-12 胃蛋白酶和葡萄糖-6-磷酸酶的pH活性曲線
動物體內多數酶的最適pH值接近中性,但也有例外,如胃蛋白酶的最適pH約1.8,肝精氨酸酶最適pH約為9.8(見表2-2)。
表2-2 一些酶的最適pH
| 酶 | 最適pH | 酶 | 最適pH | 酶 | 最適pH |
| 胃蛋白酶 | 1.8 | 過氧化氫酶 | 7.6 | 延胡索酸酶 | 7.8 |
| 胰蛋白酶 | 7.7 | 精氨酸酶 | 9.8 | 核糖核酸酶 | 7.8 |
最適pH不是酶的特徵性常數,它受底物濃度、緩衝液的種類和濃度以及酶的純度等因素的影響。
溶液的pH值高於和低於最適pH時都會使酶的活性降低,遠離最適pH值時甚至導致酶的變性失活。測定酶的活性時,應選用適宜的緩衝液,以保持酶活性的相對恆定。
四、溫度對反應速度的影響
化學反應的速度隨溫度增高而加快。但酶是蛋白質,可隨溫度的升高而變性。在溫度較低時,前一影響較大,反應速度隨溫度升高而加快,一般地說,溫度每升高10℃,反應速度大約增加一倍。但溫度超過一定數值後,酶受熱變性的因素佔優勢,反應速度反而隨溫度上升而減緩,形成倒V形或倒U形曲線。在此曲線頂點所代表的溫度,反應速度最大,稱為酶的最適溫度(optimum temperature)(圖2-13)。
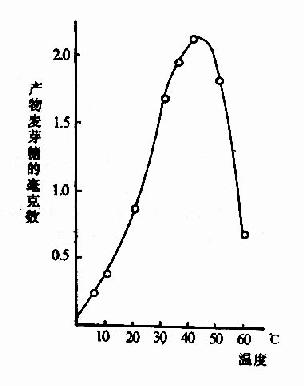
圖2-13 溫度對唾液澱粉酶活性影響
從動物組織提取的酶,其最適溫度多在35℃~40℃之間,溫度升高到60℃以上時,大多數酶開始變性,80℃以上,多數酶的變性不可逆。酶的活性雖然隨溫度的下降而降低,但低溫一般不破壞酶。溫度回升後,酶又恢復活性。臨床上低溫麻醉就是利用酶的這一性質以減慢組織細胞代謝速度,提高機體對氧和營養物質缺乏的耐受體,有利於進行手術治療。
酶的最適溫度不是酶的特徵性常數,這是因為它與反應所需時間有關,不是一個固定的值。酶可以在短時間內耐受較高的溫度,相反,延長反應時間,最適溫度便降低。
五、抑制劑對反應速度的影響
凡能使酶的活性下降而不引起酶蛋白變性的物質稱做酶的抑制劑(inhibitor)。使酶變性失活(稱為酶的鈍化)的因素如強酸、強鹼等,不屬於抑制劑。通常抑制作用分為可逆性抑制和不可逆性抑制兩類。
(一)不可逆性抑制作用(irreversibleinhibition)
不可逆性抑制作用的抑制劑,通常以共價鍵方式與酶的必需基團進行不可逆結合而使酶喪失活性,按其作用特點,又有專一性及非專一性之分。
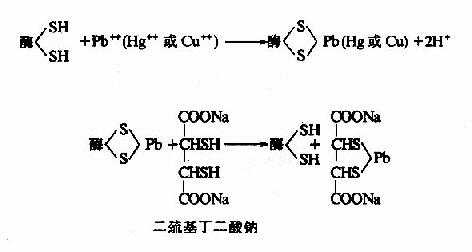
1.非專一性不可逆抑制
抑制劑與酶分子中一類或幾類基團作用,不論是必需基團與否,皆可共價結合,由於其中必需基團也被抑制劑結合,從而導致酶的失活。某些重金屬(Pb++、Cu++、Hg++)及對氯汞苯甲酸等,能與酶分子的巰基進行不可逆適合,許多以巰基作為必需基團的酶(通稱巰基酶),會因此而遭受抑制,屬於此種類型。用二巰基丙醇(british antilewisite,BAL)或二巰基丁二酸鈉等含巰基的化合物可使酶復活。
2.專一性不可逆抑制
此屬抑制劑專一地作用於酶的活性中心或其必需基團,進行共價結合,從而抑制酶的活性。有機磷殺蟲劑能專一作用於膽鹼酯酶活性中心的絲氨酸殘基,使其磷醯化而不可逆抑制酶的活性。當膽鹼酯酶被有機磷殺蟲劑抑制後,膽鹼能神經末稍分泌的乙醯膽鹼不能及時分解,過多的乙醯膽鹼會導致膽鹼能神經過度興奮的症状。解磷定等藥物可與有機磷殺蟲劑結合,使酶和有機磷殺蟲劑分離而復活。
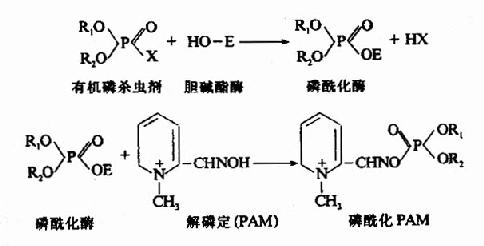
(二)可逆性抑制(reversible inhibition)
抑制劑與酶以非共價鍵結合,在用透析等物理方法除去抑制劑後,酶的活性能恢復,即抑制劑與酶的結合是可逆的。這類抑制劑大致可分為以下二類。
1.競爭性抑制(competitive inhibition)
(1)含義和反應式
抑制劑I和底物S對游離酶E的結合有競爭作用,互相排斥,已結合底物的ES複合體,不能再結合I。同樣已結合抑制劑的EI複合體,不能再結合S。
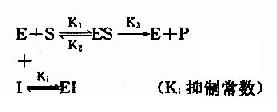
抑制劑I在化學結構上與底物S個相似,能與底物S競爭酶E分子活性中心的結合基團,因此,抑制作用大小取決於抑制劑與底物的濃度比,加大底物濃度,可使抑制作用減弱。
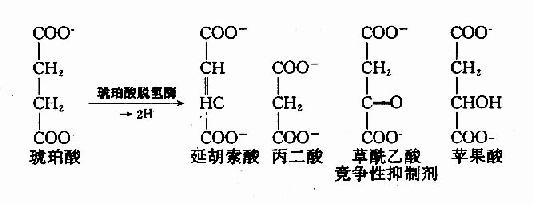
例如,丙二酸、蘋果酸及草醯乙酸皆和琥珀酸的結構相似,是琥珀酸脫氫酶的競爭性抑制劑。
(2)反應速度公式及作圖
按米氏公式推導方法,也可演算出競爭性抑制時,抑制劑、底物和反應速度之間的動力學關係及其雙倒數方程式為:
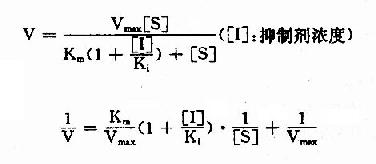
以1V分別為橫坐標和縱坐標作圖,此方程式可繪成競爭性抑制作用的特性曲線(圖2-14)。
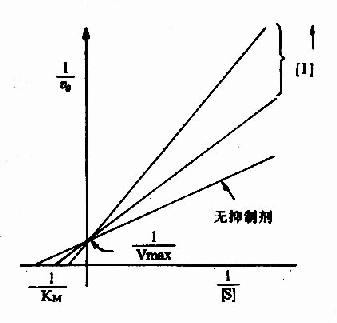
圖 2-14 競爭性抑制
有競爭性抑制劑存在的曲線與無抑制劑的曲線相交於縱坐標I/Vmax處,但橫坐標的截距,因競爭性抑制存在變小,說明該抑制作用,並不影響酶促反應的最大速度,而使Km值變大。
很多藥物都是酶的競爭性抑制劑。例如磺胺藥與對氨基苯甲酸具有類似的結構(如圖2-15),而對氨基苯甲酸、二氫喋呤及谷氨酸是某些細菌合成二氫葉酸的原料,後者能轉變為四氫葉酸,它是細菌合成核酸不可缺少的輔酶。由於磺胺藥是二氫葉酸合成酶的競爭性抑制劑,進而減少菌體內四氫葉酸的合成,使核酸合成障礙,導致細菌死亡。抗菌增效劑-甲氧苄氨嘧啶(TMP)能特異地抑制細菌的二氫葉酸還原為四氫葉酸,故能增強磺胺藥的作用。
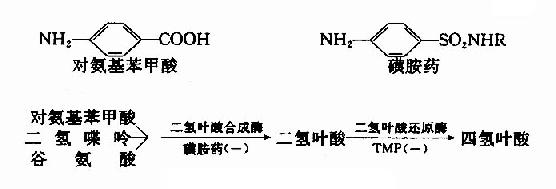
圖2-15 磺胺藥物的抑菌作用
2.非競爭性抑制(non-competitive inhibition)
(1)含義和反應式
抑制劑I和底物S與酶E的結合完全互不相關,既不排斥,也不促進結合,抑制劑I可以和酶E結合生成EI,也可以和ES複合物結合生成ESI。底物S和酶E結合成ES後,仍可與I結合生成ESI,但一旦形成ESI複合物,再不能釋放形成產物P。
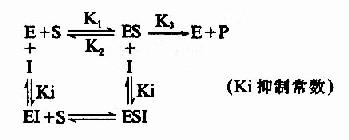
I和S在結構上一般無相似之處,I常與酶分子上結合基團以外的化學基團結合,這種結合併不影響底物和酶的結合,增加底物濃度並不能減少I對酶的抑製程度。
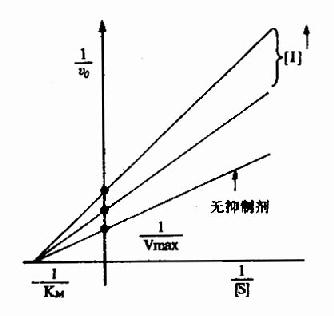
圖2-16 非競爭性抑制
(2)反應速度公式及作圖
按米氏公式推導方法可演算出非競爭性抑制時,抑制劑、底物濃度和反應速度之間動力學關係:
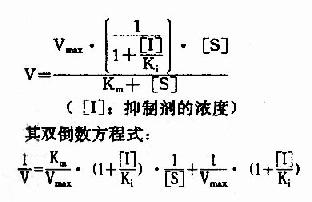
以1V分別為橫坐標和縱坐標作圖,此方程式可繪成非競爭性抑制作用的特性曲線(圖2-16)。
有非競爭性抑制劑存在的曲線與無抑制劑存在的曲線相交於橫坐標-1/Km處,縱坐標截距,因非競爭性抑制劑的存在而變大,說明該抑制作用,並不影響底物與酶的親和力,而使酶促最大反應速度變小。
如賴氨酸是精氨酸酶的競爭性抑制劑,而中性胺基酸(如丙氨酸)則是非競爭性抑制劑。
總上所述,酶的競爭性和非競爭性抑制可通過雙倒數作圖加以區別。Vmax不因競爭性抑制劑的存在而改變,Km則不因非競爭性抑制劑的存在而改變。
六、激活劑對酶促反應速度的影響
能使酶活性提高的物質,都稱為激活劑(activator),其中大部分是離子或簡單的有機化合物。如Mg++是多種激酶和合成酶的激活劑,動物唾液中的α-澱粉酶則受Cl-的激活。
| 關於「生物化學與分子生物學/酶促反應的動力學」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |