病理學/動脈粥樣硬化病理變化
| 醫學電子書 >> 《病理學》 >> 心血管疾病 >> 動脈粥樣硬化 >> 動脈粥樣硬化病理變化 |
| 病理學 |
|
|
|
動脈壁的年齡變化:據國內研究,早在3個月胎齡時即見到主動脈內彈力膜分層,中膜淺層SMC空過彈力膜窗孔進入內膜,其後SMC增生,產生膠原、彈 性纖維及蛋白多糖。內膜隨著年齡增長而逐漸增厚。此外,在動脈杈或分支開口處常見小塊白色增厚區,稱為內膜墊(intimal cushion)。內膜墊由SMC、膠原纖維及蛋白多糖組成,可能是對血流剪應力的反應。據病理普查結果表明,動脈粥樣硬化病變的發生與年齡的關係十分密 切。動脈杈、分支開口及血管彎曲的凸面為病變的好發部位。
1.脂紋 脂紋(fatty streak)是動脈粥樣硬化的早期病變。據屍檢普查,9歲以下兒童的主動脈脂紋檢出率為11.5%,10~19歲為48.96%。肉眼觀,主動脈的脂紋 常見於其後壁及分支開口處,為帽針頭大小斑點及寬約1~2mm、長短不一的黃色條紋,不隆起或稍微隆起於內膜表面。
脂紋的形成多先有高脂血 症,高脂血症或其它有害因子可造成內皮損傷,使其表面糖萼變薄,內皮細胞間間隙增寬。LDL與內皮細胞的高親和性受體結合而被攝取,通過胞漿,進入內皮下 間隙,並被內皮細胞及SMC釋放的氧自由基氧化修飾,產生氧化LDL(OX-LDL)及氧化Lp(a)[OX-Lp(a)]。
在動脈分杈、 分支開口處以及變曲動脈的凸面的血流剪應力減低,並可出現渦流,這使單核細胞易離開軸流與內皮接觸。已知內皮細胞能分泌幾種粘附分子,例如細胞間粘附分子 (intercellular adhesion molecule-1,ICAM-1)及血管粘附分子(vascular adhesion molecule-1,VCAM-1)。ICAM-1可與白細胞表面的受體β2整合素(β2integrin,包括LFA-1及MAC-1)結 合,VCAM-1可與白細胞的受體(VLA-4)結合,從而使單核細胞粘附於內皮表面。
單核細胞遷入內皮下間隙受多種因素影響。其中最重要 的是SMC分泌的單核細胞趨化蛋白1(monocyte chemotactic protein 1,MCP-1),對單核細胞有很強的趨化活性。此外,動脈壁細胞產生的生長因子(如PDGF)及OX-LDL等對單核細胞亦有趨化活性。遷入內皮下間隙 的單核細胞被激活並分化成巨噬細胞。
OX-LDL、OX-Lp(a)可與巨噬細胞表面的清道夫受體結合而被攝取。這些受體對膽固醇無下調作用,因而被巨噬細胞攝取的脂質愈來愈多,直至形成泡沫細胞(foam cell)(圖8-1)。
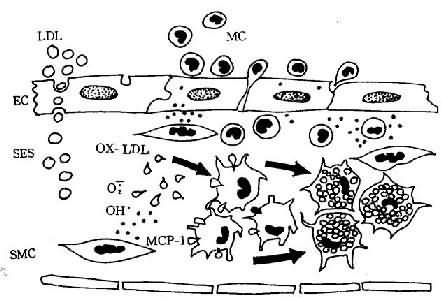
圖8-1 單核細胞遷入內膜及泡沫細胞形成模式圖
LDL滲入內皮下間隙(SES),被氧自由基氧化修飾;MCP-1釋放,單核細胞(MC)遷入內膜,OX-LDL與巨噬細胞表面的清道夫受體結合而被攝取,泡沫細胞形成(EC:內皮細胞,SMC:平滑肌細胞)(仿Schwartz)
大 量泡沫細胞聚集即形成脂紋,內皮隆起及變形。電鏡下,巨噬細胞源性泡沫細胞表面富有突起,形成絲狀偽足;胞漿內含有大量較小的脂質空泡和溶酶體,有時還見 到膽固醇結晶;核卵圓或略呈腎形,異染色質常呈塊狀緊靠核膜,偶見1~2個核仁。內皮細胞、巨噬細胞及SMC均可分泌生長因子〔PDGF、纖維母細胞生長 因子(FGF)、表皮生長因子(EGF)等〕,在其作用下,原已存在於內膜的SMC增生;中膜SMC發生表型轉變(phenotypic modulation),即由收縮型(胞漿內含大量肌絲及緻密體)轉變為合成型(含大量粗面內質網、核蛋白體及粒線體);同時,SMC穿過內彈力板窗孔遷 移入內皮下間隙並增生。SMC表面有LDL受體,可結合、攝取LDL及VLDL而成為泡沫細胞(肌源性泡沫細胞)。電鏡下,肌源性泡沫細胞多呈長形,或有 突起,多少保持SMC的特點,胞漿內可見肌絲和緻密體,脂質空泡多少不定,一般稍大,有時能見到基底膜(圖8-2)。
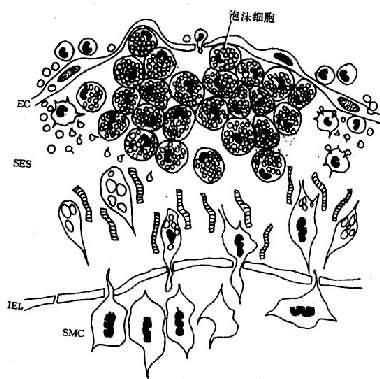
圖8-2 脂紋組織結構模式圖
內 皮下間隙(SES)大量巨噬細胞源性泡沫細胞聚集,中膜SMC穿過內彈性膜(IEL)窗孔遷入內膜,增生並攝取脂質,內膜隆起及變形EC:內皮細胞病變的 進展:已知OX-LDL具有細胞毒性,當大量OX-LDL被巨噬細胞攝取,超過了其清除能力時可引起泡沫細胞的壞死,導致細胞外脂質核心形成。加 之,SMC大量增生,穿插於巨噬細胞源性泡沫細胞之間,產生膠原、彈性纖維及蛋白多糖,使病變演變為纖維斑塊(圖8-3)。
2.纖維斑塊 肉眼觀,纖維斑塊(fibrous plaque)為隆起於內膜表面的灰黃色斑塊。隨著斑塊表層的膠原纖維不斷增加及玻璃樣變,脂質被埋於深層,斑塊乃逐漸變為瓷白色。鏡檢下,斑塊表面為一 層纖維帽,乃由多量SMC及大量細胞外基質(包括膠原、彈性纖維、蛋白聚糖及細胞外脂質)組成。纖維帽之下有不等量的增生的SMC、巨噬細胞及兩種泡沫細 胞,以及細胞外脂質及基質(圖8-4,圖8-5)。
由於OX-LDL的細胞毒性作用,以及很可能內皮細胞及SMC產生的氧自由基的作用,可 引起斑塊內細胞損傷及壞死。比較脆弱的巨噬細胞源性泡沫細胞壞死後,其胞漿內的脂質被釋放出來,成為富含膽固醇酯的脂質池。泡沫細胞壞死崩解,釋放出許多 溶酶體酶,促進其它細胞壞死崩解。隨著這些病理過程的發展,纖維斑塊逐漸演變為粥樣斑塊。
3.粥樣斑塊 粥樣斑塊(atheromatous plaque)亦稱粥瘤(atheroma)。肉眼觀,為明顯隆起於內膜表面的灰黃色斑塊。切面,表層的纖維帽為瓷白色,深部為多量黃色粥糜樣物質(由脂 質和壞死崩解物質混合而成)(圖8-6)。鏡檢下,纖維帽趨於老化,膠原纖維陷於玻璃樣變,SMC被分散埋藏在細胞外基質之中。深部為大量無定形壞死物 質,其內富含細胞外脂質,並見膽固醇結晶(石蠟切片上為針狀空隙)、鈣化等(圖8-7)。底部和邊緣可有肉芽組織增生,外周可見少許泡沫細胞和淋巴細胞浸 潤。病變嚴重者中膜SMC呈不同程度萎縮,中膜變薄。外膜可見新生毛細血管、不同程度的結締組織增生及淋巴細胞、漿細胞浸潤。一些學者認為,這種外膜炎症 (慢性主動脈周圍炎)可能是對粥瘤中的類蠟質(ceroid 一種含高度不飽和脂肪酸的黃色臘樣物質)成分的一種自身免疫反應。
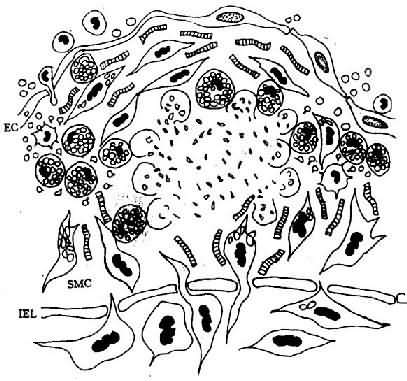
圖8-3 脂紋的進展
泡沫細胞壞死及細胞外脂質核心形成,SMC繼續增生,產生膠原、彈性纖維及蛋白多糖,使病變演變為纖維斑塊

圖8-4 發展中的纖維粥樣斑塊
斑塊表層為脂紋,含有泡沫細胞和增生的平滑肌細胞;深層有大量膽固醇(針狀結晶)析出和泡沫細胞散在。男性,25歲,主動脈。
圖8-5 發展中的纖維粥樣斑塊
圖8-4的斑塊深層。高倍鏡下可見大量膽固醇結晶、泡沫細胞和增生的平滑肌細胞

圖8-6 主動脈粥樣硬化
主動脈內膜面見粥樣斑塊形成
4.複合病變
(1)斑塊內出血:在粥樣斑塊的邊緣常見到許多薄壁的新生血管。在血流剪應力作用下,這些薄壁血管常易破裂出血,可形成血腫,使斑塊更加隆起,其後血腫被機化。
(2) 斑塊破裂:為最危險的併發症,斑塊破裂常形成潰瘍(粥瘤性潰瘍)及並發血栓形成;壞死性粥樣物質可排入血流而造成膽固醇栓塞。斑塊破裂常見於腹主動脈下 端、髂動脈和股動脈。富含軟的細胞外脂質的斑塊,特別是脂質池偏位時,容易破裂。斑塊外周部分纖維帽最薄,含膠原、氨基葡聚糖及SMC較少,細胞外脂質較 多,抗張強度較差,該處巨噬細胞源性泡沫細胞浸潤也最多。因此,破裂往往發生在纖維帽的外周。
(3)血栓形成:表淺的或由於斑塊破裂造成較 深的內膜損傷,均可使膠原暴露,通過von Willebrand因子的介導,引起血小板的聚集而形成血栓,可引起器官動脈阻塞而導致梗死(如腦梗死、心肌梗死)。冠狀動脈血栓的機化及再通可在一定 程度上恢復該支動脈的血流,有助於保持梗死灶周圍心肌的存活。
(4)鈣化:多見於老年患者,鈣鹽可沉積於坏死灶及纖維帽內,動脈壁因而變硬、變脆。鈣化灶可進而發生骨化。

圖8-7 主動脈粥樣硬化
內膜中形成粥瘤,其中為一些壞死物質及膽固醇結晶,表面內膜呈纖維性增厚
(5) 動脈瘤形成:嚴重的粥樣斑塊底部的中膜SMC可發生不同程度的萎縮,以致逐漸不能承受血管內壓力(張力)的作用而擴張,形成動脈瘤(aneurysm)。 另外,血流可從粥瘤性潰瘍處侵入主動脈中膜,或中膜內血管破裂出血,均可造成中膜撕裂,形成夾層動脈瘤(aneurysma dissecans)。
| 關於「病理學/動脈粥樣硬化病理變化」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |