生理學/激素作用的機制
| 醫學電子書 >> 《生理學》 >> 內分泌 >> 內分泌概述 >> 激素作用的機制 |
| 生理學 |
|
|
激素作為信息物質與靶細胞上的受體結合後,如何把信息傳遞到細胞內,並經過怎樣的錯綜複雜的反應過程,最終產生細胞生物效應的機制,一直是內分泌學基礎理論研究的重要領域。近一二十年來,隨著分子生物學的發展,關於激素作用機制的研究,獲得了迅速進展,不斷豐富與完善了關於激素作用機制的理論學說。激素按其化學性質分為兩在類棗含氮激素和類固醇激素,這兩類激素有作用機制也完全不同,現分別敘述。
(一)含氮激素有作用機制棗第二信使學說
第二信使學說是Sutherland等於1965年提出來的。Sutherland學派在研究糖原酵解第一步所需限速酶棗磷酸化酶的活性時,發胰高血糖素與腎上腺素可使肝勻漿在APT、Mg2+與腺苷酸環化酶(adenylate cyclase,AC)的作用下產生一種新物質,這種物質具有激活磷酸體酶從而催化糖原酵解的作用。實驗證明,它是環-磷腺苷(cyclic AMP,cAMP),在Mg2+存在的條件下,腺苷酸化酶促進ATPA轉變為cAMP。CAMP在磷酸二酯酶(phosphodiesterase)的作用下,降解為5ˊAMP。隨後,進一步發現cAMP之所以能激活磷酸化酶,是由於cAMP激活了另一種酶,即依賴cAMP的蛋白激酶(cAMP-dependent protein kinase,cAMP-PK,PKA)而完成的。
Sutherland綜合這些資料提出第二信使學說,其主要內容包括:①激素是第一信使,它可與靶細胞膜上具有立體構型的專一性受體結合;②激素與受體結合後,激活漠上的腺苷酸環化酶系統;③在mg2+楔存在的條件下,腺苷酸環化酶促使ATP轉變為cAMP,cAMP是第二信使,信息由第一信使傳遞給第二信使;④cAMP是使無活性的蛋白激酶(PKA)激活。PKA具有兩個亞單位,即調節亞單位與催化亞單位。CAMP與PKA的調節亞單位結合,導致調節亞單位與催化亞脫離而使PKA激活,催化細胞內多種蛋白質發生磷酸化反應,包括一些蛋白發生磷酸化,從而引起靶細胞各種生理生化反應(圖11-2)。
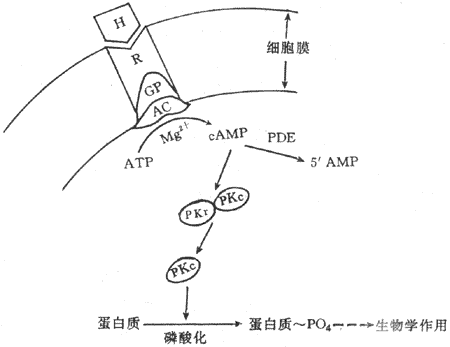
圖11-2 含氧激素作用機制示意圖
H:激素 R:受體 GP:G蛋白 AC:腺苷酸環化酶PDE:磷酸 二酯酶
RKr :蛋白激酶調節亞單位 PKc:蛋白激酶催化亞單位
以cAMP為第二信使學說的指出,推動了激素作用機制的研究工作迅速深入發展。近年來的研究資料表明,cAMP並不是唯一的第二信使,可能作為第二信使的化學物質還有cGMP、三磷酸肌醇、二醯甘油、Ca2+等。另外,關於細胞表現受體調節、腺苷酸環化酶活化機制、蛋白激酶C的作用等方面的研究都取得了很大進展,現概述如下:
1.激素與受體的相互作用 激素有膜受體多為糖蛋白,其結構一般分為三部分:細胞膜外區段、質膜部分和細胞膜內區段。細胞膜外區段含有許多糖基,是識別激素並與之結合的部位。激素分子和靶細胞受體的表現,均由許多不對稱的功能基團構成極為複雜而又可變的立體構型。激素和受體可以相互誘導而改變本身的構型以適應對方的構型,這就為激素與受體發生專一性結合提供了物質基礎。
激素與受體的結合力稱為親和力(affinity)。一般來說,由於相互結合是激素作用的第一步,所以親和力與激素的生物學作用往往一致,但激素的類似物可與受體結合而不表現激素的作用,相反卻阻斷激素與受體相結合。實驗證明,親和力可以隨生理條件的變化而發生改變,如動物性周期的不同階段,卵巢顆粒細胞上的的卵泡刺激素(FSH)受體的親和力是不相同的。某一激素與受體結合時,其鄰近受體的親和力也可出現增高或降低的現象。
受體除表現親和力改變外,其數量也可發生變化。有人用淋巴細胞膜上胰島素受體進行觀察發現,如長期使用大劑量的胰島素,將出現胰島素受體數量減少,親和力也降低;當把胰島素的量降低後,受體的數量和親和力可恢復正常。許多種激素(如促甲狀腺激素、絨毛膜促性腺激素、黃體生成素、卵泡刺激素等)都會出現上述情況。這種激素使其特異性受體數量減少的現象,稱為減衰調節或簡稱下調(down regulation0)。下調發生的機制可能與激素-受體複合物內移入胞有關。相反,有些激素(多在劑量較小時)也可使其特異性受體數量增多,稱為上增調節或簡稱上調(up regulation),如催乳素、卵泡刺激素、血管緊張素等都可以出現上調現象。下調或上調現象說明,受體或上調現象說明,受體的合成與降解處於動態平衡之中,其數量是這一平衡的結果,它的多少與激素有量相適應,以調節靶細胞對激素有敏感性與反應強度。
2.G蛋白在信息傳遞中的作用激素受體與腺苷酸環化酶是細胞膜上兩類分開的蛋白質。激素受體結合的部分在細胞膜的外表面,而腺苷環化酶在膜的胞漿面,在兩者之間存在一種起耦聯作用的調節蛋白——鳥苷酸結合蛋白(guanine nucleotide-bindingregulatory protein),簡稱G蛋白。G蛋白由α、β和γ三個亞單位組成,α亞單位上有鳥苷酸結合位點。當G蛋白上結合的鳥苷酸為GTP時則激活而發揮作用,但當G蛋白上的GTP水解為GDPA時則失去活性。當激素與受體結合時,活化的受體便與G蛋白的α亞單位結合,並促使其與β、γ亞單位脫離,才能對腺苷酸環化酶起激活或抑制作用。
G蛋白可分為興奮型G蛋白(Gs)和抑制型G蛋白 Gi。Gs的作用是激活腺苷酸環化酶,從而使cAMP生成增多;Gi的作用則是抑制腺苷酸環化酶的活性,使cAMP生成減少。有人提出,細胞膜的激素受體也可分為興奮型(Rs)與抑制型(Ri)兩種,它們分別與興奮性激素(Hs)或抑制性激素(Hi)發生結合,隨後分別啟動Gs或Gi,再通過激活或抑制腺苷酸環化酶使cAMP增加或減少而發揮作用。
3.三磷酸肌醇和二醯甘油為第二信使的信息傳遞系統許多含氮激素是以cAMP為第二信使調節細胞功能活動的,但有些含氮激素的作用信息並不以cAMP為媒介進行傳遞,如胰島素、催產素、催乳素、某些下丘腦調節肽和生長因子等。實驗證明,這些激素作用於膜受體後,往往引起細胞膜磷脂醯肌醇轉變成為三磷酸肌醇(inositol-1,4,5,triphosphate,IP3)和二醯甘油(diacylglycerol,DG),並導致胞漿中Ca2+濃度增高。近年來,有人提出IP3和DG可能是第二信使的學說引起人們的重視,並且得到越來越我的實驗證實。這一學說認為,在激素的作用下,可能通過G蛋白的介導,激活細胞膜內的磷脂酶C(phosphinositol-specificphospholipase C.PLC),它使由磷脂醯肌醇(PI)二次磷酸化生成的磷脂醯二磷肌醇(PIP2)分解,生成IP3和DG。DG生成後仍留在膜中,IP3則進入胞漿。在未受到激素作用時,細胞膜幾乎不存在游離的DG,細胞內IP3的含量也極微,只有在細胞3受到相應激素作用時,才加速PIP2的降解,大量產生IP3和DG。IP3的作用是促使細胞內Ca2+貯存庫釋放Ca2+進入胞漿。細胞內Ca2+主要貯存在粒線體與內質網中。實驗證明,IP3引起Ca2+的釋放是來自內質網而不是粒線體,因為在內質網膜上有IP3受體,IP3與其特異性受體結合後,激活Ca2+通道,使Ca2+從內質網中進入胞漿。IP3誘發Ca2+動員最初發反應是引起暫短的內質網釋放Ca2+,隨後是由Ca2+釋放誘發作用較長的細胞外Ca2+內流,導致胞漿中Ca2+濃度增加。Ca2+與細胞內的鈣調蛋白(calmodulin,CaM)結合後,可激活蛋白酶,促進蛋白質磷酸化,從而調節細胞的功能活動。
DG的作用主要是它能特異性激活蛋白激酶C(protein kinase C,PKC)PKC的激活依賴於Ca2+的存在。激活的PKC與PKA一樣可使多種蛋白質或酶發生磷酸化反應,進而調節細胞的生物效應。另外,DG的降解產物花生四烯酸是合成前列腺素的原料,花生四烯酸與前列腺素的過氧化物又參與鳥苷酸環化酶的激活,促進cGMP的生成。CGMP作為另一種可能的第二信使,通過激活蛋白激酶G(PKG)而改變細胞的功能(圖11-3)。
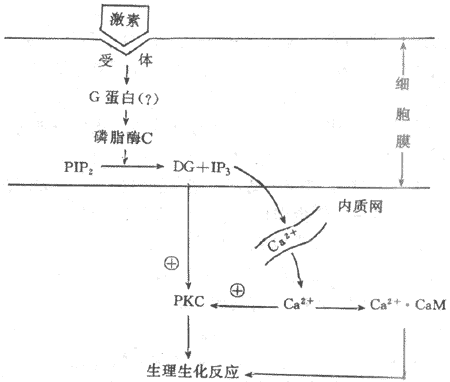
圖11-3 磷脂醯肌醇信息傳遞系統示意圖
PIP2:磷脂醯二磷肌醇 DG:二醯甘油 IP3:三磷酸肌醇PKC:蛋白激酶C CaM:鈣調蛋白
(二)類固醇激素作用機制棗基因表達學說
因固醇激素的分子小(分子量僅為300左右)、呈脂溶性,因此可透過細胞膜進入細胞。在進入細胞之後,經過兩個步驟影響基因表面而發揮作用,故把此種作用機制稱為二步作用原理,或稱為基因表達學說。
第一步是激素與胞漿受體結合,形成激素-胞漿受體複合物。在靶細胞將中存在著類固醇激素受體,它們是蛋白質,與相應激素結合特點是專一性強、親和性大。例如,子宮組織胞漿的雌二醇受體能與17β-雌二醇結合,而不能與17α-雌二醇結合。激素與受體的親和性大小與激素的作用強度是平行的。而且胞漿受體的含量也隨靶器官的功能狀態的變化而發生改變。當激素進入細胞內與胞漿受體結合後,受體蛋白發生構型變化,從而命名激素-胞漿受體複合物獲得進入核內的能力,由胞漿轉移至核內。第二步是與核內受體相互結合,形成激素-核受體複合物,從而激發DNA的轉錄過程,生成新的mRNA,誘導蛋白質合成,引起相應的生物效應(圖11-4)。
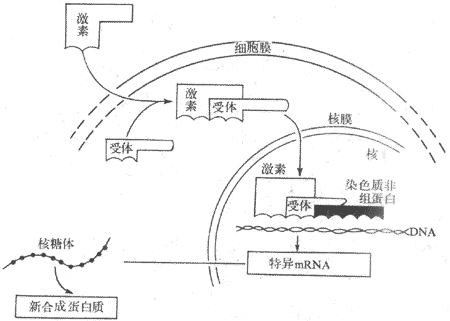
圖11-4 類固醇激素作用機制示意圖
近年來由於基因工程技術的發展與應用,不少類固醇激素的核內受體的結構已經清楚。它們是特異地對轉錄起調節作用的蛋白,其活性受因固醇激素的控制。核受體主要有三個功能結構域:激素結合結構域、DNAA結構結構域和轉錄增強結構域。一旦激素與受體結合,受體的分子構象發生改變,暴露出隱蔽於分子內部的DNA結合結構域及轉錄增強結構域,使受體DNA結合,從而產生增強轉錄的效應。另外,政治家實驗資料表明,在DNA結合結構域可能有一個特異序列的胺基酸片斷,它起著介導激素受體複合物與染色質中特定的部位相結合,發揮核定位信號的作用。
甲狀腺激素雖屬含氮激素,但其作用機制卻與類固醇激素相似,它可進入細胞內,但不經過與胞漿受體結合即進入核內,與核受體結合調節基因表達。
應該指出,含氮激素可作用於轉錄與翻譯階段而影響蛋白質的合成;反過來,類固醇激素也可以作用於細胞膜引起基因表達學說難以解釋的某引起現象。
| 關於「生理學/激素作用的機制」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |