臨床生物化學/核酸雜交技術
| 醫學電子書 >> 《臨床生物化學》 >> 診斷分子生物學基本技術 >> 分子生物學實驗診斷技術 >> 核酸雜交技術 |
| 臨床生物化學 |
|
|
檢驗方法建立的基本要素是特異性和靈敏度,在複雜的物體中,使無法感覺的特定物質進入人類的觀察範圍。核酸雜交檢測技術就是利用核酸鹼基嚴格配對的特異性,核酸標記物的靈敏度而建立的檢測核酸結構與功能的方法。該法建立以來已有二十年,目前研究實驗室用得多,臨床實驗室用得較少,除成本高外,關鍵是操作複雜,重複性差,僅能半定量。成本高可隨經濟發展而緩和,但其它缺點尚需努力克服。
雜交實驗的探針應具有特異性,對應不同的雜交方法靶基因(被檢基因)應有一定的純度與丰度。雜交反應的開始是碰撞,探針濃度高則速率增加,一般32P標記探記探針5-100ng/ml,非放射性探針25-1000ng/ml,原位雜交無論放射還是非放射物標記,一般都需0.1-5.0μg/ml。當探針過量時,雜交速率取決於探針長度,如一個100ng/ml20個核苷酸的合成寡核苷酸探針與1-100pg 1kb長的靶基因雜交,10分鐘能達到最大雜交率。而相同條件下2kb的克隆探針需160小時。主要原因是這裡所指濃度是重量濃度而非摩爾濃度。長探針因標記量大,小的摩爾濃度已足以達到需要的檢測靈敏度。為了促進長探針(>250個核苷酸)的雜交速率,加入雜交促進劑是非常必要的。最常用的是硫酸葡聚糖,使用濃度為5%-10%,濃度過高會增加雜交液粘度。聚乙二醇也作為促進劑,價廉且粘度低,但檢測本底太高。另外雜交的溫度、鹽濃度、甲醯胺濃度可調節雜交分子形成的穩定性。理論選用DNA:DNA雜交溫度T=Tm-25℃,此時雜交分子最易形成。但具體實驗中影響Tm值的因素很多,一般雜交溫度低,形成的雜交分子較穩定。RNA:DNA雜交分子的Tm大10-15℃,RNA:RNA雜交分子的Tm大20-25℃,使得雜交溫度提高,此時需調節甲醯胺濃度來調節雜交溫度。好的實驗條件最終應在實踐中摸索建立。
(一)斑點雜交
將少量核酸樣品點樣在硝酸纖維素濾膜上,80℃烘烤後可牢固地固定在膜上,再用探針進行雜交。尼龍膜,特別是聚偏氟乙烯膜(PVDF)與DNA結合力更高,堅韌、易操作。點樣可手工,也可用真空點樣品。檢測可用放射性探針自顯影或非放射性探針顯色。可用於DNA或RNA分析。下面以非放射性探針分析DNA為例,結果是顯色。
取硝酸纖維素膜和濾紙在2xSSC(NaCl 300mmol/L,檸檬酸鈉30mmol/L),pH7.0浸15分鐘,平鋪濾紙在點樣抽濾器上,再鋪上硝酸纖維濾膜,真空抽氣使點樣器減壓,膜顯出凹面。點樣50μl(5-10μgDNA,可直接點血清樣品)於凹面,撤去真空,把膜晾乾。取濾紙浸0.5mol/l NaOH,1.0mol/l NaCl,把膜平鋪於濾紙上20分鐘,變性。取濾紙二張分別浸在0.5mol/l Tris-Hcl pH7.5和1.0mol/l Tris-HCl,0.6mol/l NaCl pH7.5,分別依次把膜平鋪於濾紙上,各中和15分鐘,中和後膜的pH為7.2-7.5。於80℃,30-45分鐘烘乾。(RNA分析點樣緩衝液系統不同,無需變性,中和,余大致相同)用塑料封口機把膜和2.5ml預雜交緩衝液封入塑料袋中,42℃,水浴30分鐘。
| 預雜交緩衝液: | 65℃6xSSC | (原液:20xSSPE) |
| 5xDenhardt | (50xDenhardt) | |
| 0.5%SDS | (10%SDS) | |
| 100μg/ml變性鮭精DNA片段 | (1mg/ml) | |
| 42℃增加50%甲醯胺 | (原液),配成20ml. |
50xDenhardt:5g聚蔗糖(Ficoll,400型,Parmacia),5g聚乙烯吡咯烷酮和5g牛血清白蛋白(組份Ⅴ,Sigma)加水至500ml。過濾後-20℃保存。
探針2ml(50-100ng/2ml預雜交緩衝液)於100℃,10分鐘,馬上置冰浴5分鐘(變性)。加入袋封口。42℃水浴過夜。去雜交液(可回收)。以2xSSC,0.1%SDS15ml,50℃5分鐘洗二次。0.1SSC,0.1%SDS洗二次。封閉:另取袋封入膜和封閉液(蛋白質50mg/ml,100mmol/l Tris-HCl(pH7.5)/150mmol/LNaCl)2.5ml,37℃,30分鐘。去封閉液(可回收)。100mmol/lTris-HCl(pH7.5)/150mmol/L NaCl ,15ml,5分鐘洗二次。親和反應:酶標抗體3ml(酶有鹼性磷酸酶、過氧化物酶等,標記物有抗地高辛、生物素等,現以地高辛標鹼性磷酸酶為例4μg/3ml 100mmol/L Tris-HCl,150mmol/l MgCl2,10mg/ml牛血清白蛋白),封入袋中37℃,30分鐘。100mmol/l Tris-Hcl,100mmol/l NaCl,50mmol/l MgCl2,pH9.5,10ml,1分鐘洗一次。取硝基四氮唑蘭(NBT)75mg/ml 70%二甲基甲醯胺25μl,4-溴-5-氯-3-吲哚磷酸50mg/ml二甲基甲醯胺20μl(底物)和100mmol/l Tris-HCl,100mmol/l NaCl,50mmol/l MgCl2,pH9.56ml混勻,37℃,避光反應三小時,顯色。蒸餾水洗膜,晾乾。觀察結果。
(二)Southern blot
1975年E.Southern發明了將DNA切開,電泳分離,再變性,印跡到硝酸纖維(Nc)濾膜上,用探針進行雜交,檢測DNA的方法。自顯影或顯色用於DNA分析。以32P標記放射性探針為例,放射自顯影觀察結果。(圖18-6)。
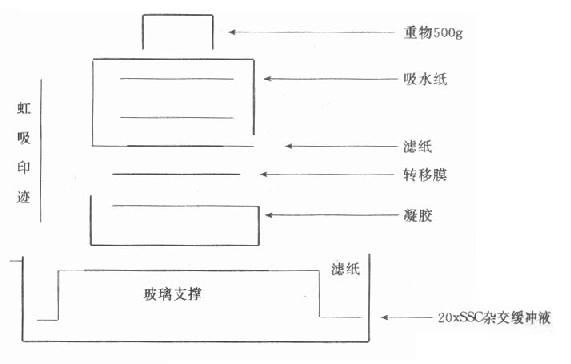
圖18-6 Southernblot體系
前述分離、純化的DNA樣品5-10μg/100μlTE,加限制性內切酶3Unit/1μgDNA和內切酶相應緩衝液,在相應溫度保溫1-3小時(不同的酶所用的緩衝液和溫度不同),乙醇沉澱,15-20μl TE溶解DNA斷片。前述電泳條件,與DNA分子量標準品(Marker,Ladder)一起,3-4V/cm電泳(30V12-15小時)。在紫外光下觀察Marker充分分離,結束電泳。將膠放入0.5mol/l NaCl,0.5mol/L NaOH液體中30分鐘,使DNA變性。同時將膜用蒸餾水浸潤,在0.5mol/L NaCl,0.5mol/L NaOH液體的方盤皿上,放上濾紙兩頭浸在液體中,依次放上凝膠、膜、濾紙、一尺厚的吸水紙,壓力1kg的重物。轉移(印跡,blot)過夜。翌日,把膜放在0.5mol/l Tris-HCl,pH7.0-7.5,1mol/L NaCl液中,中和膜上鹼性變性液15-30分鐘。戴上手套,用手指壓在膜上來回充分洗膜。室溫乾燥一小時。用塑料封口機,把膜和預雜交緩衝液封在塑料口袋中,注意驅除袋內汽泡。熱水浴過夜。探針變性後,加入袋中再封口。熱水浴過夜。
| 洗膜: | 2xSSPE,0.5%SDS,總體積200ml,室溫30分鐘。 |
| 0.4%xSSPE,0.5%SDS,總體積200ml,60℃,30分鐘。 | |
| 將膜包入塑料袋,在暗室貼在X光底片上。-70℃,自顯影1-2天。 | |
| 沖片顯影,觀察結果(背景不清晰可重新洗膜再顯影)。 |
(三)Northern blot
用於RNA分析,電泳條件與轉膜方法與Southern blot不同外,RNA不必變性與中和,電泳時加電醛防止RNA髮夾結構形成。其它步驟相同。
為了防止RNase水解需分析的mRNA,儘可能將器皿在160-180℃乾熱滅菌8小時以上,也可加0.1%焦碳酸二乙酯(DEPC)泡2小時,滅菌水淋洗乾淨,100℃干烤15分鐘。不能幹熱滅菌的試劑等,也可加1%DEPC處理12小時(但不能用於Tris)後,100℃。加熱15分鐘(或高壓滅菌15分鐘)以抑制、分解RNase。1.0g瓊脂糖,滅菌水80ml加熱溶解。加x50TAE2ml,EB25μl,滅菌水至1000ml。樣品緩衝液,x50TAE20μl,50%去離子甲醯胺500μl,甲醛180μl,混勻。約10-30μg/10μl純化的RNA樣品,加二倍(20μl)樣品緩衝液(可點樣一個凝膠孔lane)。60℃水浴15min,馬上置冰浴。加1/10電泳指示劑。點樣電泳,75-80V電泳4-5小時(指示劑泳動7~8cm),結束電泳。電泳期間正負極緩衝液要不斷交換(可用蠕動泵),以免pH改變。電泳結束,將凝膠放在紫外光下可觀察到人rRNA大亞基28S(5.1kb),小亞基18S(2.0kb),記下大小亞基移動距離(或拍照),可作為被測mRNA分子量分析的參照物。凝膠在50mmol/l NaOH中變性30分鐘(低濃度鹼,此步可省)。膜在10xSSPE中浸20分鐘。用10xSSPE轉移過夜(同Southern blot)。80℃1-2小時乾燥。用探針雜交後,顯影或顯色。
(四)原位雜交(insituhybridization)
在保持細胞形狀條件下,進行細胞內雜交,顯影或顯色。用於DNA或RNA分析。
細胞用離心塗片機塗片或組織切片置於載玻片上。4%多聚甲醛(PFA)/PBS固定(固定時間因標本而異10-20分鐘,也可用含2%甲醛,0.05%戊二醛,2.5mmol/lCaCl2的0.1mol/L磷酸緩衝液pH7.3,500W微波爐中照射10-20秒,固定)。馬上用PBS洗標本三次,2.5μg/ml蛋白酶K,37℃,5-20分鐘(因標本和固定條件而定)處理。磷酸鹽類緩衝液(PBs NaCl 137mmol/l,KCl 2.7mmol/L,Na2HPO48.1mmol/L,KH2PO41.5mmol/L)洗滌。4%PFA/PBS後固定,PBS洗一次,0.2%甘氨酸/PBS洗二次,每次15分鐘。預雜交:42℃,1小時。預雜交緩衝液:10%硫酸葡聚糖,10%Denhardt液,0.5%吐溫-20,250μg/ml鮭魚精子DNA,500μg/ml酵母tRNA。雜交:42℃,4小時。用2x雜交緩衝液(4xSSC,0.2mol/L磷酸鈉pH6.5,2xDenhardt)溶解已標記探針,使其終濃度為0.1-1.0μg/ml。DNA檢測時把探針覆蓋在標本上,置100℃5分鐘(變性)取出,雜交。mRNA檢測則先把探針置95℃水浴3分鐘,立即置冰水浴,再覆蓋標本上進行雜交。覆蓋標本用液量100-200μl洗滌:2xSSC,50℃過夜。0.2xSSC,室溫1小時。載玻片浸在緩衝液中。顯色(試劑、方法參照斑點雜交的封閉-顯色部分)20分鐘-2小時,顯微鏡下觀察結果。
| 關於「臨床生物化學/核酸雜交技術」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |