生物化學與分子生物學/呼吸鏈
| 醫學電子書 >> 《生物化學與分子生物學》 >> 生物氧化 >> 呼吸鏈 |
| 生物化學與分子生物學 |
|
|
|
呼吸鏈(respiratorychain)是由一系列的遞氫體(hydrogen transfer)和遞電子體(eletron transfer)按一定的順序排列所組成的連續反應體系,它將代謝物脫下的成對氫原子交給氧生成水,同時有ATP生成。實際上呼吸鏈的作用代表著粒線體最基本的功能,呼吸鏈中的遞氫體和遞電子體就是能傳遞氫原子或電子的載體,由於氫原子可以看作是由H+和e組成的,所以遞氫體也是遞電子體,遞氫體和遞電子體的本質是酶、輔酶、輔基或輔因子。
目錄 |
一、呼吸鏈的組成
構成呼吸鏈的遞氫體和遞電子體主要分為以下五類
(一)尼克醯胺腺嘌呤二核苷酸(NAD+)或稱輔酶I(CoI)。
為體內很多脫氫酶的輔酶,是連接作用物與呼吸鏈的重要環節,分子中除含尼克醯胺(維生素PP)外,還含有核糖、磷酸及一分子腺苷酸(AMP),其結構如下:
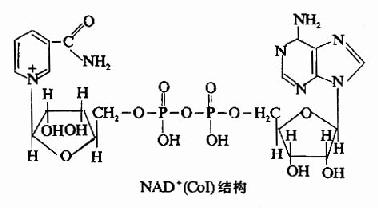
NAD+的主要功能是接受從代謝物上脫下的2H(2H++2e),然後傳給另一傳遞體黃素蛋白。
在生理pH條件下,尼克醯胺中的氮(吡啶氮)為五價的氮,它能可逆地接受電子而成為三價氮,與氮對位的碳也較活潑,能可逆地加氫還原,故可將NAD+視為遞氫體。反應時,NAD+的尼克醯胺部分可接受一個氫原子及一個電子,尚有一個質子(H+)留在介質中。
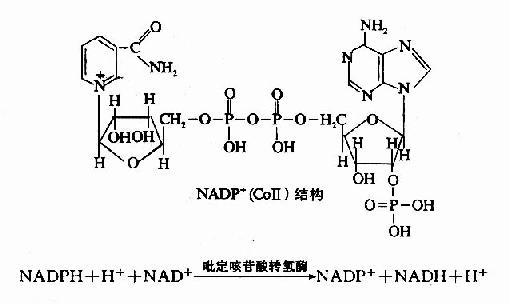
此外,亦有不少脫氫酶的輔酶為尼克醯胺腺嘌呤二核苷酸磷酸(NADP+),又稱輔酶Ⅱ(CoⅡ),它與NAD+不同之處是在腺苷酸部分中核糖的2′位碳上羥基的氫被磷酸基取代而成。
當此類酶催化代謝物脫氫後,其輔酶NADP+接受氫而被還原生成NADPH+H+,它須經吡啶核苷酸轉氫酶(pyridine nucleotidetranshydrogenase)作用將還原當量轉移給NAD+,然後再經呼吸鏈傳遞,但NADPH+H+一般是為合成代謝或羥化反應提供氫。

(二)黃素蛋白(flavoproteins)
黃素蛋白種類很多,其輔基有兩種,一種為黃素單核苷酸(FMN),另一種為黃素腺嘌呤二核苷酸(FAD),兩者均含核黃素(維生素B2),此外FMN尚含一分子磷酸,而FAD則比FMN多含一分子腺苷酸(AMP),其結構如下:
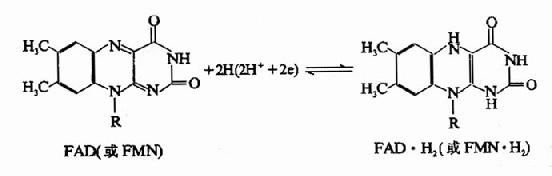
在FAD、FMN分子中的異咯嗪部分可以進行可逆的脫氫加氫反應。
FAD或FMN與酶蛋白部分之間是通過非共價鍵相連,但結合牢固,因此氧化與還原(即電子的失與得)都在同一個酶蛋白上進行,故黃素核苷酸的氧化還原電位取決於和它們結合的蛋白質,所以有關的標準還原電位指的是特定的黃素蛋白,而不是游離的FMN或FAD;在電子轉移反應中它們只是在黃素蛋白的活性中心部分,而其本身不能作為作用物或產物,這和NAD+不同,NAD+與酶蛋白結合疏鬆,當與某酶蛋白結合時可以從代謝物接受氫,而被還原為NADH,後者可以游離,再與另一種酶蛋白結合,釋放氫後又被氧化為NAD+。
多數黃素蛋白參與呼吸鏈組成,與電子轉移有關,如NADH脫氫酶(NADh dehydrogenase)以FMN為輔基,是呼吸鏈的組分,介於NADH與其它電子傳遞體之間;琥珀酸脫氫酶,粒線體內的甘油磷酸脫氫酶(glycerol phosphate dehydrogenase)的輔基為FAD,它們可直接從作用物轉移還原當量H++e reducing equivalent)到呼吸鏈,此外脂肪醯CoA脫氫酶與琥珀酸脫氫酶相似,亦屬於FAD為輔基的黃素蛋白類,也能將還原當量從作用物傳遞進入呼吸鏈,但中間尚需另一電子傳遞體稱為電子轉移黃素蛋白(electrontransferring flavoprotein,ETFP,輔基為FAD)參與才能完成。
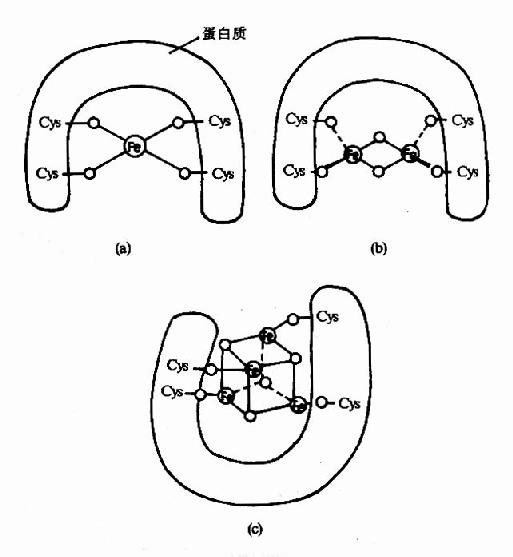
(三)鐵硫蛋白(ironsulfur proteins,Fe-S)
又稱鐵硫中心,其特點是含鐵原子。鐵是與無機硫原子或是蛋白質肽鏈上半胱氨酸殘基的硫相結合,常見的鐵硫蛋白有三種組合方式(a)單個鐵原子與4個半胱氨酸殘基上的巰基硫相連。(b)兩個鐵原子、兩個無機硫原子組成(2Fe-2S),其中每個鐵原子還各與兩個半胱氨酸殘基的巰基硫相結合。(c)由4個鐵原子與4個無機硫原子相連(4Fe4S),鐵與硫相間排列在一個正六面體的8個頂角端;此外4個鐵原子還各與一個半胱氨酸殘基上的巰基硫相連(圖6-1)。
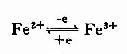
圖6-1 鐵硫蛋白結構
(a)單個鐵與半胱氨酸硫相連 (b)2Fe-2S (c)4Fe-4S
鐵硫蛋白中的鐵可以呈兩價(還原型),也可呈三價(氧化型),由於鐵的氧化、還原而達到傳遞電子作用。
在呼吸鏈中它多與黃素蛋白或細胞色素b結合存在。
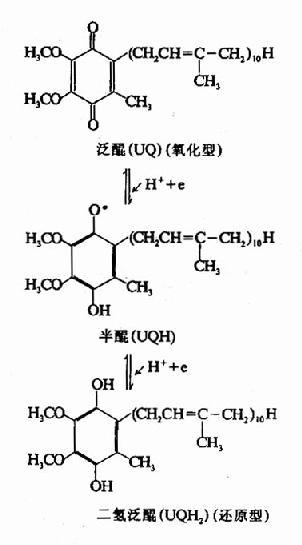
(四)泛醌(ubiquinone,UQ或Q)
亦稱輔酶Q(coenzymeQ),為一脂溶性苯醌,帶有一很長的側鏈,是由多個異戊二烯(isoprene)單位構成的,不同來源的泛醌其異戊二烯單位的數目不同,在哺乳類動物組織中最多見的泛醌其側鏈由10個異戊二烯單位組成。
泛醌接受一個電子和一個質子還原成半醌,再接受一個電子和質子則還原成二氫泛醌,後者又可脫去電子和質子而被氧化恢復為泛醌。
(五)細胞色素體系
1926年Keilin首次使用分光鏡觀察昆蟲飛翔肌振動時,發現有特殊的吸收光譜,因此把細胞內的吸光物質定名為細胞色素。細胞色素是一類含有鐵卟啉輔基的色蛋白,屬於遞電子體。粒線體內膜中有細胞色素b、c1、c、aa3,肝、腎等組織的微粒體中有細胞色素P450。細胞色素b、c1、c為紅色細胞素,細胞色素aa3為綠色細胞素。不同的細胞色素具有不同的吸收光譜,不但其酶蛋白結構不同,輔基的結構也有一些差異。
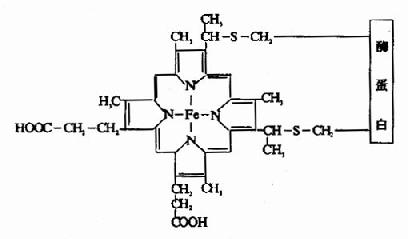
細胞色素c為一外周蛋白,位於粒線體內膜的外側。細胞色素C比較容易分離提純,其結構已清楚。哺乳動物的Cyt c由104個胺基酸殘基組成,並從進化的角度作了許多研究。Cyt c的輔基血紅素(亞鐵原卟啉)通過共價鍵(硫醚鍵)與酶蛋白相連(見圖6-2),其餘各種細胞色素中輔基與酶蛋白均通過非共價鍵結合。
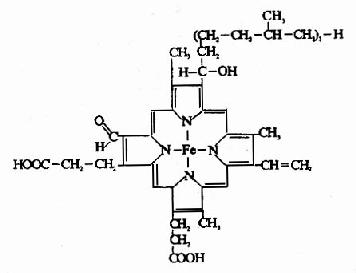
圖6-2 細胞色素C的輔基與酶蛋白的聯接方式
細胞色素a和a3不易分開,統稱為細胞色素aa3。和細胞色素P450、b、c1、c不同,細胞色素aa3的輔基不是血紅素,而是血紅素A(見圖6?)。細胞色素aa3可將電子直接傳遞給氧,因此又稱為細胞色素氧化酶。
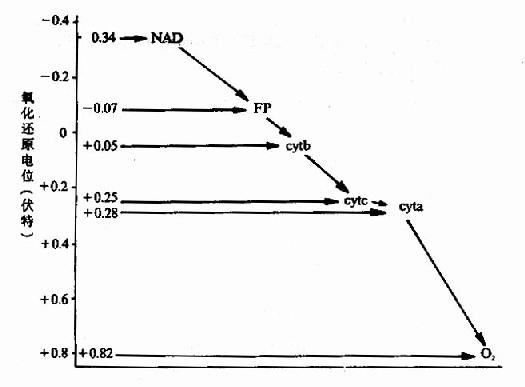
圖6-3 血紅素A結構式
鐵卟啉輔基所含Fe2+可有Fe2+←→Fe3++e的互變,因此起到傳遞電子的作用。鐵原子可以和酶蛋白及卟啉環形成6個配位鍵。細胞色素aa3和P450輔基中的鐵原子只形成5個配位鍵,還能與氧再形成一個配位鍵,將電子直接傳遞給氧,也可與CO、氰化物、H2S或疊氮化合物形成一個配位鍵。細胞色素aa3與氰化物結合就阻斷了整個呼吸鏈的電子傳遞,引起氰化物中毒。
二、呼吸鏈中各種傳遞體的排列順序
(一)確定排列順序的方法
1.標準氧化還原電位的數值表示氧化還原能力的大小,標準氧化還原電位負值越大,其還原性越強,容易被氧化;標準氧化還原電位正值越大,其氧化性越強,容易被還原。因此呼吸鏈中各種組分的排列順序應當由低電位依次向高電位排列(圖-4)。
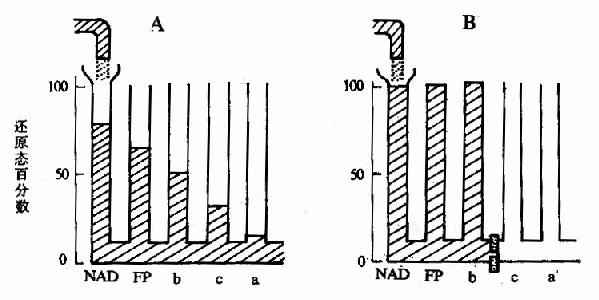
圖6-4 各種傳遞體的標準氧化還原電位
2.還原程度來確定。Chance和Williams使用分光光度法測定離體的粒線體在有氧條件下三羧酸循環反應達到平衡時,呼吸鏈中各種傳遞體的還原程度。反應達到平衡時從底物一側到氧一側的各種傳遞體的還原程度應當是遞減的,底物的一側最高,氧一側最低,如下表中數據所示。
表6-1 有氧動態平衡時電子傳遞體的還原程度
| 傳遞體 | NAD | FP | Cyt b | Cyt c | Cty aa3 |
| 還原型% | 53 | 20 | 16 | 6 | 1 |
FP:黃素蛋白
這種情況好象物理學上的聯通管,圖6?A中,若進水量等於出水量,即流量達到平衡時,離進水口最近的水管中水位最高,離出水管最近的水管中水位最低,從進水管到出水管水位逐漸減低,若把水流視為電子流,就是上述實驗中的情況。
3.使用特異的抑制劑 特異的抑制劑能阻斷呼吸鏈中的特定環節,阻斷部位的底物一側的各種傳遞體應為還原型,阻斷部位的氧一側的各種傳遞體應為氧化型,正象我們阻斷聯通管的底部一樣,阻斷部位以前的各水管中水是滿的,而阻斷部位以後的各水管中水均流光(見圖6-5,B)。
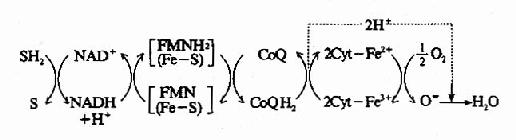
圖6-5 有氧氧化穩定時各種傳遞體的還原太分數
A.不加抑制劑 B.加入抗霉A阻斷
複合物Ⅰ:催化NADH氧化、CoQ還原。
複合物Ⅱ:催化琥珀酸氧化、CoQ還原
複合物Ⅲ:催化Co QH2氧化、Cyt c還原
複合物Ⅳ:催化Cyt c氧化、O2還原
表6-2 使用抗黴素A前後各種遞電子體的還原型百分數
| FP | Cyt b | Cyt c+c1 | Cty aa3 | |
| 琥珀酸 | 40 | 25 | 19 | 4 |
| 琥珀酸+抗黴素A | 100 | 100 | 0 | 0 |
從表中可以看出,FP、Cyt b位於抗黴素A阻斷部位之前,Cytc、cl、aa3位於阻斷部位之後。用不同的抑制劑作此實驗,就可以確定呼吸鏈中各種傳遞體的排列順序。
4.在體外實驗中,將粒線體分成各種複合物,檢測其各自催化的反應,再將其重組,檢測其催化能力。
美國格林(Green)等實驗室成功地將呼吸鏈分離成具有催化活性的四種複合物以及CoQ和Cytc.檢測各個複合物的功能發現:
可以看出CoQ在複合物Ⅰ與Ⅲ,Ⅱ與Ⅲ之間傳遞還原當量,Cyt c在複合物Ⅲ與Ⅳ之間傳遞還原當量。他們又將這四種複合物1:1:1:1的比例混合,加上CoQ和Cyt c重組,基本上恢復了粒線體原有的催化能力。
藉助上述實驗方法,呼吸鏈各組分的排列順序已基本明確,但仍有些不一致的看法,其中以CoQ至細胞色素C這一部分研究得還很不清楚,對於Fe-S和CoQ的定位和數量也有爭議。
(二)氧化呼吸鏈
1.NADH氧化呼吸鏈 人體內大多數脫氫酶都以NAD+作輔酶,在脫氫酶催化下底物SH2脫下的氫交給NAD+生成NADH+H+,在NADH脫氫酶作用下,NADH+H+將兩個氫原子傳遞給FMN生成FMNH2,再將氫傳遞至CoQ生成CoQH2,此時兩個氫原子解離成2H++2e,2H+游離於介質中,2e經Cyt b、c1、c、aa3傳遞,最後將2e傳遞給1/2O2,生成O2-,O2與介質中游離的2H+結合生成水,綜合上述傳遞過程可用圖6-6表示。
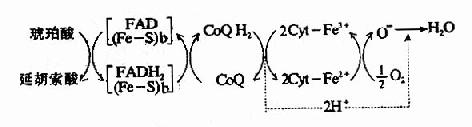
圖6-6 NADH氧化呼吸鏈
SH2:作用物;(Fe-S):鐵硫中心;Cyt:細胞色素
2.琥珀酸氧化呼吸鏈 琥珀酸在琥珀酸脫氫酶作用下脫氫生成延胡索酸,FAD接受兩個氫原子生成FADH2,然後再將氫傳遞給CoQ,生成CoQH2,此後的傳遞和NADH氧化呼吸鏈相同,整個傳遞過程可用圖6-7表示。
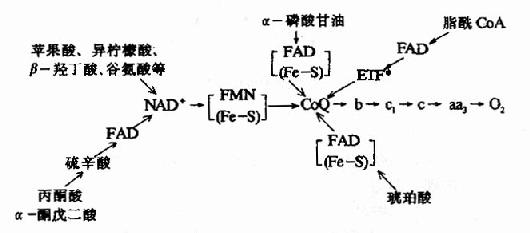
圖6-7 琥珀酸氧化呼吸鏈
(Fe-S):鐵硫中心:b:琥珀酸脫氫酶複合體的細胞色素
3.粒線體氧化呼吸鏈總結 粒線體中物質代謝會生成大量的NADH+H+和FADH2-它們可來自丙酮酸氧化脫羧、三羧酸循環、脂肪酸的β-氧化和L-谷氨酸的氧化脫氨等反應,現將某些重要底物氧化時的呼吸鏈總結於圖6-8。
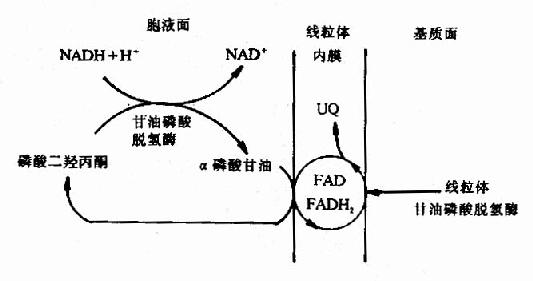
圖6-8 粒線體中某些底物氧化時的呼吸鏈
*ETF:电子传递黄素蛋白,辅基为FAD
三、胞漿中NADH的轉移
體內很多物質氧化分解產生NADH,反應發生在粒線體內,則產生的NADH可直接通過呼吸鏈進行氧化磷酸化,但亦有不少反應是在粒線體外進行的,如3-磷酸甘油醛脫氫反應,乳酸脫氫反應及胺基酸聯合脫氨基反應等等。由於所產生的NADH存在於粒線體外,而真核細胞中,NADH不能自由通過粒線體內膜,因此,必須藉助某些能自由通過粒線體內膜的物質才能被轉入粒線體,這就是所謂穿梭機制,體內主要有兩種穿梭機制。
1.α磷酸甘油穿梭(glycerolα-phosphateshuttle)
該穿梭機制主要在腦及骨骼肌中,它是藉助於α-磷酸甘油與磷酸二羥丙酮之間的氧化還原轉移還原當量,使粒線體外來自NADH的還原當量進入粒線體的呼吸鏈氧化,具體過程如圖6-9。
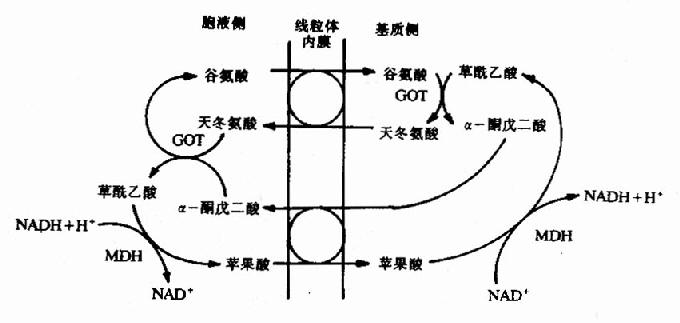
圖6-9 α磷酸甘油穿
當胞液中NADH濃度升高時,胞液中的磷酸二羥丙酮首先被NADH還原成α磷酸甘油(3-磷酸甘油),反應由甘油磷酸脫氫酶(輔酶為NAD+)催化,生成的α磷酸甘油可再經位於粒線體內膜近外側部的甘油磷酸脫氫酶催化氧化生成磷酸二羥丙酮。粒線體與胞液中的甘油磷酸脫氫酶為同工酶,兩者不同在於粒線體內的酶是以FAD為輔基的脫氫酶,而不是NADH+,FAD所接受的質子、電子可直接經泛醌、複合體Ⅲ、Ⅳ傳遞到氧,這樣粒線體外的還原當量就被轉運到粒線體氧化了,但通過這種穿梭機制果只能生成2分子ATP而不是3分子ATP。
2.蘋果酸,天冬氨酸穿梭(malate aspartate shuttle):
這種穿梭機制主要在肝、腎、心中發揮作用,其穿梭機制比較複雜,不僅需藉助蘋果酸、草酸乙酸的氧化還原,而且還要藉助α酮酸與胺基酸之間的轉換,才能使胞液中來的NADH的還原當量轉移進入粒線體氧化,具體過程如圖6-10。
![]() 天冬氨酸穿梭"/>
天冬氨酸穿梭"/>
圖6-10 蘋果酸天冬氨酸穿梭
GOT:穀草轉氨酸;MDH:蘋果酸脫氫酶
當胞液中NADH濃度升高時,首先還原草醯乙酸成為蘋果酸,此反應由蘋果酸脫氫酶催化,胞液中增多的蘋果酸可通過內膜上的二羧酸載體系統與粒線體內的α酮戊二酸交換;進入粒線體的蘋果酸,經蘋果酸脫氫酶催化又氧化生成草醯乙酸並釋出NADH,還原當量從複合體I進入呼吸鏈經CoQ、複合體Ⅲ、Ⅳ傳遞,最image/005061360後給氧,所以仍可產生3分子ATP,與在粒線體內產生的NADH氧化相同。與此同時粒線體內的α酮戊二酸由於與蘋果酸交換而減少,需要補充,於是在轉氨酶作用下由谷氨酸與草醯乙酸進行轉氨基反應,生成α酮戊二酸和天冬氨酸,天冬氨酸借粒線體膜上的谷氨酸天冬氨酸載體轉移系統與胞液的谷氨酸交換,從而補充了粒線體內谷氨酸由於轉氨基作用而造成的損失,進入胞液的天冬氨酸再與胞液中α酮戊二酸進行轉氨基,重新又產生草醯乙酸以補充最初的消耗,從而完成整個穿梭過程。
參看
| 關於「生物化學與分子生物學/呼吸鏈」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |