臨床生物化學/底物、輔因子、活化劑、變構劑的種類和濃度
| 醫學電子書 >> 《臨床生物化學》 >> 血清酶定量的檢測技術 >> 酶活性測定條件的選擇和限定 >> 底物、輔因子、活化劑、變構劑的種類和濃度 |
| 臨床生物化學 |
|
|
|
這一項包括幾種因子,其中最重要的是底物種類和濃度,這是每種測酶活性濃度方法中首先需要選擇的項目,選擇恰當與否,對該酶測定至關重要。後面幾項則不是每種酶測定都會遇到的選擇。
(一)選合適的底物種類和濃度
如所測的酶專一性不強,可作用於多種底物,首先就需決定選擇哪一類底物作為測此酶的底物。如該項酶測定主要用於臨床診療工作,則首先應考慮選有較高診斷價值的底物。例如臨床上測定酸性磷酸酶主要用於診斷前列腺癌,所選的底物應對前列腺酸性磷酸酶有較高的特異性。不易被其它組織如紅細胞、血小板中酸性磷酸酶所作用,在常用的底物中以麝香草酚磷酸鹽最符合上述選擇條件。但如進行酶基礎研究,探討其在體內作用時,則選擇酶在體內的生理底物更為合適,一般而言在多種底物中,Km最小的底物往往是此酶的生理底物。
選擇Km小的底物測定酶還有一個優點,就是在最大反應速度V的底物濃度也將最低。在實際工作中可能意味著試劑成本可能較低,不易出現底物難溶解的困難。
底物專一性強的酶雖然不面臨上述選擇,但只要所測酶催化的是可逆反應,則和專一性不強酶一樣,都面臨著是選擇正向還是逆向反應來測定酶,不同反應方向的底物必然是不一樣的。這方面的選擇更多從技術和實用方面加以考慮往往選擇速度較快的方向,因為這可以提高測定的靈敏度,如測定肌酸激酶(CK),由於磷酸肌酸價格昂貴且不穩定,早期多選用正向反應,底物為肌酸和ATP速度太慢,只是逆向反應的1/6,測定靈敏度太低,以致正常標本結果誤差很大。近年來都改用逆向反應測定CK,明顯提高CK測定的精密度和準確度。在此問題上,實用考慮也起了不小作用。例如測定乳酸脫氫酶(LD)時,如考慮到正向反應明顯快於逆向反應,則應考慮以丙酮酸和NADH為底物,這正是IFCC和其它一些學會推薦的方法。但目前市售的測LD的試劑盒不少都以乳酸和NAD+為底物。因為NAD+價格明顯低於NADH,並且穩定可長期儲存。科研工作中如需測LD,還是最好採用IFCC的方法。
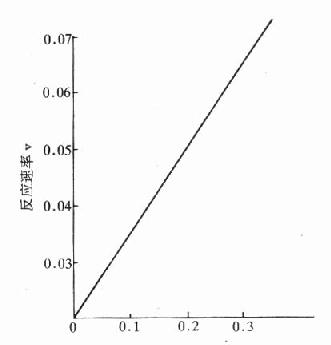
確定底物種類後,重要的問題是選擇底物的合適濃度,在討論此問題之前,有必要先簡單複習一下底物濃度和酶反應速度之間的關係,因其不同於其它化學反應有其獨特之處,圖17-2很形象表示出這種差異。
反應物濃度[S]
圖17-2a 反應物濃度對化學反應的影響
底物濃度[S]
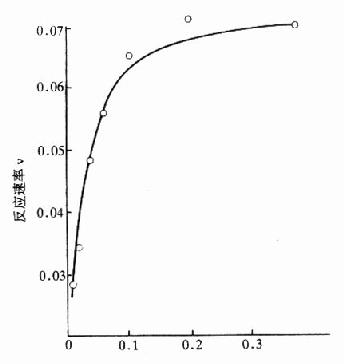
圖17-2b 底物濃度對酶反應的影響
圖a表示在一般化學反應中遵循質量作用定律,反應速度隨反應物質濃度增加成正比例增加,圖b則表示酶反應中底物濃度對反應速度的影響,當底物濃度很低時,酶反應速度幾乎隨底物增加成正比例加快,進一步升高底物濃度,雖然反應速度也加快,但增加速度愈來愈慢,不成比例。到一定程度,反應速度趨於恆定為一常數,實際上就是趨向最大反應速度V,測定此處的反應速度V,最能準確地反映酶量多少。在此處底物濃度變化,對反應速度影響很小。
Michaclis和Menten二式首先在本世紀初對酶反應的此項獨特現象從理論上加以合理解釋。並推導出著名的米-門方程式:
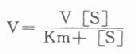
此公式對選擇酶測定的底物濃度有重要的指導作用。Km對每一種酶而言在一定條件下為一常數,並可從上述方程式求出,在反應速度為最大反應速度V一半時,代入上式得:
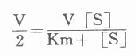
Vkm+V[S]=2V[S]
VKm=V[S]
[S]=Km
換言之,當酶促反應速度為最大反應速度一半時,此時的底物就相當於酶的米氏常數Km。以mol/L表示之,大多數酶Km在10-3至10-5mol/L之間。
當我們知道或計算出某一酶的Km後就可以計算出不同底物濃度和Km間的比值,化入米-門方程式就可計算出此時酶促反應速度相當於最大反應速度的百分比,見表:17-3
表17-3 底物濃度與Km比值相當的最大反應百分比
| [S]/Km | V/V×100 |
| 100.0 | 99.0 |
| 10.0 | 91.0 |
| 1.0 | 50.0 |
| 0.1 | 9.0 |
| 0.01 | 0.99 |
依據上表一般都認為酶測定時底物濃度最好為Km的20倍乃至100倍。在實際工作考慮到底物溶解度的限制,價格的昂貴,可將底物濃度降為Km的10倍。再低就不適合酶的測定,可能產生較大誤差。
以上規律適用於大多數酶。一些酶還有其特殊情況,常能遇到的是當底物濃度增加到一定範圍後,酶反應速度不僅不增加,反而下降。如乳酸脫氫酶,當丙酮酸濃度超過一定量時,酶活性反而下降,故丙酮酸濃度不能過高。
以上介紹的米-門方程式只適用於單一底物的酶,不少酶催化反應二底物乃至更多底物,有關二底物的米-門方程以及此時底物濃度的選擇可參考一些有關書籍。實際工作中最簡單的作法是先將其中底物之一的濃度選得很高,使酶飽和,然後求出另一底物的表觀Km,反之亦然,最後按上述規律決定二底物的合適濃度。
(二)輔因子、活化劑的種類和濃度
從廣義上說,凡能促進酶及反應物進入活化狀態從而加速酶催化反應的物質都能稱為輔因子,它包括種類很廣的物質。英漢生化詞典將輔因子(cofactors)定義為「一種酶的活性所需要的一種非蛋白質成分」。這種輔因子可能是一種金屬離子激活劑或一種有機分子(輔酶)。它們或松或緊地與酶相結合;緊密接合的輔因子稱為「輔基」。將激活劑(activator)定義為「一種金屬離子,作為一種酶的輔助因子。」
在前面已談到,測酶活性濃度時應該在最適條件下測酶反應的最大速度。如測定酶需要輔因子,活化劑時,應選擇合適的種類和濃度加入到測定酶的體系中,在些過程中可能會涉及到下列四類物質。
首先是輔酶(Coenzyme)。很多酶反應都必須有輔酶參加。如相當部分的還原酶需要輔酶Ⅰ(NAD+)和輔酶Ⅱ(NADD+)參加。ATP是激酶(Kinase)反應中不可少的輔酶,這類物質一般是小的有機化合物,和輔基不同點是與酶蛋白結合很鬆弛,用透析和其它方法很易將它們與酶分開,儘管它們不用於酶的底物,特異性不強,往往參加一系列酶反應和代謝過程。但在作用方式上和底物類似,在酶反應過程中與酶結合、分離及反覆循環。在方法學上,可將它們按底物處理,即可按米-門方程式求出其Km,按底物規律選擇其濃度。
第二是輔基,輔基雖也是小的有機化合物,但卻是酶蛋白不可分割部分,不含輔基的酶蛋白稱為脫輔基酶蛋白(apoenzyme),沒有催化活性,必須加入足量輔基,和它結合成為全酶(holoenzyme),才可能有催化活性。最典型的例子是各種轉氨酶需要磷酸吡哆醛為其輔基,在反應過程中。胺基酸將其氨基交給吡哆醛變為吡哆胺,本身接受醛基成為酮酸,然後吡哆胺將氨基轉交給酮酸生成胺基酸,本身又變回吡哆醛。從此機制不難理解為何脫輔基酶蛋白無催化活性。
輔基和輔酶不同點不僅表現在和酶蛋白結合緊密,不易為透析所除去,和酶作用方式也不同,不似輔酶迅速與酶結合,又迅速分解為酶和產物,輔基顯著特點之一是與酶結合需要一定時間,因此在酶測定時,如按底物一樣來處理輔基,在酶反應開始時才加入輔基,則開始階段反應較慢,經過一段延滯期後,反應才達到應有速度。因此在酶測定時,往往是先加入足量輔基,作用一定時間如10分鐘後,再加入底物開始酶反應。
很多輔酶和輔基來自維生素或結構中含有維生素,如NAD和NADP來自維生素尼克酸,轉氨酶的輔基磷酸吡哆醛來自維生素B6(吡哆醇)。來自維生素B1的焦磷酸硫胺素是丙酮酸脫羧反應的輔羧化酶。從維生素B2(核黃素)形成的FAD,FMN是很多呼吸鏈上酶的輔基,維生素H(生物素)在羧化和脫羧作用中起輔基作用,葉酸衍生物參與一碳基團的轉移。維生素B12的衍生物鈷胺醯胺參與酶催化的異構反應。
第三類物質是離子,很多酶需要特定離子幫助才能使其反應達到最大速度。最常見的是二價金屬離子如Mg2+、Zn2+、Mn2+、Ca2+、Fe2+等。所有轉移磷酸的酶,如激酶類和鹼性磷酸酶的反應都需要Mg2+的參加。所以如在反應體系中加入金屬螯合劑如ED-TA或以他們為抗凝劑常抑制一些酶的活性。因此酶測定的標本多採用血清而不採用血漿,以外還有單價的K+。如丙酮酸激酶反應同時需要K+和Mg2+。澱粉酶催化的反應需要陰離子Cl-,5mmol/L氯離子可加速澱粉酶的反應三倍。
離子加速酶反應的機制是多種多樣,Zn2+是鹼性磷酸酶和羧基肽酶A整體結構的一部分,可穩定酶的三級和四級結構。Cl-加速澱粉酶反應的機制可能與它能與酶分子中某些帶陽電荷基團結合有關,改變了在催化作用中起重要作用的基團的電離常數,有些離子可使酶分子帶陽電荷,和帶陰性電荷的底物結合,在酶反應中起了橋樑作用。必須注意的是,過量的離子往往抑制酶反應速度,在測定酶時要選擇合適的濃度。
第四類是一些無法包括在前三類的其它加速酶反應物質,如巰基化合物可穩定酶的雙硫鍵。在肌酸激酶反應體系中加入它將明顯增高酶活性,並且隨所加巰基化合物的不同,增加的速度也有差異,所以在測肌酸激酶時要選擇好巰基化合物的種類與合適的濃度。
還有所謂的表觀激活作用,該物質並不是真正加快反應速度,而是由於和抑制劑作用抵消了抑制作用,從表面上看似乎是加速了酶的反應作用。
(三)選變構劑的種類與濃度
有一類特殊的酶叫變構酶(allosteric enzyme),其反應速度和底物關係不同於一般酶的雙曲線,而出現S形曲線,這是由於這種酶具有二個或更多個獨特的部位-或是相互作用的催化部位,或是相互作用的催化部位與調節部位,其結果是酶與底物作用速度將受另一類物質的影響,這類物質命名為變構劑或效應物。根據作用不同又分為變構激活劑和變構抑制劑或者正負效應物,而不同濃度的變構劑會明顯改變曲線形狀。變構酶在物質代謝中有重要的調節作用。在測定變構酶活性濃度時,必須選擇好變構劑種類和濃度。一般來說應選擇在飽和濃度的變構劑的條件下測定構酶的活性濃度。
| 關於「臨床生物化學/底物、輔因子、活化劑、變構劑的種類和濃度」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |