逆轉錄病毒
| A+醫學百科 >> 逆轉錄病毒 |
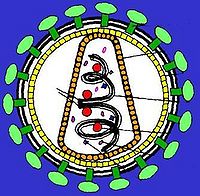
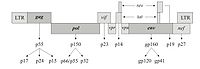
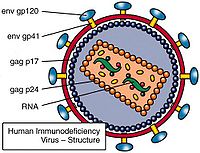
逆轉錄病毒即RNA病毒,需在逆轉錄酶的作用下首先將RNA轉變為cDNA,新合成的cDNA插入宿主的核DNA中,隨宿主DNA複製、轉錄、翻譯達到擴增目的的一類病毒。逆轉錄病毒是RNA病毒,它有三個結構蛋白基因:gag-編碼病毒衣殼、基質等結構蛋白的基因;pol-編碼逆轉錄酶(p66/p51)、
蛋白水解酶和整合酶;env-編碼gpl20和gp41兩種包膜糖蛋白。有的逆轉錄病毒還帶有癌基因(vonc),即有的逆轉錄病毒有致癌作用。近年來,已設計構建成一些缺陷型病毒(defective virus)使逆轉錄病毒成為有用的基因載體,成功地把抗藥性基因轉入了人體造血前體細胞,並在細胞中表達。Hock等選用了缺失編碼病毒外殼蛋白基因的逆轉錄病毒,因此不能合成自身的外殼,但它有識別外殼蛋白進行包裝的信號(一段尚未鑒定的DNA順序)。用這種缺陷的逆轉錄病毒去感染某種細胞株,這種細胞株包含有輔助病毒(helper virus)。輔助病毒能合成蛋白外殼,但缺失了識別蛋白外殼進行包裝的信號,因此它不能包裝成病毒顆粒。當用逆轉錄病毒感染細胞株後,逆轉錄病毒的RNA進入輔助病毒的外殼蛋白,成為病毒顆粒。這時把受感染的細胞同骨髓細胞一起培養,包裝在輔助病毒外殼蛋白中的逆轉錄病毒RNA,進入骨髓細胞,病毒DNA插入宿主細胞基因組,基因的活性得到表達。這時,由於骨髓細胞裡面沒有輔助病毒,所以整合進宿主基因組的逆轉錄病毒,不再有外殼蛋白可供包裝,因此也就無法增殖,而只能被「陷」在宿主基因組中,通過細胞分裂而傳給下一代子細胞。
1970年科學家在致癌RNA病毒中發現一種特殊的RNA病毒聚合酶,該酶能以RNA為模板,根據鹼基互補原則,合成cDNA。這一過程與一般病毒轉錄方向相反,故稱逆轉錄,催化此過程的酶稱為逆轉錄酶,後來發現在哺乳動物的胚胎細胞和正分裂的淋巴細胞也含有。
逆轉錄病毒又稱為攜帶逆轉錄酶的病毒,它先侵入宿主細胞以病毒RNA為模板,靠酶形成DNA環化,然後合到宿主細胞的染色體中去以原病毒形式在宿主細胞中一代代傳下去。
目錄 |
逆轉錄病毒分類
逆轉錄
按照目前國際病毒分類標準,逆轉錄病毒科分為7個屬:
α逆轉錄病毒屬 Alpharetrovirus
β逆轉錄病毒屬 Betaretrovirus
γ反轉錄病毒屬 Gammaretrovirus
δ反轉錄病毒屬 Deltaretrovirus
ε反轉錄病毒屬 Epsilonretrovirus
慢病毒屬 Lentivirus
泡沫病毒屬 Spumavirus
其中的慢病毒屬又分為5個組,包括牛慢病毒組、馬慢病毒組、貓慢病毒組、羊慢病毒組和人類慢病毒組。HIV在病毒「大家族」中的定位是逆轉錄病毒科慢病毒屬中的人類免疫缺陷病毒組。
逆轉錄病毒和基因治療
從1990年國施行第一例基因治療計劃到目前為止,全世界共有幾百例臨床計劃在實施中。當初人們對基因治療普遍寄予厚望,但結果卻往往不盡如人意。人們意識到在基因組、基因的表達調控及疾病發生的機理沒有徹底闡明之前,基因治療還很難取得突破性進展。但基因治療的出現,畢竟給我們治療一些用傳統療法難以治癒的疾病帶來了新的希望。
逆轉錄病毒載體
逆轉錄病毒的許多特點使其成為基因轉移載體的上佳選擇。最重要的一點是它可以有效的整合入靶細胞基因組並穩定持久地表達所帶的外源基因。病毒基因組以轉座的方式整合,其基因組不會發生重排,因此所攜帶的外源基因也不會改變。而另一類整合載體——腺相關病毒,以同源重組的方式整合,整合過程中病毒基因組發生重排,可能會影響到外源基因的結構與功能
如果能實現有效的基因轉移,基因治療在對付遺傳性疾病、減緩腫瘤發展、戰勝病毒性感染和終止神經系統退行性病變等方面都會有廣闊的應用前景。這就要求在載體改造、載體的靶向性、外源基因的表達調控等諸多方面取得顯著進展。基因轉移載體可分兩大類:病毒性載體和非病毒性載體。非病毒性載體的方法包括裸DNA注射、基因槍法、多聚賴氨酸或陽離子脂質體包裹DNA法等。一般非病毒性載體毒性成分少,且較安全。但它們存在共同的弱點:效率低且攜帶基因表達時間短。所以目前研究仍是一些病毒性載體,如逆轉錄病毒、腺病毒、腺相關病毒、慢病毒等。逆轉錄病毒應用最早,研究也相當成熟,目前仍被廣泛應用。慢病毒也是一類逆轉錄病毒,它表現出的一些特點使人們對其逐漸產生了興趣。逆轉錄病毒的許多特點使其成為基因轉移載體的上佳選擇。最重要的一點是它可以有效的整合入靶細胞基因組並穩定持久地表達所帶的外源基因。病毒基因組以轉座的方式整合,其基因組不會發生重排,因此所攜帶的外源基因也不會改變。而另一類整合載體——腺相關病毒,以同源重組的方式整合,整合過程中病毒基因組發生重排,可能會影響到外源基因的結構與功能。
逆轉錄病毒的靶向性
逆轉錄病毒可以與多種細胞表面蛋白結合而進入細胞,其宿主細胞範圍很廣。逆轉錄病毒的親嗜性存在物種之間的差異,據此可將其分為三類:(1)單嗜性逆轉錄病毒(ectropic retrovirus),只感染小鼠和少數幾個品種的大鼠;(2)兼嗜性逆轉錄病毒(amphotropic retrovius),能感染小鼠的細胞,也能感染其他種屬動物的細胞;(3)異嗜性逆轉錄病毒(xenotropic retrovirus),能感染多種動物細胞,但不能感染小鼠細胞。目前使用較多的是兼嗜性逆轉錄病毒,即以兼嗜性包裝細胞包裝病毒顆粒。逆轉錄病毒的宿主範圍由病毒顆粒表面的包被蛋白(Env)決定,病毒基因組不影響其靶向性,不同的基因組可用相同的Env包被,且Env來自何種病毒,包裝出的病毒顆粒就叫該病毒的假病毒。
通過改變Env蛋白可以改變載體的靶向性。如用水泡性口炎病毒的G蛋白包裝逆轉錄病毒基因組產生假病毒(pseudotype),可拓展逆轉錄病毒的靶細胞範圍並賦予病毒顆粒新的特性。兼嗜性逆轉錄病毒一般結合細胞表面的磷酸轉運體而進入細胞,但有一些重要的靶細胞:淋巴細胞、早期造血幹細胞磷酸轉運體的表達水平很低,而導致載體對其轉導效率低下。G蛋白包裝的假病毒則得有效感染這些細胞。這種假病毒還可以用超速離心進行濃縮達到很高的滴度(109 cfu/ml),普通的逆轉錄病毒只能達到106 cfu/ml;G蛋白還能抵抗人類補體的滅活作用,使其適於作體內(in vivo)的基因轉移。
為提高逆轉錄病毒感染靶細胞的特異性,還可以在原來的病毒Env蛋白上接上一段具有特異靶向的多肽,目前應用較多的是單鏈可變區抗體(scFv)。如Martin等設計的特異靶向黑色素瘤細胞的逆轉錄病毒。他們在病毒包被糖蛋白的表面結構域(SU)上依次接上間質金屬蛋白酶的酶切位點、一段富含脯氨酸的肽段及一段特異識別高分子量黑色素瘤相關抗原(HMW-MAA)的SCFU。90%的人黑色素瘤細胞高水平表達HMW-MAA這一穿膜分子,而絕大多數成人組織不表達。富含脯氨酸的肽段則暫時阻端SU和磷酸轉運體的結合。腫瘤細胞表面還有高表達的間質金屬蛋白酶,它在腫瘤細胞對正常組織的侵入中發揮重要作用。這樣改造過的載體在SCFV的導向下達到腫瘤部位,腫瘤細胞表面的金屬蛋白酸切去SU上的SCFV和脯氨酸肽段,SU和腫瘤細胞表面的磷酸轉運體結合,進入腫瘤細胞,從而大大提高了載體靶向的特異性。
逆轉錄病毒載體感染非分裂細胞的探索
具有感染終末分化細胞的能力,高的轉導效率和持續且可控制的基因表達是理想的基因治療載體的三大特點。逆轉錄病毒雖具有後面兩個優點,但不能感染非分裂細胞如肌肉、大腦、肺及肝組織中的這些可以做為基因治療靶細胞的重要細胞。由於逆轉錄病毒的複製特點,它感染細胞時,細胞分裂需處於DNA合成階段。因此有人嘗試使用組織損傷或部分切除來誘導靶細胞分裂。例如肝臟部分切除可以極大地提高逆轉錄病毒在肝內的轉導效率。
還有一種途徑是利用一些基因的產物來誘導間歇期細胞進行DNA複製來增強逆轉錄病毒的感染。SV40的大T抗原可以誘導終末分化的肌肉細胞進行DNA複製和細胞分裂。表達溫度敏感的大T抗原的肝細胞可被逆轉錄病毒高效感染。用巨噬細胞集落刺激因子(GMCSF)預先刺激間歇期細胞也可以大大增強逆轉錄病毒載體的感染效率。
逆轉錄病毒載體表達的調控
有人用ex vivo的方法,在肌細胞中表達IX因子,治療小鼠血友病B。發現感染細胞回輸小鼠後5~7d,IX因子的表達即被「關閉」了。證明不是由於細胞丟失、基因刪除或免疫機制的原因。而可能是由於持續表達的外源基因誘導機體對其進行修飾而失去表達,因此要求基因在誘導物的作用下短暫表達,目前使用較多的有四環素誘導調控系統和雌激素誘導調控系統等。除此之外增強與啟動子的正確組合也能避免基因表達被關閉。仍以上例,若用ATP肌酸磷酸轉移酶的增強子——啟動子來控制外源基因表達,只能得到低水平的表達,換用ATP肌酸磷酸轉移酶增強子——巨細胞病毒啟動子的嵌合載體,外源基因的表達可以持續兩年。尋找載體調控元件的合理組合需長期摸索,在多基因載體中這種任務顯得更加艱巨。
|
||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||
| 關於「逆轉錄病毒」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |