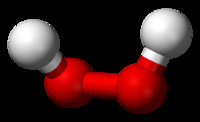
過氧化氫
| A+醫學百科 >> 過氧化氫 |
過氧化氫(hydrogen peroxide )化學式是H₂O₂,為強氧化劑,其水溶液名稱為雙氧水 。雙氧水具有消毒、防腐、除臭及清潔作用,用於清洗創面、潰瘍、膿竇、耳內膿液;塗搽治療面部褐斑(肝斑);在換藥時用以去痂皮和粘附在傷口上的敷料(可減輕疼痛);稀釋至1%濃度用於扁桃體炎、口腔炎、白喉等的含漱。
除用於有惡臭不潔的創面外,尤適用於厭氣菌感染以及破傷風、氣性壞疽的創面,用3%溶液沖洗或濕敷,根據情況每日可多次使用。詳細參看過氧化氫溶液條目。
CAS No.: 7722-84-1
EINECS登錄號:231-765-0
目錄 |
分子
分子式:H₂O₂
分子結構:O原子以sp3雜化軌道成鍵、分子為共價極性分子。
相對分子質量: 34.01
H.O兩種元素的質量比:1×2:16×2=2:32=1:16
物理特性
外觀與性狀: 水溶液為無色透明液體,有微弱的特殊氣味。純過氧化氫是淡藍色的油狀液體。
主要成分:工業級 分為27.5%、35%兩種。
熔點(℃):-0.89℃(無水)
沸點(℃):152.1℃(無水)
折射率:1.4067(25℃)
相對密度(水=1): 1.46(無水)
飽和蒸氣壓(kPa): 0.13(15.3℃)
溶解性:能與水、乙醇或乙醚以任何比例混合。不溶於苯、石油醚。
結構:H-O-O-H 沒有手性,由於-O-O-中O不是最低氧化態,故不穩定,容易斷開
溶液中含有氫離子,而過氧根在氫離子的作用下會生成氫氧根離子,其中氫離子濃度大於氫氧根離子濃度。
燃爆危險: 本品助燃,具強刺激性。
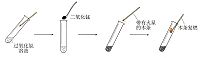
1.取5ml5%的過氧化氫溶液於試管中,將帶火星的木條伸入試管中,木條沒有復燃。
2.取5ml5%的過氧化氫溶液於試管中,加熱,再將帶火星的木條伸入試管中,木條復燃。
3.取5ml5%的過氧化氫溶液於試管中,加入少量二氧化錳,再將帶火星的木條伸入試管中,木條復燃。二氧化錳做催化劑,和過氧化氫反應生成氧氣和水。
化學特性
1、 過氧化氫的分子結構 過氧化氫是含有極性鍵和非極性鍵的極性分子,其結構式為H—O—O—H,電子式為:H:O:O:H 2、 過氧化氫的物理性質 過氧化氫是一種無色黏稠的液體,它的水溶液俗稱雙氧水。 3、 過氧化氫的化學性質
(1)H₂O₂是二元弱酸,具有酸性
(2)氧化性 H₂O₂+ 2KI + 2HCl ==== 2KCl + I₂+ 2H₂O
2Fe2+ + H₂O₂+ 2H+ ==== 2Fe3+ + 2H₂O
H₂O₂+H₂S ==== S↓+ 2H₂O H₂O₂+ SO₂==== H₂SO₄
註:在酸性條件下H2O2的還原產物為H2O,在中性或鹼性條件其還原產物為氫氧化物.
(3)還原性 2KMnO₄+ 5H₂O₂+ 3H₂SO₄ ==== 2MnSO₄+ K₂SO4 + 5O₂↑+ 8H₂O
H₂O₂+Cl₂=2HCl + O₂ 註:H₂O₂的氧化產物為O₂
(4)不穩定性 4、 H₂O₂的保存方法 實驗室里常把H₂O₂裝在棕色瓶內避光並放在陰涼處。 5、 H₂O₂的用途 作消毒、殺菌劑,作漂白劑、脫氯劑,純H₂O₂還可作火箭燃燒的氧化劑等。
電解反應
電解雙氧水會生成臭氧和水,同時水又生成氫氣和氧氣。
分步反應化學方程式:
一、3H₂O₂==通電== 3H₂O + O₃↑
二、2H₂O ==通電== 2H₂↑+ O₂↑
總反應化學方程式為:
6H₂O₂=(通電)=6H₂↑+2O₃↑+3O₂↑
註:首次生成的臭氧顏色為橙黃。
主要用途
在不同的情況下可有氧化作用或還原作用。可用氧化劑、漂白劑、消毒劑、脫氯劑,並供火箭燃料、有機或無機過氧化物、泡沫塑料和其他多孔物質等。
醫用雙氧水(3%左右或更低)是很好的消毒劑 。
工業用是10%左右用於漂白,作強氧化劑,脫氯劑,燃料等。
實驗用做制O₂原料。
健康危害
最重要危害與效應:
急性:
吸入:蒸氣會造成眼睛、鼻子及喉嚨之刺激感。
皮膚接觸:會造成刺痛及暫時性變白,沖洗乾淨2-3小時會恢復,殘留會造成紅腫及起泡。
眼睛接觸:會造成嚴重之傷害及有目盲之可能性,此症状可能歷時一周或更久才出現。
吞食:會傷害胃及喉嚨,可能導致食道及胃出血。
慢性:
吸入:導致慢性呼吸道器官疾病。
皮膚接觸:導致皮膚病。
眼睛接觸:導致眼疾。
主要症状:刺激感、皮膚刺痛及暫時性變白、紅腫、起泡、眼疾、胃出血。當為腐蝕性傷害時,嚴重時可造成失明、組織壞死、肺水腫。
危險特性
爆炸性強氧化劑。過氧化氫本身不燃,但能與可燃物反應放出大量熱量和氧氣而引起著火爆炸。過氧化氫在pH值為3.5~4.5時最穩定,在鹼性溶液中極易分解,在遇強光,特別是短波射線照射時也能發生分解。當加熱到 100℃以上時,開始急劇分解。它與許多有機物如糖、澱粉、醇類、石油產品等形成爆炸性混合物,在撞擊、受熱或電火花作用下能發生爆炸。過氧化氫與許多無機化合物或雜質接觸後會迅速分解而導致爆炸,放出大量的熱量、氧和水蒸氣。大多數重金屬(如鐵、銅、銀、鉛、汞、鋅、鈷、鎳、鉻、錳等)及其氧化物和鹽類都是活性催化劑,塵土、香煙灰、碳粉、鐵鏽等也能加速分解。濃度超過74%的過氧化氫,在具有適當的點火源或溫度的密閉容器中,能產生氣相爆炸。
應急處理:迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。小量泄漏:用砂土、蛭石或其它惰性材料吸收。也可以用大量水沖洗,洗水稀釋後放入廢水系統。大量泄漏:構築圍堤或挖坑收容。噴霧狀水冷卻和稀釋蒸汽、保護現場人員、把泄漏物稀釋成不燃物。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
雙氧水的作用是什麼?
雙氧水是一種每個分子中有兩個氫原子和兩個氧原子的液體,具有較強的滲透性和氧化作用,醫學上常用雙氧水來清洗創口和局部抗菌。據最新研究發現,雙氧水不僅是一種醫藥用品,還是一種極好的美容佳品。
面部皮膚直接接觸外界環境,常被細菌、灰塵等污染,再加上皮膚本身的汗腺、皮脂腺分泌物形成的污垢,極易誘發粉刺、皮炎、癤腫等疾病,從而影響皮膚的美麗。用雙氧水敷面不僅能去除皮膚的污垢,還能直接為皮膚增強表面細胞的活性,抑制和氧化黑色素的沉著,使皮膚變得細膩有彈性。操作方法:將臉用洗面奶洗乾淨後,用毛巾蘸上3%的雙氧水敷於面部,每次5分鐘,每日1次,10天為一療程,在操作時應注意避免雙氧水進入眼睛。
用雙氧水做美容,一定要事先徵求皮膚科醫生的意見,直接用雙氧水美白是相當危險的。雖然會讓皮膚短時間內變白,但時間長了卻會對皮膚造成強烈刺激,嚴重的可能燒壞表皮層,讓皮膚變粗糙、長皰。
另外,雙氧水還有淡化毛髮顏色的功能,對於那些因汗毛過長而影響美觀的女性,可在脫毛後,用雙氧水直接塗於皮膚上,每日2次,這樣日後長出的汗毛就不會變黑變粗,而會變得柔軟且顏色為淡黃。
過氧化氫曾作為染髮劑的2號劑(氧化劑)的成分之一,但因其對人體有害,故現已被淘汰。
此外,在實驗室,常用雙氧水和二氧化錳混合制氧氣。
過氧化氫製取氧氣化學方程式:
2H₂O₂+ MnO₂== 2H₂O + O₂↑
常被不法商販使用
過氧化氫溶液,俗稱雙氧水,為無色無味的液體,添加入食品中可分解放出氧,起漂白、防腐和除臭等作用。因此,部分商家在一些需要增白的食品如:水發食品的牛百葉和海蜇、魚翅、蝦仁、帶魚、魷魚、水果罐頭、和面製品等的生產過程中違禁浸泡雙氧水,以提高產品的外觀。少數食品加工單位將發霉水產干品經浸泡雙氧水處理漂白重新出售或為消除病死雞、鴨或豬肉表面的發黑、淤血和霉斑,將這 些原料浸泡高濃度雙氧水漂白,再添加人工色素或亞硝酸鹽發色出售。過氧化氫可通過與食品中的澱粉形成環氧化物而導致癌性,特別是消化道癌症。另外,工業雙氧水含有砷、重金屬等多種有毒有害物質更是嚴重危害食用者的健康。FAO(聯合國糧食及農業組織)和WHO(聯合國世界衛生組織)根據其毒性試驗報告規定,過氧化氫僅限於牛奶防腐的緊急措施之用。我國《食品添加劑使用衛生標準》亦規定雙氧水只可在牛奶中限量使用,且僅限於內蒙古和黑龍江兩地,在其它食品中均不得有殘留。
影響雙氧水漂白的因素
濃度、溫度、時間、PH值等因素是化學反應的主要條件。在雙氧水漂白的工藝中,應該弄清這些因素的相互關係,以便制定合理的工藝。
1、濃度
雙氧水漂白所規定的合理濃度,應該以既能達到一定白度和去除棉籽殼的效果,又要使纖維損傷最小為原則。實踐證明,織物白度和雙氧水濃度的關係不是成正比的。當採用汽蒸工藝時,濃度控制在3-5g/L已能達到一定的白度要求,濃度再高,白度增加不多,相反容易損傷纖維。因此,汽蒸工藝濃度一般為3-5g/L,稀薄織物還應適當低些。具體確定時應根據使用設備、漂白方式、織物厚薄、退漿煮練狀況以及浴比等決定。為了儘可能減少對纖維的損傷,濃度以低為宜,要得到較高的白度,應在煮練上採取措施。
2、溫度
溫度對雙氧水的分解速度有直接的關係。在一定濃度和時間的條件下,織物上雙氧水的分解消耗是隨著溫度的升高而增加的,因此,織物的漂白效果是隨雙氧水在織物上分解率的增高而增高的。當溫度達到90—100℃時,雙氧水可以分解90%,白度也最好;但是當溫度為60%時,分解率僅為50%左右。
3、時間
雙氧水漂白時間的確定與溫度有關。如果用冷漂法,要室溫堆置10h左右,高溫汽蒸漂白時間卻可以大大縮短。從測定雙氧水消耗率看,汽蒸15min已達到70%,汽蒸45—60min,消耗率已達到90%,並趨於平衡。可見汽蒸時間45—60min就已夠了。
4、鹼劑
常規漂白中漂液PH值為10.5~11,加水玻璃尚不能達到要求,因此要加鹼劑調節PH值,最常用的鹼劑為燒鹼,用量為1—2g/L。它是活化劑,能促進雙氧水的分解,使雙氧水生成具有漂白作用的過氧化氫離子,在PH值為10.5~11情況下,雙氧水以中速分解達到漂白的目的。但在退煮漂與煮漂一浴法短流程工藝中,燒鹼的用量均較高,燒鹼不僅調節PH值,還兼退漿和煮練的功能。這就使漂浴很不穩定,加速了雙氧水的分解,不僅浪費雙氧水,而且可能導致纖維降解使織物脆損。為了控制雙氧水的分解速率,前已述及要加入適合的穩定劑,使雙氧水按工藝要求來分解,並在分解與穩定之間達到平衡,這就是在穩定劑幫助下的「受控雙氧水漂白工藝」,採用此工藝既能取得較好的織物白度及去雜效果,又不至於對纖維造成較大的損傷。
雙氧水工業製法一
生產鹼性過氧化氫的空氣電極及其製法
本發明屬於用電化學方法製備無機化合物的領域。本發明涉及工業製備鹼性過氧化氫用含醌空氣電極及其製法。本發明多組元電極組由單元極板組裝,每對電極由陰極板,含醌空氣陰極碳芯、離子交換隔膜,塑料支撐網與陽極板組成,在電極工作區的上下端設有流體分配室和收集室,在流體進口處設有節流孔,多組元電極採用有限制的偶極串聯,將陽極循環鹼水所用塑料軟管延長至5米以上。本發明可在直接使用低壓空氣的情況下製備鹼性過氧化氫並得到滿意的工作指標,不存在電極受鹼水浸透而失效的缺點。
生產鹼性過氧化氫用含醌空氣電極,其特徵在於每對電極由陽極板、塑料網、陽離子隔膜和含醌空氣陰極組成,在電極工作區的上、下端設有進入流體的分配室和排出流體的收集室,在流體進口處設有節流孔,多組元電極採用有限制的偶極串聯接法,加長陽極循環鹼水進、出口用的塑料軟管後再接至集液總管,多組元電極組由單元極板組裝。
雙氧水工業製法二
本發明涉及無機化合物製備領域,特別涉及從申請號為871 03988專利申請中所得陰極產物的過氧化鈉水溶液製備過 氧化氫的方法。用磷酸或磷酸二氫鈉將過氧化鈉水溶液中和至 pH9.0~9.7,使生成Na₂HPO₄和H₂O₂,將所說的Na₂HPO₄和H₂O₂水溶液冷卻到+5~-5℃,使絕 大部分Na₂HPO₄以Na₂HPO₄ .10H₂O水合物形式析出,再在離心分離器 中將含有Na₂HPO₄ . 10H₂O水 合物和過氧化氧水溶液混合物進行分離,分離出該水合物,隨 後再對含有少量Na₂HPO₄ 的過氧化氫水溶 液進行蒸發和分餾,得到約30%H₂O₂產品 。
權利要求:
製備過氧化氫的方法,其特徵在於,用下列步驟從過氧化鈉水 溶液製備: (1)用磷酸或磷酸二氫鈉NaH₂PO₄將過氧化鈉水溶液中和至9.0~9.7,使 生成Na₂HPO₄和H₂O₂的水溶液, (2)使所說的Na₂HPO₄和 H₂O₂水溶液冷卻到+5~-5℃,從而使絕 大部分Na₂HPO₄以Na₂HPO₄ .10H₂O水合物形式析出, (3)在離 心分離器中對含有Na₂HPO₄ .10H₂O水合物和過氧化氫水溶液混合物進行分離,從而使Na₂HPO₄ .10H₂O結晶從含少量Na₂HPO₄ 的過氧化氫水溶液中分離出來, (4)將所說的含少量Na₂HPO₄ 的過氧 化氫水溶液在蒸發器中蒸發,得到含H₂O₂和H₂O的蒸汽,而含過氧化氫的Na₂HPO₄ 濃鹽溶液從底部流出並返回中和槽, (5)將所說 的含H₂O₂和H₂O的蒸汽在分餾塔中 進行減壓分餾,得到約30%H₂O₂產品。
雙氧水工業製法三
用電解60%的硫酸,得到過二硫酸,再經水解可得濃度為95%的雙氧水。
包裝:裝於聚乙烯桶內,容器蓋上應有排氣孔,外套木箱,每桶淨重20kg。
儲運注意事項:屬於一級無機酸性腐蝕品物品,本品應儲存在陰涼、清潔、通風的庫房內,庫溫不宜超過30℃,避免日光照射。容器要蓋緊,但通氣孔要暢通,防止灰塵堵塞,灰塵落入其中易分解變質。隔絕熱源與火種,不可與有機物或鐵、銅、鉻等金屬及其鹽類共儲混運。搬運時穿工作服、戴口罩、手套。誤觸皮膚,用水沖洗乾淨,觸及眼睛用溫水沖洗。本品不宜久儲,平時加強檢驗,發現漏桶及時換桶,如遇墊倉木冒煙,應立即將冒煙的墊倉木搬出倉外,或用水澆救。
失火時可用水、砂土或二氧化碳滅火器撲救。
過氧化氫的製備
1. 實驗室製備:
實驗室里可用稀硫酸與BaO₂或Na₂O₂反應來製備過氧化氫:
BaO₂+ H₂SO₄==== BaSO₄↓+ H₂O₂
Na₂O₂+ H₂SO₄+ 10H₂O ==== Na₂SO₄ .10H₂O↓ + H₂O₂過濾後的溶液含6~8%的H₂O₂.
雙氧水的妙用。
當衣服被高錳酸鉀染上顏色後,84泡不掉,唯有用雙氧水可以祛除乾淨。大家不防可以用一下。
| 關於「過氧化氫」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |