生理學/心臟泵功能的調節
| 醫學電子書 >> 《生理學》 >> 血液循環 >> 心臟的泵血功能 >> 心臟泵功能的調節 |
| 生理學 |
|
|
機體在長期進化的過程中, 發生和發展了一套逐步完善的循環調節機構,使循環功能適應於不同生理情況下新陳代謝的需要。這種調節是在複雜的神經和體液機制參與下,通過對心臟和血管活動的綜合調節而實現的(整體調節機制將後述)。本節主要從心臟本身來闡述控制心輸出量的因素的作用機制。
心輸出量取決於心率和搏出量,機體通過對心率和搏出量兩方面的調節來調節心輸出量。
(一)搏出量的調節
心室肌的收縮是面臨著動脈壓(後負荷)的阻擋進行的。等容收縮相內,心室肌收縮首先引起室內壓升高,只有當室內壓升高到超過動脈壓時,心肌纖維才能縮短,心室容積才能縮小,血液才能射出。由此可見,在心率恆定情況下,心室每次收縮的射血量取決於心肌纖維縮短的程度和速度,這決定了心肌收縮產生張力(表現為心室內血液的壓力)的程度和速度。凡是能影響心肌收縮強度和速度的因素都能影響搏出量,而搏出量的調節正是通過改變心肌收縮的強度和速度來實現的。
1.心肌收縮的「全或無」現象心肌細胞和骨骼肌細胞一樣,收縮反應是由肌膜的興奮通過興奮~收縮耦聯觸發引起的;但是,從整塊肌肉來看,在骨骼肌,一個細胞產生的興奮不能擴布到另一個細胞,只有在支配一個肌細胞有神經纖維發放神經波動時,才會出現收縮效應;若發放衝動的神經纖維數目增加,可以引起更多的肌細胞興奮和收縮,整塊肌肉的收縮增強。因此,如果骨骼肌作單收縮,其收縮強度的改變可以來自兩個方面,一是由於單個肌細胞收縮強度的改變,另一原因是參與收縮活動的肌細胞數目發生變化。心肌則不同,相鄰的心肌細胞是由閏盤的特殊結構和特性,興奮可以通過它由一個心肌細胞傳播到另一個心肌細胞。因此,整個心室(或整個心房)可以看成是一個功能上互相聯繫的合胞體,產生於心室某一處的興奮可以在心肌細胞之間迅速傳遞,引起組成心室的所有心肌細胞幾乎同步收縮。從參與活動的肌細胞數目上看,心肌的收縮是「全或無」的。這就是說,心肌據要麼不產生,一旦產生則全部心肌細胞都參與收縮。由此可見,心肌收縮的強度,不象骨骼肌那樣可以因參加活動的細胞數目的不同而改變;各個心肌細胞收縮強度的變化是整塊心肌收縮強度發生的唯一原因。所以搏出量的調節可以從單個心肌細胞收縮功能調控的角度來探討。
2.搏出量的調節搏出量和搏功的調節,是心臟生理中最基本最重要地課題之一,從世紀末、本世紀初以來,眾多學者對此進行了大量實驗研究。50年代中期,Sarnoff對這些研究資料進行詳細分析之後,將搏出量和搏功的調節歸納為:①由初長度改變引起的異長調節,以及②由心肌收縮能力改變引起的等長調節等方式。
(1)異長調節:前已述,控制骨骼股收縮強度和速度的一個重要因素就是肌肉本身的初長度,而初長度是被動地由該肌肉收縮前所隨的負荷(前負荷)所決定的。前負荷和初長度對肌肉收縮強度和作功能力的影響是雙相的,構成的長度~張力曲線類似拋物線,在前負荷和初長度達最適水平之前,肌肉收縮強度和作功能力隨前負荷~初長度的增加而增加;超過最適水平,收縮效果將隨前負荷~初長度的繼續增加而降低(圖4~3)。
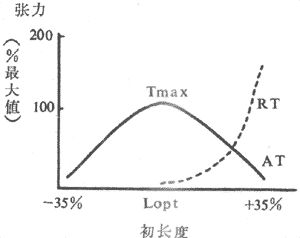
圖4~3 骨骼肌的長度~張力曲線
AT:主動張力 RT:靜息張力(被動張力)
Tmax:最大張力 Lopt:最適初長
在心肌,初長度同樣是控制收縮功能最重要的因素,不過,初長度和收縮功能的關係具有某些特殊性。為了分析前負荷和初長度對心臟泵血功能的影響,可以在實驗中逐步改變心室舒張末期壓力(亦稱充盈壓)和容積(相當於前負荷或初長),並測量射血心室的搏功或等容心室的室內峰壓,將一系列搏功或室內峰壓數據對應心室舒張末期壓力和容積,繪製成坐標圖,即為心室功能曲線(圖4~4)。心室功能曲線大致可分為三段:①充盈壓1.6~2kPa(12~15mmHg)是人體心室最適前負荷,位於其左側的一段為功能曲線升支,它與骨骼肌長度~長力曲張升支段相似;均表明當前負荷~初長度未達最適水平之前,搏功或等容峰壓隨初長度的增加而增加,通常情況下,左室充壓約0.7~0.8kPa(5~6mmHg),可見正常心室是在功能曲線的升支段工作,前負荷~初長度尚遠離其適水平.這一特徵表明心室具有較大程度的初長度貯備,心室通過前負荷~初長度的增加即異長調節機制使泵血功能增強的容許範圍是很寬的.而體內骨骼肌的自然長度已經接近最適長度,前負荷~初長度貯備很小,通過初長度調節其收縮功能的範圍也很小;②充盈壓2~2.7kPa(15~20mmHg)範圍內,曲線逐漸平坦,說明前負荷在上限範圍內變動時對泵血功能的影響不大;③隨後的曲線呈平坦狀,或輕度下傾,並不出現明顯的降支,這一點明顯不同於骨骼,說明正常心室充壓即使超過2.7kPa(20mmHg),搏功不變或僅輕度減少,只有在民生嚴重病理變化的心室,功能曲線才出現降支。
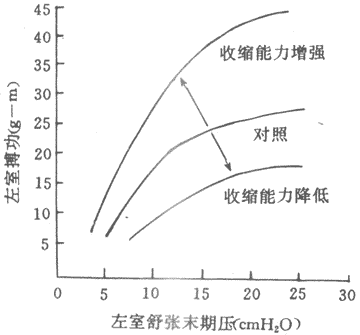
圖4~4 心室功能曲線(lcmH2O=0.098kPa)
在一組心肌肌小節標本上的研究表明,在心室最適前負荷和最適初長度時,肌小節初長度為2.0~2.2μm,這正是肌小節的最適初長度,粗細肌絲處於最佳重疊狀態。這種情況下,肌小節等長收縮產生的張力最大。達最適水平之前,隨著前負荷和肌小的初長度的增加,粗細肌絲有效地重疊的程度增加,激活時可能形成的橫橋聯接的數目相應增加,肌小節以至整個心室的收縮強度增加,搏出量和搏功增加。由此可見,心室功能曲線的升支正是肌小節初長度~主動張力關係的升支在整個心室功能上的一種反映。在搏出量的這種調節機制中,引起調節的因素是心肌細胞本身初長度的改變,其效應是心肌細胞收縮強度的改變,因些將這種形式的調節稱為異長調節。
為什麼骨骼肌的長度~張力曲線出現降支,而正常心室的功能曲綞不再現降支?已知,一個具有彈性的物質受到外力作用時,一方面可被拉長,隨之產生彈性張力,與此同時,這一個彈性張力又具有阻止它本身被進一步拉長的作用。當骨骼肌處於最適長度即肌小節初長度為2.0~2.2μm的狀態下,所產生的靜息張力較小,繼續增加前負荷,肌細胞可被進一步延伸,肌小節初長度可大大超過2.2μm,肌絲重疊程度明顯減小,收縮能力因此下降。但是,由於心肌細胞外間內含有大量勁度較大的膠原纖維,因而心肌的伸展性較小,處於最適初長度時,產生的靜息張力已經很大,從而阻止心肌細胞繼續被拉長。實驗證明,即使在前負荷很大的情況下,心肌肌小節初長度一般也不會超過2.25~2.30μm。心肌細胞這種抵抗過度延伸的特性,對心臟泵血功能具有重要生理意義,它使心臟不致於被在前負荷明顯增加時,引起搏出師長作功能力的下降。心室功能曲線不再現降支,並不是心肌初長度超過最適水平之後心肌的收縮功能依然不受影響,而只是在這種情況下初長度不再與前負荷呈平行關係。而在慢性過度擴張的病理心臟上觀察到的功能曲線降支,是由於室壁心肌發生了組織學改變,心室容積擴大,心肌細胞收縮功能又嚴重損傷的緣故。
既然前負荷~初長度是調節搏出量的主要因素,那麼在體情況下有哪些因素可以影響心室的前負荷和初長度?在心室其它條件(主要是心室肌的順應性)不變的情況下,心室前負荷~舒張末期壓是由心室舒張末期充盈的血液量來決定的,充盈量大,舒張末期容積也較大。可以設想,凡是影響心室充盈量的因素,都能夠通過異長調節機制來使搏出量發生改變。
心室充盈的血量,是靜脈回心血量和心室射血剩餘血量兩者的總和。靜脈回心血量又受下述因素的影響:①心室舒張充盈期持續時間。例如,心率增快時,充盈期縮短,心室充盈不完全,充盈壓降低,搏出量減少;②靜脈迴流速度。在充盈期持續時間不變的情況下,靜脈內血液通過驚訝進入心室的速度愈快,充盈量愈大,搏出量相應增加。靜脈加流速度取決於外周靜脈壓與心房壓和心室壓之差。外周靜脈增高(如循環血量增加、外周靜脈管壁張力增高等情況下)和(或)心房心室壓力降低時,可促進靜脈迴流。心臟每次射血之後的剩餘血液量,也影響心室的充盈量,但是,這種影響是多方面的;如果靜脈回心血量不變,心室剩餘血量的增加將導致部充盈量增加,充盈壓增高,搏出量隨之增加;但另一方面,當心室剩餘血量增加時,心室舒張期內室壓增高,靜脈回心血量將因此減少,總充盈量不一定增加。總之,在心室射血功能不為的情況下,心室剩餘血量的增減對搏出量是否有影響以及發生何種影響,取決於心室總充盈量是否改變以及發生何種改變。
早在1914~1918年,生理學家Starling在哺乳動物身上就觀察到肌纖維初長度對心臟的功能的影響,因此異長調節也稱為Starling機制,心室功能曲線也可稱為Starling曲線。通常,心室射血量與靜脈回心血量相平衡,從而維持心室舒張末期壓力和容積於正常範圍,如果因某種原因造成靜脈回心血量超過射血量,則充盈壓將增高,通過Starling機制增加搏出量使之與迴流量重新達到平衡,否則舒張末期壓力和容積將持續增高而得不到糾正。但Starling機制的主要作用是對搏出量進行精細的調節。例如,當體位改變以及當左右心室搏出量不平衡等情況下所出現的充盈量的微小變化,是通過異長調節機制來改變搏出量使之與充盈量達到平衡的;而對於持續的、劇烈的循環功能變化,例如體力勞動時搏出量持久且大幅度的增高,主要靠心肌收縮能力的變化來調節,這時異長調節機制的作用不大。
(2)等長調節:人們進行強體力勞動時,搏出量和搏功可成倍增加,而此時心臟舒張末期容積不一定增大,甚至有所減小;相反,心力衰竭病人,心臟容積擴大而其作功能力反而降低。由此推測,對於心臟的泵血功能,除異長調節處,還有另一種與心肌初長度無關的調節機制存在。精確的實驗研究表明,將離體心有保持在最適長度情況下,支甲腎上腺素促使心肌等長收縮產生的最大張力和張力上升速率都增加,等張收縮的幅度增大,縮短速度加快,將一系列等長收縮或等張收縮的實驗結果繪製成長度~張力曲線和張力~速度曲張,可以看到,在去甲腎上腺素作用下,長度~張力曲線升支向左上方移位,張力~速度曲張向右上方移位。這些結果表明,處於任何一種初長度下(不只是最適初長度)的心肌,在有去甲腎上腺素的情況下,等長收縮產生的張力都比沒有去甲腎上腺素時為高;後一結果表明,任何一種後負荷情況下,受去甲腎腺素作用的心肌等張收縮的縮短速度增快。完整心室的結果類似:給予去甲腎上腺素後,心肺功能曲線左上移位,表明有同一前負荷~舒末容積條件下,等容心室的峰壓增高,射血心室容積縮小程度增加;室內壓上升速率和射血期容積縮小的速度也能增加。其結果,搏出量和搏功增加,心臟泵血功能明顯加強。另一些因素,如乙醯膽鹼,則引起相反效應。很明顯,上述干預因素引起心肌收縮功能和心臟泵血功能改變的原因並不是初長度的變化,而是通過心肌另一種功能變數起作用的。這種功能變數稱之為心肌收縮能力(myocardial contractility)。心肌收縮能力一般地定義為:心肌不依賴於負荷而改變其力學活動(包括收縮活動的強度和速度)的一種內在特性,因此,心肌收縮能力又稱為心肌變力狀態(inotropic state)。在某些因素作用下,心肌收縮能力發生改變,從而影響心肌細胞學活動的強度和速度,使心臟搏出量和搏功相應發生改變(圖4~4)。心臟泵血功能的這種調節是通過收縮能力這個與初長度無關的、心肌內在功能變數的改變而實現的,故稱等長調節。
心肌收縮能力受多種因素的影響,興奮~收縮耦聯過程中各個環節(參看第二章)都能影響收縮能力,其中活化橫橋數和肌凝蛋白的ATP酶活性是控制收縮能力的主要因素,已知,粗肌絲上的橫橋,只有與細肌絲的肌纖蛋白結合形成橫橋聯接並活化,才能導致肌絲滑行併產生力。在一定初長度的條件下,粗細肌絲的重疊區提供了可以形成橫橋聯接的最大橫橋數,然而不是所有橫橋都會形成活化橫橋。海參化橫橋數與最大橫橋數的比例,取決於興奮後胞漿Ca2+濃度的升高程度和肌鈣蛋白對Ca2+的親和力;凡能增加興奮後胞漿Ca2+濃度(或)肌鈣蛋白Ca2+親和力的因素,均可增加活化橫橋的比例,導致收縮能力的增強。例如兒茶酚胺增加收縮能力的原因之一,就是它通過激活β~腎上腺素能受體,增加胞漿cANP濃度,使肌膜Ca2+通道和肌漿網Ca2+的通道的開放程度增加,導致心肌興奮後胞漿Ca2+濃度升高程度增加。一些鈣增敏劑,如茶鹼,可以增加肌鈣蛋白對Ca2+的親和力使肌鈣蛋白結合形成活化橫橋,肌凝蛋白的ATP酶就被激活,它分解ATP以提供肌絲滑行的能量。甲狀腺激素和體育鍛煉能提高肌凝蛋白ATP酶活性,促進心肌收縮能力增強;相反,老年人的心臟和甲狀腺功能減退患者的心臟,心肌肌凝蛋白分子結構發生改變,其ATP酶的活性較低,收縮能力減弱。
心肌收縮能力的評定:
泵血功能反映的是心室前負荷的後負荷(見後文)、心肌收縮能力及及心率等變數的綜合效果,而心肌收縮能力直接反映心肌本身的功能狀態,收縮能力的改變具有極其重要的生理和病理意義。因此,理論研究和臨床實踐中都需要對收縮能力進行定量測量和評定,以了解收縮能力的水平和變化。由於收縮能力並不是某種可測量的單一變數,因此,對收縮能力的具體度量是比較困難的。衡量泵血功能的指標(如搏出量、搏功等)受前、後負荷影響,並不能直接反映收縮能力的水平,只有根據心肌長度~張力曲線或心室功能曲線的移位來判斷收縮能力的變化(左上移位提示收縮能力增強,右下移位表明收縮能力低下,圖4~4)。但這種評定方法具有操作繁雜、敏感性較低的缺點。目前,常用的方法是採用一系列速度指標來定量評定收縮能力。在離體心肌,最常採用的是張力變化速率(Dt/dt)和長度變化速率(Dl/dt);對完整心室,常採用的指標有:等容相室內壓變化速率(Dp/dt)、射血相心室容積變化速率(dV/dt)或心室直徑變化速率(dD/dt)等,以及心肌纖維收縮成分的縮短程度(VCE)等。這些速度指標受負荷改變的影響較小,對收縮能力的變化比較敏感,為國內外心臟學研究工作者廣泛採用。
(3)後負荷對搏出量的影響:已知,離體肌肉的後負荷對收縮過程產生一定的影響,對心室而言,動脈壓起著後負荷的作用,因此,動脈壓的變化將影響心室肌的收縮過程,影響搏出量。在心率、心肌初長度和收縮能力不變的情況下,如果動脈壓增高,等容收縮相室內壓峰值必然也增高,從而使等容收縮相延長而射血相縮短,同時,射血相心室肌纖維縮短的程度和速度均減小,射血速度減慢,搏出量因此減少。應該看到,後負荷對心肌收縮活動的上述影響,是一種單純機械效應,並不是某種功能調節機制進行調節的結果。從心肌收縮釋放的能量的分配比例上,可以很容易理解這個問題。當心肌收縮能力不變時,收縮釋放的能量是恆定的。如果室內壓力升高,表示心肌產生張力消耗的能量相對增加,用於心肌纖維縮短將相對減少;如果肌肉作等長收縮,釋放的能量幾乎全部用於產生張力。另一方面,也應該看到,由於動脈壓影響了搏出量,又常常繼發地引起一些調節機制的活動。如上述,動脈壓的突然升高首先導致搏出量減少,結果造成心室內剩餘血量增加,充盈量增加,後者又再引起異長調節機制的調節,搏出量可以恢復正常水平,即通過異長調節可以使動脈壓增高所招致的搏出量減少的現象得到糾正。但是,既然通過異長調節,搏出量已經恢復原有水平,那麼,心室的充盈一不是將同時恢復原水平,異長調節的作用被取消,搏出量不是又因高動脈壓狀態的存在而減少了嗎?這就是說,搏出量是否會出現時而降低、時而恢復的現象?許多實驗都證明,隨著搏出題的恢復,心室舒張末期容積確實也恢復到原水平,但此時,搏出量仍然維持高水平,並不出現再次減少的現象。進一步分析發現,後一情況的出現乃是心肌收縮能力增強所致。儘管此時產生的張力隨負荷的增加而有所增加,但縮短的程度不但可以不降低,反而可能增加。至於這種情況下心肌收縮能力為什麼增強,原因尚不十分清楚,可能是神經機液機制調節的結果。
綜上所述,心室後負荷的本身直接著搏出量,隨後通過異長和等長調節機制,使前負荷和心肌收縮能力與後負荷相匹配,從而使機體得在在動脈壓增高的情況下,能夠維持適當的心輸出量。這種情況對於機體是有重要生理意義的。但也應看到,此時搏出量的維持,是心肌加強收縮的結果,如果動脈壓持續增高,心室肌將因處於收縮強狀太而逐漸肥厚,即發生了病理性改變,隨後將導致泵血功能減退。
(二)心率及其對心輸出量的影響
健康成年人的安靜狀態下,心率平均為每分鐘75次(正常範圍為每分鐘60~100次)。不同生理條件下,心率有很大變動,可低到每分鐘40~50次,高達每分鐘200次。
心輸出量是搏出量與心率的乘積,心率增快,心輸出量增加;但這有一定的限度,如果心率增加過快,超過每分鐘170~180次,心室充盆時間明顯縮短,率盈量減少,搏出題可減少到僅有正常時的一半左右,心輸出量亦開始下降。當心率增快但尚未超過此限度時,儘管此時心室充盈時間有所縮短,但由於回心血量中的絕大部分是在快速充盈期內進入心室的,因此,心室充盈量以及搏出量不致於減少或過分減少,而由於心庇護增加,每分鐘的輸出量增加。反之,如心率太慢,低於每分鐘40次,心輸出量亦減少。這是因為心室舒張期過長,心室充盈早已接近限度,再延長心舒時間也不能相應增加充盈量和搏出量。可見,心跳頻率最適宜時,心輸出量最大,心率過快或過慢,心輸出量都會減少。
心率受自主神經的控制,交感神經活動增強時,心率增快;迷走神經活動增強時,心率減慢。影響心率的體液因素主要有循環血液中的腎上腺和去甲腎上腺素,以及甲狀腺素。此外,心率受體溫的影響,體溫升高1℃,心率將增加12~18次。
(三)心臟泵功能的貯備
心臟的泵血功能能夠廣泛適應機體不同生理條件下的代謝需要,表現為心輸出量可隨機體代謝增長而增加。健康成年人靜息狀態下心率每分鐘75次,搏出量約70ml,心輸出量為5L左右。強體力勞動時,心率可達每分鐘180~200次,搏出量可增加到150ml左右,心輸出量可達25~30L,為靜息時的5~6倍。心臟每分鐘能射出的最大血量,稱最大輸出量。它反映心臟的健康程度。由上可以看出,在平時,心輸出量產是最大的,但能夠在需要時成倍地增長,表明健康人心臟泵血功能有一定的貯備力量。心輸出量隨機體代謝需要而增加的能力,稱為泵功能貯備,或心力貯備。健康人有相當大的心力貯備,而某些心臟疾患的病人,靜息時心輸出量與健康人沒明顯差別,尚能夠滿足靜息狀態下代謝的需要,但在代謝活動增強時,輸出量卻不以相應增加,最大輸出量較正常人為低;而訓練有素的運動員,心臟的最大輸出量遠比一般人為主,可達35L以上,為靜息時的8倍左右。
| 關於「生理學/心臟泵功能的調節」的留言: | |
|
目前暫無留言 | |
| 添加留言 | |